佤药娘母良药酒通过抑制凋亡对勃起功能障碍大鼠的机制研究
2023-11-13谢雪华方鹏强温伟波崔换天
赵 杰,罗 艳,谢雪华,陈 瑶,方鹏强,鲍 凯,温伟波,,崔换天
(1.云南省中医医院,云南 昆明,650021;2.沧源佤族自治县班老乡卫生院,云南 临沧,677400;3.沧源佤族自治县工业和科技信息化局,云南 临沧,677400;4.云南中医药大学,云南 昆明,650500)
阴茎勃起功能障碍(erectile dysfunetion,ED)是1 种常见的男性性功能障碍,其特征是无法获得并维持足够的阴茎勃起以进行令人满意的性交,严重影响患者及其伴侣的生活质量[1]。导致ED 的因素主要有器质性因素(神经源性、血管性、糖尿病等)[2]、心理因素(表现焦虑、压力、精神障碍等)[3]、医源性因素(手术损伤引起)[4]、年龄增长(衰老)[5]等。目前临床常用西地那非、他达拉非等药物辅助治疗[6],但越来越多的患者表现出服药效果不佳以及其他不良反应,开发更安全有效的治疗方法迫在眉睫[7]。中医药在防治ED方面表现出了特殊的优势。研究表明,补肾活血方联合他达拉非可以改善海绵体血流情况,改善ED 患者的勃起情况[8]。活血通络起痿汤联合小剂量他达拉非治疗可有效提高ED 患者的国际勃起功能指数评分[9]。马鬃蛇石油醚提取物可抑制阴茎海绵体细胞凋亡以改善ED 大鼠的勃起功能[10]。中药酒是传统医学中防治疾病、强身健体的优良食药产品。娘母良(佤文Nya Miex Tiang 的音译)作为云南佤族的1 种珍奇中草药,其炮制的药酒在佤医临床应用中颇为广泛,对强肾壮阳、安神补脑、暖宫促孕等具有明显功效[11],但其作用机制不明。本文通过双侧髂内动脉结扎法建立ED 大鼠模型,分析娘母良药酒对ED 大鼠的影响,并基于凋亡通路探索其作用机制。
1 方法
1.1 实验动物 SPF 级健康雄性6~8 周龄SD 大鼠,60 只,体质量200~220 g,购买于北京华阜康生物科技股份有限公司,动物许可证号:SCXK (京)2019-0008。大鼠5 只/笼,饲养于室温(21 ± 2)℃,相对湿度50%~60%,明暗12 h/12 h 的环境并使大鼠自由进食饮水。
1.2 药品试剂 53%vol 茅台镇散酒(SC11552032 110418);娘母良药酒(娘母良200 g + 53%vol 茅台镇散酒4 000 mL);枸橼酸西地那非片(货号:H20143255,广东白云山医药集团股份有限公司);盐酸阿扑吗啡(APO,货号:PHR2621,默克);BCA 蛋白检测试剂盒(货号:A045-4-2),一氧化氮(NO)测定试剂盒(货号:A013-2-1)均购于南京建成生物工程研究所;大鼠环磷酸鸟苷(cGMP)ELISA 检测试剂盒(货号:ml003133,酶联生物);B 淋巴细胞瘤-2(Bcl-2,货号:ab59348),Bcl-2 相关X 蛋白(Bax,货号:ab32503) 均购于Abcam 上海贸易有限公司;Cleaved caspase-3 (货号:9661),Cleaved caspase-9(货号:9507)均购于Cell Signaling Technology 公司。
1.3 建立ED 模型 使用双侧髂内动脉结扎法建立ED 模型[12]。将大鼠麻醉后固定于手术台上,在腹部正中切口,分离腹壁肌肉组织,通过手术放大镜辅助,沿髂总动脉小心分离直至髂内动脉,以8-0 线结扎双侧髂内动脉。假手术组大鼠接受假手术,即按建模步骤但不予结扎。
采用APO 实验验证模型[13]:在大鼠颈项皮肤松软处注射100 μg/kg APO,记录30 min 内大鼠阴茎勃起次数,以阴茎体增长、末段阴茎体露出为阴茎勃起1 次;未检测到阴茎勃起证明模型构建成功。
1.4 分组和给药 将60 只大鼠平均分为6 组:假手术、模型、白酒、西地那非、娘母良低剂量、娘母良高剂量组。假手术组大鼠接受假手术,其余组均使用双侧髂内动脉结扎法建立ED 模型。造模成功后第1 天开始给药,西地那非组每天灌胃5 mg/kg 的西地那非,娘母良低、高剂量组每天分别灌胃3、6 mL/kg的娘母良药酒,白酒组每天灌胃等体积等度数白酒,假手术与模型组每天分别灌胃等体积的生理盐水作为平行对照,各组均给药持续28 d。给药结束后,所有大鼠进行APO 勃起实验,之后被处死,称重并收集样本。
1.5 附睾和睾丸指数检测 取各组大鼠睾丸,称质量后放入4%的多聚甲醛中备用。
脏器指数= 脏器质量/ 体质量× 100%。
1.6 附睾精子数量及存活率检测 取大鼠右侧附睾浸泡于37 ℃生理盐水中,制备精子悬液,取10 μL 混匀的精子悬液,滴于血细胞计数板中,显微镜下计数精子数量,N = 镜下精子数目/ 100 × 106/mL;根据精子的活动情况,统计活动精子数,M = 镜下活动精子数目/ 100 × 106/mL,计算精子活率。
精子活率= M / N × 100%。
1.7 阴茎勃起相关生物活性因子测定 完成上述实验后,将大鼠下腹及会阴消毒,灭菌动物手术器械将大鼠阴茎从根部剪断,迅速取出龟头和包皮组织,灭菌生理盐水漂洗阴茎,阴茎后端放入4%的多聚甲醛中备用。称取阴茎前端100 mg,剪碎,匀浆。按照生化试剂盒和ELISA 试剂盒说明书分别检测NO、cGMP含量。
1.8 阴茎海绵体与睾丸组织病理学染色 将置于4%多聚甲醛固定的大鼠阴茎海绵体组织及睾丸组织脱水,石蜡包埋,切片,常规HE 染色,中性树胶封片,显微镜下观察大鼠海绵体与睾丸组织病理变化。
1.9 Western blot 检测阴茎组织中凋亡相关蛋白表达 提取阴茎海绵体组织蛋白后,电泳分离蛋白,将蛋白转移到PVDF 膜后,浸5%脱脂奶粉于摇床上室温封闭2 h,将封闭后的膜置于对应一抗稀释液中(Bcl-2,1 ∶10 000;Bax,1 ∶1 000;Cleaved caspase-3,1 ∶1 000;Cleaved caspase-9,1 ∶1 000)4 ℃过夜。使用封闭液按1 ∶6 000 稀释二抗,温室孵育2 h,置于化学发光仪中曝光。
1.10 数据处理 数据利用SPSS 25.0 统计软件进行数据处理及统计分析,计量资料采用均数± 标准差(±s)表示,采用独立样本t 检验,组间比较采用单因素方差分析(ANOVA)统计;方差不齐采用秩和检验,以P<0.05,P<0.01,P<0.001 为差异有统计学意义。
2 结果
2.1 各组大鼠勃起功能比较 APO 实验结果显示,与假手术组相比,模型组大鼠的勃起次数显著降低(4.10 ± 0.54 vs.0.90 ± 0.70,P<0.01);与模型组相比,白酒组无明显差异(0.90 ± 0.70 vs.1.10 ± 0.70,P>0.05),西地那非组与娘母良低、高剂量组大鼠的勃起次数均显著增多(0.90 ± 0.70 vs.2.60 ± 0.49,P<0. 01;0.90 ± 0.70 vs.1.70 ± 0.46,P<0. 05;0.90 ± 0.70 vs.2.30± 0.64,P<0.01);与白酒组相比,娘母良低、高剂量组均显著增多(1.10 ± 0.70 vs.1.70 ± 0.46,P<0. 05;1.10 ±0.70 vs.2.30 ± 0.64,P<0.01);与西地那非组相比,娘母高剂量组无明显差异(2.60 ± 0.49 vs.2.30 ± 0.64,P>0.05)。见图1。

图1 各组大鼠勃起次数
2.2 各组大鼠附睾与睾丸的质量及指数比较 结果显示,与假手术组相比,模型组大鼠的附睾质量、睾丸质量、附睾指数、睾丸指数均显著降低(0.88 ± 0.08 vs 0.39 ± 0.07,1.93 ± 0.18 vs 0.96 ± 0.12,0.25 ± 0.02 vs 0.10 ± 0.02,0.54 ± 0.05 vs 0.25 ± 0.03,均P<0.01);与模型组相比,白酒组无明显差异(0.39 ± 0.07 vs 0.35 ±0.08,0.96 ± 0.12 vs 0.93 ± 0.10,0.10 ± 0.02 vs 0.09 ±0.03,0.25 ± 0.03 vs 0.24 ± 0.05,均P>0.05),西地那非组与娘母良各剂量组均显著升高(西地那非组,0.39 ±0.07 vs 0.72 ± 0.09,0.96 ± 0.12 vs 1.65 ± 0.17,0.10 ±0.02 vs 0.20 ± 0.03,0.25 ± 0.03 vs 0.46 ± 0.05,均P<0.01;娘母良低剂量组,0.39 ± 0.07 vs 0.45 ± 0.08,0.96± 0.12 vs 1.34 ± 0.17,0.10 ± 0.02 vs 0.13 ± 0.03,均P<0.01,0.25 ± 0.03 vs 0.38 ± 0.04,P<0.05;娘母良高剂量组,0.39 ± 0.07 vs 0.78 ± 0.11,0.96 ± 0.12 vs 1.70 ±0.17,0.10 ± 0.02 vs 0.22 ± 0.03,0.25 ± 0.03 vs 0.48 ±0.04,均P<0.01);与白酒组相比,娘母良低、高剂量组显著升高(娘母良低剂量组,0.35 ± 0.08 vs 0.45 ±0.08,P<0.05,0.93 ± 0.10 vs 1.34 ± 0.17,0.09 ± 0.03 vs 0.13 ± 0.03,0.24 ± 0.05 vs 0.38 ± 0.04,均P<0.01;娘母良高剂量组,0.35 ± 0.08 vs 0.78 ± 0.11,0.93 ± 0.10 vs 1.70 ± 0.17,0.09 ± 0.03 vs 0.22 ± 0.03,0.24 ± 0.05 vs 0.48 ± 0.04,均P<0.01);与西地那非组相比,娘母良高剂量组无明显差异(0.72 ± 0.09 vs 0.78 ± 0.11,1.65 ±0.17 vs 1.70 ± 0.17,0.20 ± 0.03 vs 0.22 ± 0.03,0.46 ±0.05 vs 0.48 ± 0.04,均P>0.05)。见图2。

图2 各组大鼠附睾与睾丸的质量及指数
2.3 各组大鼠精子质量比较 结果显示,与假手术组相比,模型组大鼠的精子数量及存活率均显著降低(84.00 ± 10.90 vs.5.40 ± 1.70,86.31 ± 5.73 vs.28.59 ±18.15,均P<0.01);与模型组相比,白酒组无明显差异(5.40 ± 1.70 vs.5.80 ± 0.75,28.59 ± 18.15 vs.32.70 ±10.20,均P>0.05),西地那非组与娘母良各剂量组均显著升高(西地那非组,5.40 ± 1.70 vs.71.10 ± 7.09,28.59 ± 18.15 vs.69.02 ± 5.32,均P<0.01;娘母良低剂量组,5.40 ± 1.70 vs.47.00 ± 4.30,28.59 ± 18.15 vs.48.90 ± 4.81,均P<0.01;娘母良高剂量组,5.40 ± 1.70 vs.67.05 ± 4.49,28.59 ± 18.15 vs.74.76 ± 3.31,均P<0.01);与白酒组相比,娘母良组显著升高(娘母良低剂量组,5.80 ± 0.75 vs.47.00 ± 4.30,32.70 ± 10.20 vs.48.90 ± 4.81,均P<0.01;娘母良高剂量组,5.80 ± 0.75 vs.67.05 ± 4.49,32.70 ± 10.20 vs.74.76 ± 3.31,均P<0.01);与西地那非组相比,娘母良高剂量组精子数量无明显差异,精子活率显著升高(71.10 ± 7.09 vs.67.05 ± 4.49,P>0.05,69.02 ± 5.32 vs.74.76 ± 3.31,P<0.05)。见图3。

图3 各组大鼠精子质量
2.4 各组大鼠阴茎海绵体与睾丸病理的变化 HE结果显示,假手术组大鼠阴茎海绵体组织形态正常,血窦丰富且排列规则,内皮细胞完整且均匀分布于血管壁上;模型组和白酒组大鼠阴茎海绵体组织血窦减少并分布紊乱、内皮细胞损伤并且密度降低等病理变化;西地那非与娘母良干预后阴茎海绵体组织形态逐渐恢复正常。见图4。
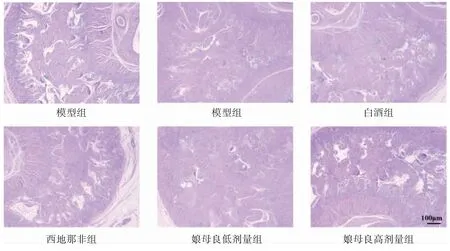
图4 各组大鼠阴茎海绵体组织HE 染色(100×)
假手术组大鼠睾丸组织生精细胞结构正常,层次规则,生精小管管腔饱满,各生精小管之间接触紧密,仅有部分生精小管呈空腔状态,说明大部分的精子细胞完好;模型组大鼠睾丸组织生精细胞结构异常,排列紊乱,生精小管管腔缩小,各生精小管之间的间隙明显变宽;西地那非与娘母良干预后睾丸组织形态逐渐恢复正常。见图5。
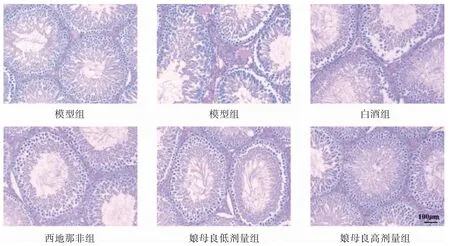
图5 各组大鼠睾丸组织HE 染色(100×)
2.5 各组大鼠NO/cGMP 信号传导变化 结果显示,与假手术组相比,模型组大鼠的NO 和cGMP 水平均显著降低(5.16 ± 0.73 vs.2.18 ± 0.50,1.90 ± 0.37 vs.0.41 ± 0.08,均P<0.01);与模型组相比,白酒组无明显差异(2.18 ± 0.50 vs.1.98 ± 0.52,0.41 ± 0.08 vs.0.43 ±0.05,均P>0.05),西地那非组与娘母良各剂量组均显著升高(西地那非组,2.18 ± 0.50 vs.3.98 ± 0.43,0.41 ±0.08 vs.1.49±0.36,均P<0.01;娘母良低剂量组,2.18±0.50 vs.3.21 ± 0.42,0.41 ± 0.08 vs.0.93 ± 0.18,均P<0.01;娘母良高剂量组,2.18 ± 0.50 vs.4.28 ± 0.45,0.41 ± 0.08 vs.1.56 ± 0.35,均P<0.01);与白酒组相比,娘母良组显著升高(娘母良低剂量组,1.98 ± 0.52 vs.3.21 ± 0.42,0.43 ± 0.05 vs.0.93 ± 0.18,均P<0.01;娘母良高剂量组,1.98 ± 0.52 vs.4.28 ± 0.45,0.43 ± 0.05 vs.1.56 ± 0.35,均P<0.01);与西地那非组相比,娘母良高剂量组无明显差异(3.98 ± 0.43 vs.4.28 ± 0.45,1.49 ±0.36 vs.1.56 ± 0.35,均P>0.05)。见图6。
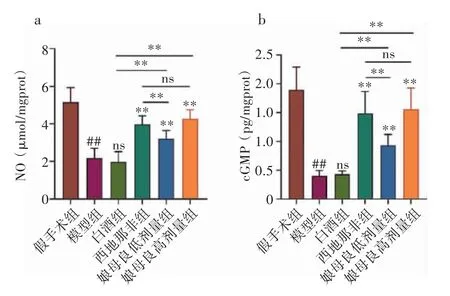
图6 各组大鼠NO/cGMP 信号传导
2.6 各组大鼠凋亡相关蛋白变化 Western blot 结果显示,与假手术组相比,模型组大鼠Bax/Bcl-2,Cleaved caspase-3 和Cleaved caspase-9 的蛋白表达水平均显著升高(0.08± 0.02 vs.1.00 ± 0.00,0.26 ± 0.02 vs.1.00 ± 0.00,0.27 ± 0.06 vs.1.00 ± 0.00,均P<0.01);与模型组相比,白酒组无明显差异(1.00 ± 0.00 vs.0.93 ± 0.05,1.00 ± 0.00 vs.0.99 ± 0.05,1.00 ± 0.00 vs.1.06 ± 0.06,均P>0.05),西地那非组与娘母良组不同程度降低(西地那非组,1.00 ± 0.00 vs.0.14 ± 0.02,1.00 ± 0.00 vs.0.35 ± 0.04,1.00 ± 0.00 vs.0.66 ± 0.02,均P<0.01;娘母良低剂量组,1.00 ± 0.00 vs.0.39 ± 0.03,1.00 ± 0.00 vs.0.58 ± 0.08,均P<0.01,1.00 ± 0.00 vs.1.13 ± 0.11,P>0.05;娘母良高剂量组1.00 ± 0.00 vs.0.16 ± 0.02,1.00 ± 0.00 vs.0.38 ± 0.05,1.00 ± 0.00 vs.0.67 ± 0.09,均P<0.01);与白酒组相比,娘母良组显著降低(娘母良低剂量组,0.93 ± 0.05 vs.0.39 ± 0.03,0.99 ± 0.05 vs.0.58 ± 0.08,均P<0.01,1.06 ± 0.06 vs.1.13 ± 0.11,P>0.05;娘母良高剂量组0.93 ± 0.05 vs.0.16 ± 0.02,0.99 ± 0.05 vs.0.38 ± 0.05,1.06 ± 0.06 vs.0.67 ± 0.09,均P<0.01);与西地那非组相比,娘母良高剂量组无明显差异(0.14 ± 0.02 vs.0.16 ± 0.02,0.35 ±0.04 vs.0.38 ± 0.05,0.66 ± 0.02 vs.0.67 ± 0.09,均P>0.05)。见图7。

图7 各组大鼠凋亡相关蛋白表达
3 讨论
中医认为ED 是经由肝郁、湿热、瘀滞、命门火衰、阴虚火旺、阴虚火旺、心脾血虚等原因致病。娘母良具有补肾助阳、养心安神、祛痰解痉的功效[11]。临床应用于肾虚阳萎、早泄等性功能减退症以及心悸怔忡、肾虚咳喘、宫寒带下等证[12]。并且,佤族民间早已验证其强壮、增力、抗疲劳作用,是1 种纯天然强壮剂。娘母良药酒在娘母良的基础上组方而成,具有舒筋活血、补肾助阳的功效[13]。
在本文的研究中,采用双侧髂内动脉结扎法建立ED 大鼠模型,使用APO 检测造模成功与否。结果显示ED 模型大鼠的勃起功能受限,而娘母良药酒干预后ED 大鼠的勃起功能有所恢复。当ED 发生时,会出现精子质量低下,阴茎海绵体和睾丸组织形态改变的现象。娘母良药酒干预后对ED 大鼠的精子质量以及阴茎海绵体和睾丸的病理具有明显改善。NO/cGMP信号传导在阴茎勃起中发挥关键作用。NO 刺激可溶性鸟苷环化酶,将三磷酸鸟苷转化为cGMP,进而激活蛋白激酶,有利于海绵体平滑肌的松弛,并增强血液流入阴茎,导致阴茎勃起[14]。我们的结果发现ED大鼠的NO 和cGMP 产生受损,但娘母良药酒干预后NO 和cGMP 水平明显提升。在这些结果中,西地那非组和娘母良药酒组相比没有明显差异,说明娘母良药酒可能是1 种可以代替西地那非改善ED 的潜在药物。白酒组与模型组相比没有明显差异,白酒组与娘母良药酒组相比具有明显差异,说明娘母良在ED 大鼠勃起功能恢复过程中发挥了重要的作用。以上内容验证了娘母良药酒对ED 具有良好的改善作用。
细胞凋亡是1 种受基因调控的有序、自发的细胞死亡形式,是维持细胞和器官正常功能的重要病理生理过程[15]。此外,细胞凋亡也是ED 的关键病理机制,可能导致海绵体缺血,从而削弱勃起功能[16-17]。既往研究报道,Akt/Bad/Bax/Caspase-3 通路可显著预防海绵体神经损伤大鼠的体细胞凋亡[18]。五子衍宗方通过抑制细胞凋亡,有效改善与衰老相关的睾丸功能障碍[19]。Bcl-2 蛋白家族被认为是细胞凋亡的关键调节因子[19]。Bcl-2 具有抗凋亡作用,Bax 具有促凋亡作用,二者可形成二聚体发挥作用。Bcl-2/Bax 比率降低可能会导致线粒体功能障碍,Bcl-2/Bax 的平衡是决定细胞凋亡程度的主要因素[20]。当Bax-Bcl-2 二聚体增多时,可以促进线粒体穿孔,通过释放细胞色素c启动细胞凋亡的过程,它激活Caspase 级联,导致细胞破坏[21]。Caspase-9 是1 种起始caspase,在caspase-3/-7 上游发挥作用。细胞色素c 从线粒体释放到细胞质中,与凋亡蛋白酶激活因子1 结合形成凋亡体,最终激活Procaspase-9[22]。Procaspase-9 然后在大亚基和小亚基之间的亚基间连接子处裂解激活Pro caspases-3[23]。在本研究中,Wesrern blot 结果表明,ED大鼠Bax/Bcl-2 比例、Cleaved caspase-3 和Cleaved caspase-9 表达升高,而娘母良药酒干预后Bax/Bcl-2比例、Cleaved caspase-3 和Cleaved caspase-9 表达下降,表明娘母良药酒可能是通过抑制细胞凋亡改善ED。
综上所述,娘母良药酒可以促进NO 与cGMP 的产生并抑制阴茎海绵体组织细胞凋亡进而改善ED大鼠勃起功能。见图8。本研究对娘母良药酒治疗ED大鼠的效果及机制进行了初步探索,以期为娘母良药酒的临床应用提供实验基础和理论依据。然而,娘母良药酒对ED 的深入作用机制,还需要在未来进行多角度的研究。
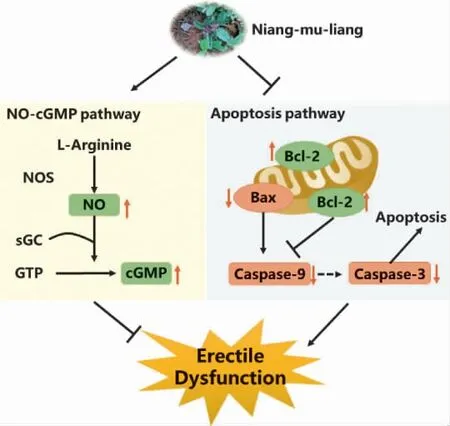
图8 图形摘要
