胃癌靶向治疗的曙光
——Claudin18.2
2023-11-13李澔叶显辉周俊杰李晓芬
李澔,叶显辉,周俊杰,李晓芬
0 引言
在全球范围内,胃癌是最常见的恶性肿瘤之一,2020年GLOBOCAN统计数据显示[1],胃癌的发病率居所有恶性肿瘤的第五位,死亡率高居第四位。胃癌起病隐匿,早期患者多无特异性症状,多数患者发现时已属局部晚期或晚期,预后较差。手术和化疗是胃癌的主要治疗手段,但术后复发转移率高和化疗有效率低、缓解持续时间短仍然是胃癌患者预后差的主要原因。随着分子生物学的蓬勃发展,抗HER2单抗(如曲妥珠单抗)和抗血管生成的靶向药物(如雷莫芦单抗、阿帕替尼等)陆续应用于晚期胃癌患者,并已证实具有一定的临床应用价值。目前已有多项Ⅲ期临床试验提示在晚期胃癌中,免疫检查点抑制剂联合化疗比单纯化疗显著延长生存期[2-3]。然而,已有的靶向药物或者免疫检查点抑制剂存在阳性率低、生存时间绝对值提高较小或者不良反应较大的局限性,亟需开发更具有效性和安全性的治疗方法。Claudin蛋白是细胞间紧密连接的重要结构蛋白,其亚型Claudin18.2(CLDN18.2)特异性表达于分化的胃上皮细胞,并在细胞恶变过程中被过度激活,在胰腺癌、食管癌和结直肠癌中也有表达。近年来,靶向CLDN18.2的药物在胃癌中取得了突破性的进展[2],有望成为广大胃癌患者的新希望。国外已有相关文章对CLDN18.2的应用前景进行了总结,但国内尚欠缺相关的系统性报道,本文旨在总结、探讨CLDN18.2在胃癌诊断、治疗和预后评估等方面的主要进展和应用潜力。
1 Claudin18.2的表达和检测方法
作为Claudin蛋白家族的一员,CLDN18.2特异性表达于胃上皮细胞,参与构成胃上皮细胞间紧密连接,在维持正常细胞的屏障功能、渗透作用、细胞极性、细胞间传输和信号转导方面发挥重要作用,该蛋白是由261个氨基酸组成的4个螺旋束TM1~TM4和5个β片层,见图1[4],其中TM1-TM4是穿膜结构域,嵌合在细胞膜内(与Claudin家族其他蛋白高度一致),而5个β片层则组成两个胞外环ECL1和ECL2,β1~β4组成了ECL1,可以决定离子透过紧密连接的电荷选择性,β5则组成ECL2,细胞外环ECL1和ECL2富含可变的环路区域,相同的亚型的CLDN18.2蛋白相互识别,在相邻细胞膜上高亲和性联动装配形成紧密连接,膜蛋白的空间分布因而受特异性限制,维持了细胞游离端到基底端的极性[5]。
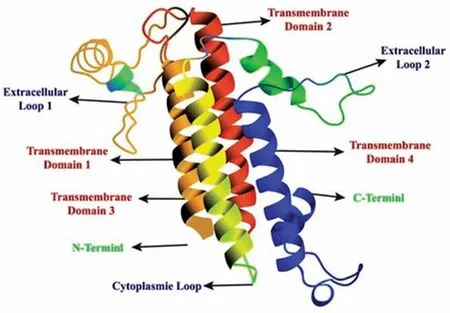
图1 Claudin 18.2的结构模式图[4]Figure 1 Structural model of Claudin 18.2[4]
2 0 0 8 年,S a h i n 等[6]最先系统性检测了CLDN18.2在人体中的表达情况,发现 CLDN18.2只在胃黏膜细胞(包括胃正常腺体、主细胞、壁细胞、内分泌细胞)以及十二指肠的潘氏细胞内表达,正常情况下不表达于胃干细胞及其他健康组织中,且其抗原表位因隐藏于紧密连接中,因此无法被血液中的抗体结合。在原发性恶性肿瘤如胃癌、胰腺癌、食管癌和结直肠癌等,CLDN18.2表达上调,且抗原表位暴露于肿瘤细胞表面(细胞恶变过程中极性丧失、细胞离散等所致),使靶向CLDN18.2的抗体可以高度特异性地结合在肿瘤细胞表面,而不损伤正常细胞,因此CLDN18.2是一种理想的抗肿瘤药物分子靶点。
目前,检测CLDN18.2表达较为成熟的方法是免疫组织化学染色(IHC)[7-8]。一般采用染色强度及阳性细胞率作为CLDN18.2表达的定量分析指标,染色强度可分为0(细胞膜或细胞质无反应)、1+(细胞膜或细胞质弱反应性)、2+(细胞膜或细胞质中反应)、3+(细胞膜或细胞质强反应性),但对于内镜活检的小样本,IHC可能无法全面、准确地反映 CLDN18.2的表达,并且也无法实现实时动态的监测。近年来,也有其他的检测方法正在研发中,例如124I-5C9-PET、循环肿瘤细胞RNA检测等[9-10]。
基于IHC的检测方法,不同研究中CLDN18.2在胃癌中的表达率有所差异,见表1[7-8,11-19]。目前成熟的抗体来源主要有两种:Clone43-14A(德国Ganymed公司)和EPR19202(美国Abcam公司);其中Clone43-14A抗体的阳性检出率稍高于EPR19202[11]。造成不同研究中表达差异的因素可能有种族特征、胃癌细胞的异质性(尤其在标本为微小组织芯片的情况下)、检测抗体种类及浓度、定义标准等。因此,明确的免疫染色方法和评分标准对于数据可比性至关重要。
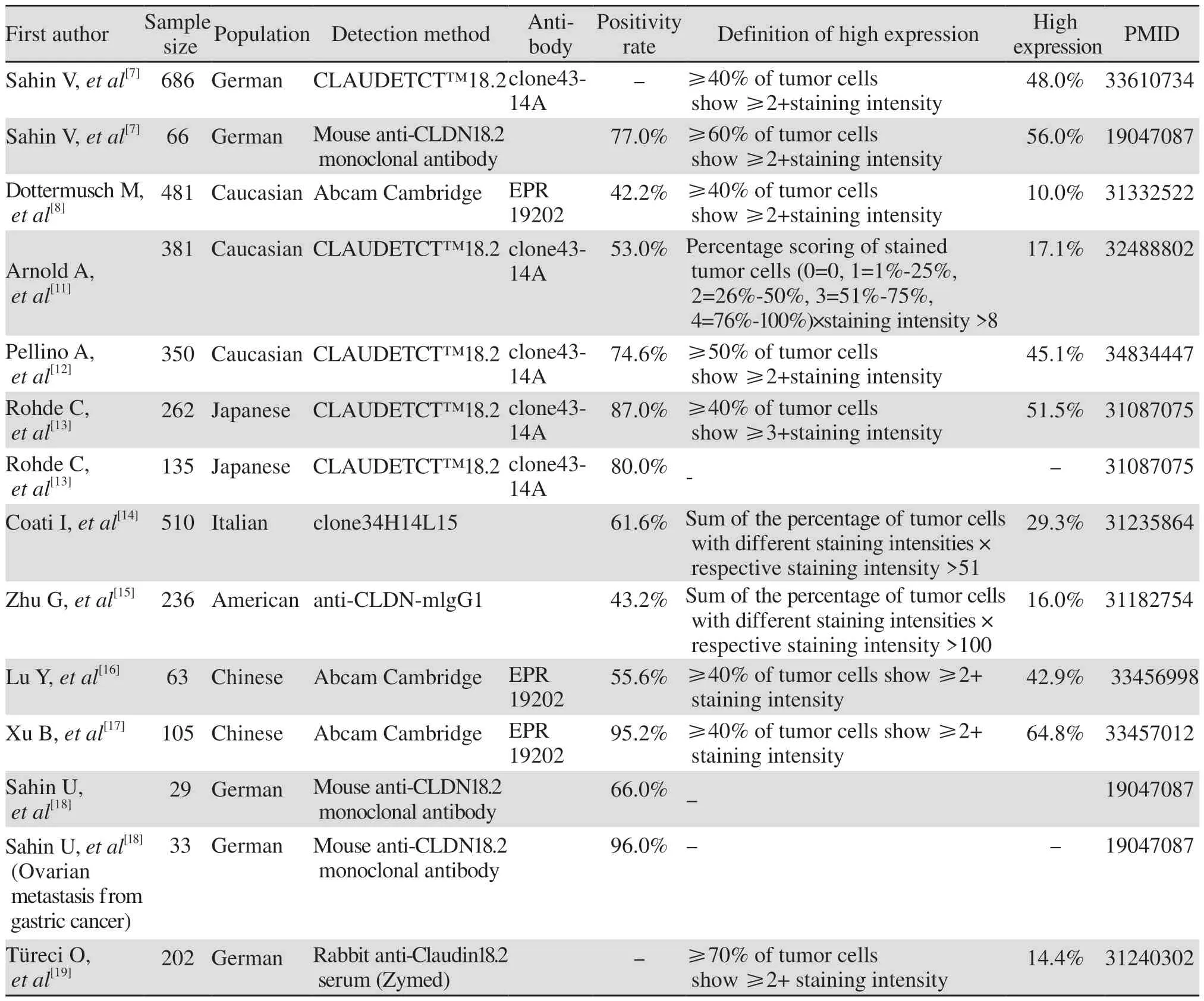
表1 不同研究中CLDN18.2的表达情况Table 1 Expression of CLDN18.2 in different studies
2 CLDN18.2与胃癌临床病理特点的相关性
2.1 与EB病毒感染的关系
已有多项[12,14,20]研究表明EB病毒阳性胃癌的CLDN18阳性率显著高于EB病毒阴性者,这可能是由于受EB病毒感染的胃癌细胞源发于低分化细胞,并且在上皮间质转化等恶变过程中保留了源细胞膜标志蛋白(如CLDN18)表达的特点,且广泛的细胞连接可能限制抗体对病毒的可及性,有助于EB病毒在肿瘤细胞中的持续存在而最终介导癌变。目前已发现CLDN18-ARHGAP基因融合现象与CLDN18.2在胃癌中的表达显著相关,嵌合蛋白CLDN18-ARHGAP可导致细胞-细胞或细胞-基质黏附丧失而诱发上皮间质转化及增加侵袭性[21-23]。CLDN18-ARHGAP26/6融合在胃癌/胃食管结合部癌患者中的出现频率高达15%,尤其在基因组稳定型、弥漫型、年轻患者和转移灶中,部分患者使用FOLFOX方案治疗没有获益,提示CLDN18-ARHGAP26融合的肿瘤细胞可能对化疗耐药[24]。
2.2 与Lauren表型、HER2表达及预后的关系
部分研究认为[14,20]CLDN18.2阳性与弥漫型胃癌显著相关,但也有研究发现CLDN18.2阳性的肿瘤与Lauren表型无关[8,11,12]。探索CLDN18.2与HER2阳性肿瘤关系的相关研究也未得出一致结果[8,12,14,20]。较多研究中观察到了12%~25%的患者中存在CLDN18.2和HER2的共同表达[7,20]。Claudin18.2可能可以作为一个新的胃癌亚群中的非重叠靶点,双靶向策略(抗HER2和抗CLDN18.2单抗)是CLDN18.2和HER2共表达患者的一个可能的治疗选择。在胃癌中,多项小样本[25-26]研究表明,CLDN18.2表达降低与预后不良相关,而三项大型白种人队列研究、一项日本研究和一项Meta分析[8,11,12-13,24]则认为CLDN18.2与总生存期无显著相关性。在其他癌种中,CLDN18对预后的关系也仍不明确。目前研究纳入的患者前线治疗情况不明,入组患者的分子表达特征也不具有可比性,混杂因素较多,仍需要大样本前瞻性研究探讨CLDN18.2与Lauren表型、HER2表达及预后的关系。
3 靶向CLDN18.2的药物
鉴于CLDN18.2在胃癌中的特殊表达,针对该靶点的药物研发如火如荼,且取得了令人瞩目的疗效。目前,进入临床试验阶段的CLDN18.2靶向药物包括单抗、CAR-T、ADC和双抗四大类。全球在研药物共38个,其中处于Ⅲ期临床试验研究的药物1个,Ⅱ期研究药物2个,Ⅰ期研究药物7个,临床前研究药物20个。由于大部分药物还处于临床前或Ⅰ期试验阶段,有确切数据公布的药物较少,我们期待更多的研究结果为临床应用提供参考。
3.1 CLDN18.2单抗
靶向CLDN18.2的单抗较多,包括Zolbetuximab、TST001、AB011等,其中研究进展最快的为Zolbetuximab。
3.1.1 Zolbetuximab Zolbetuximab(IMAB362)是第一个靶向CLDN18.2的单抗,属于人鼠嵌合IgG1单克隆抗体,通过刺激细胞免疫效应和可溶性免疫效应,激活抗体依赖性细胞毒效应和补体依赖性细胞毒效应诱导肿瘤细胞凋亡[27]。IMAB362目前已进行多项临床试验,其结果汇总详见表2。

表2 IMAB362临床试验结果汇总Table 2 Summary of clinical trial results for IMAB362
2009年,Sahin等公布了关于Zolbetuximab的Ⅰ期临床试验[28]结果,证实了该药人体耐受性良好。2015年ASCO大会报道的PILOTⅠ期试验结果表明IMAB362与唑来膦酸/IL-2的联合使用安全性良好,具有一定的抗肿瘤效果(mOS 40周,mPFS 12.7周)。其后发表的Ⅱa期试验[19](MONO研究)证实,Zolbetuximab单药治疗复发或难治型晚期胃或低位食管腺癌的疗效与CLDN18.2表达呈正相关,所有入组患者均为CLDN18.2阳性表达占比≥50%肿瘤细胞,强度≥2+,结果表明总客观缓解率(ORR)为9%,而CLDN18.2阳性表达≥70%肿瘤细胞的患者ORR可达23%。2021年发表的Ⅱb期试验[7](FAST研究)中所有患者肿瘤组织CLDN18.2表达阳性(CLDN18.2阳性表达≥40%肿瘤细胞),结果表明:(1)实验组和对照组的mPFS为7.5vs.5.3个月,P<0.0005,mOS分别为13.0vs.8.3个月,P<0.0005;(2)ORR为39%vs.25%,P=0.034;(3)CLDN18.2高表达(≥70%肿瘤细胞中表达2+强度)亚组预后更好(mPFS 9.0vs.5.7个月,P<0.0005;mOS 16.5vs.8.9个月,P<0.0005)。上述临床研究中呕吐是IMAB362最常见的不良反应(55%~69%),多为1~3级。目前,有两项关于Zolbetuximab联合化疗对比单纯化疗的全球Ⅲ期研究正在进行(SPOTLIGHT研究和GLOW研究),期待研究结果。
3.1.2 T S T 0 01 2 0 2 2 年欧洲肿瘤内科学会(ESMO)年会上,研究者以壁报形式公布了TST001在中国的Ⅰ/Ⅱ期临床试验中期分析数据[29],该研究入组了26例晚期胃及胃食管结合部腺癌患者(其中12例未检测CLDN18.2表达情况的患者分配到剂量爬坡组,14例CLDN18.2阳性患者分配到剂量扩展组),一线接受TST001联合奥沙利铂+卡培他滨化疗,治疗中最常见的1~2级不良反应包括恶心、呕吐、低白蛋白血症、贫血等,3级以上不良反应有高血压、恶心、呕吐、贫血等。在剂量爬坡组中,10例患者可评价疗效,5例(50%)患者达到PR,4例患者SD,初步疗效可观。
3.1.3 其他在研单抗 国内已有多项在研的CLDN18.2单抗,见表3。AB011是我国自主研发的首个针对CLDN18.2的单抗,也是国际上首个针对该靶点的人源化单抗。临床前研究结果显示AB011具有良好的安全性和有效性,在小鼠中联合FOLFOX方案化疗显示出良好的抗肿瘤活性[30]。目前,AB011已经完成了单药剂量递增及剂量扩展阶段研究,与化疗联合的一线治疗研究正在进行中。单药治疗阶段有既往接受过二线化疗失败的晚期胃癌患者达到了完全缓解(CR)。在联合治疗阶段,首例晚期胃癌患者首次用药后6周肿瘤评估为PR,同时各项肿瘤指标也有显著下降,均恢复到正常值以下,患者精神状态较治疗前有明显好转。
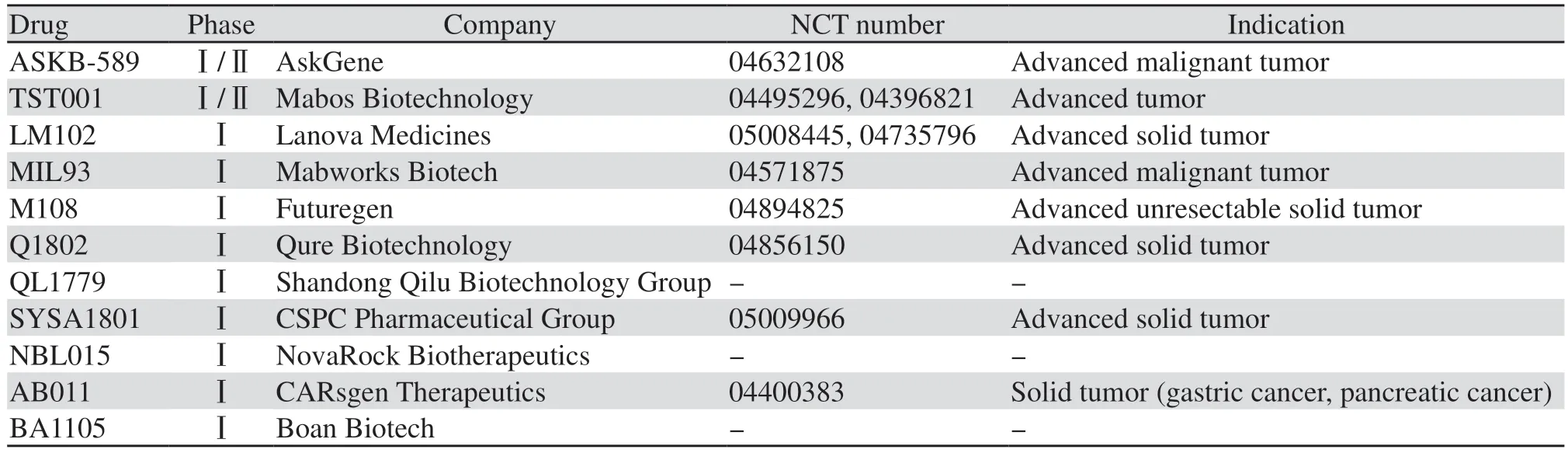
表3 国内部分在研CLDN18.2单抗一览Table 3 Overview of ongoing CLDN18.2 monoclonal antibodies in China
另外,ASKB589注射液Ⅰ/Ⅱ期试验也正在进行,前期披露的数据显示出良好的疗效[31]。其中,2例接受过多线化疗、PD-1单抗治疗失败的晚期胃癌患者,在使用ASKB589治疗6周后均达到部分缓解,靶病灶明显缩小,部分非靶病灶消失,肿瘤标志物显著下降。另外,在ASKB589联合CAPOX方案化疗一线治疗晚期胃癌的剂量爬坡研究中,3、6 mg/kg剂量组中3例患者达到部分缓解。
3.2 CAR-T
目前我国自主研发的CAR-T药物是CAR-T细胞注射液(CT041),前期数据显示其在难治性CLDN18.2阳性的消化道恶性肿瘤患者中具有可耐受的安全性和高抗肿瘤活性,目前正在进行Ⅰ/Ⅱ期临床试验。
CT041的多中心Ⅰb期临床试验的初步结果已在今年ASCO年会上公布,该研究评估了CT041在难治性胃及胃食管结合部腺癌(至少接受过两线治疗)、胰腺癌(至少接受过一线治疗)中的安全性和疗效[32-34]。CT041达到了较好的总疗效ORR为48.6%(18/37),疾病控制率(DCR)为73%(27/37);在其中18例至少两线治疗失败的胃及胃食管结合部腺癌患者亚群中,2.5×108剂量下CAR-T疗法ORR为61.1%,DCR为83.3%,mPFS为5.6个月,中位有效持续时间(mDOR)为6.4个月,mOS为9.5个月。
安全性上,最常见的不良反应为清淋预处理治疗所致的3/4级短暂性血液学毒性(100%)和1/2级细胞因子释放综合征(95%),未发生治疗相关死亡或免疫相关神经系统毒性综合征,可能与全人源化的scFv片段及清淋预处理方案有关[35-36]。
总体来说,CT041的安全性和耐受性良好,疗效显著;药代动力学方面,相较于既往治疗实体瘤的CAR-T细胞,CT041输注后的拷贝数和持续时间都有了一定程度的提升,有望给消化道肿瘤患者带来新的曙光。国内已有多项在研的靶向CLAN18.2的CAR-T药物,其研究在研阶段等信息详见表4。

表4 靶向CLAN18.2的CAR-T临床研究一览Table 4 Overview of clinical studies on CAR-T targeting CLDN18.2
3.3 双抗及抗体偶联药物
双抗及抗体偶联药物(ADC)大部分处于Ⅰ期试验阶段。ABL111是国内首个申报临床试验的CLDN18.2/4-1BB双抗,其中4-1BB为T细胞共刺激分子,CLDN18.2/4-1BB双抗可激活T细胞协同抗肿瘤,同时与CLDN18.2的结合可特异性地避免因4-1BB广泛表达而过度激活T细胞,具有结合特异性和低毒性,Claudin18.2低表达时仍能与肿瘤病灶结合,可以显著增加机体多种抑癌通路的活性[37]。PD-L1/Claudin18.2双特异性抗体(SPX-301)可通过Claudin18.2抗体介导的效应杀伤肿瘤,同时通过PD-L1抗体阻断PD-1信号及激活免疫[38]。靶向Claudin18.2/CD3双抗AMG910[39]、QLS31905[40]及PD-L1/CLDN18.2双抗Q-1802[41]也正在我国进行针对晚期胃癌/胃食管结合部癌的Ⅰ期试验。CD3和Claudin18.2的双特异性T细胞接合器(BiTEs)在PDX模型上取得了成功[42],可通过靶向结合CD3和Claudin18.2来引导T细胞,从而改善抗体依赖的细胞介导的细胞毒性作用(antibody-dependent cell-mediated cytotoxicity, ADCC),毒性较小,但原位模型的效果和安全性并不确定,临床应用可能会受到细胞因子风暴的阻碍[15]。靶点丢失,免疫反应不足,免疫检查点上调可能使双抗出现耐药性。目前已有多项在研的靶向CLAN18.2的双抗及ADC药物,其研究在研阶段等信息详见表5。
4 总结
综上所述,CLND18.2是胃癌中特异性较高的靶点,可能在弥漫型、HER2阳性、EB病毒感染的胃癌中表达更高。虽然CLND18.2的IHC抗体和判读标准仍需进一步规范,但靶向CLND18.2的药物初步临床试验已显示出令人振奋的抗肿瘤疗效,有望成为晚期胃癌全新的治疗方法。多项临床研究正在进行中,我们也期待CLND18.2在其他消化道恶性肿瘤中的研究结果。
利益冲突声明:
所有作者均声明不存在利益冲突。
