miR-30b-5p通过Sema3A调控HUVECs细胞增殖、凋亡、迁移与血管形成
2023-11-12李志杰
李志杰
(国药同煤总医院内分泌科,山西 大同 037009)
糖尿病足病是糖尿病患者常见的严重慢性并发症之一[1],患者常出现局部神经异常,伴有下肢远端外周血管病变相关的足部感染、溃疡和(或)深层组织破坏[2]。其发病原因包括感觉运动和自主神经病变、周围血管病变、关节活动受限和局部压力增加[3]。糖尿病足病患者易出现糖尿病足溃疡(DFU),若溃疡并发感染将影响伤口愈合。伤口愈合是一个复杂而有序的过程,包括凝血、炎症、细胞增殖和组织重塑四个互有重叠的阶段[4],其中新生血管的形成十分关键,其能够提供氧气和营养、促进碎片清除和伤口愈合[5]。
微小RNA(miRNAs)是一种内源性非编码小RNA,长度约为18~25个核苷酸,通过特异性结合下游靶mRNA的3′UTR区域来调节基因表达[6]。有研究[7]表明,糖尿病影响miRNAs表达,而miRNAs与糖尿病微血管和大血管并发症的发生密切相关。有研究[8]报道,miR-30b-5p在胰岛素敏感和胰岛素抵抗人群的皮下脂肪组织中呈差异性表达,提示miR-30b-5p可能在糖尿病发生过程中起作用。臂板蛋白3A多肽(Sema3A)是Sema家族的成员,其家族已鉴定出20多种类型[9],Sema3A在心脏发育、血管生成、肿瘤转移、破骨细胞生成和免疫调节中均发挥作用[10]。本研究以人脐静脉内皮细胞HUVECs为研究对象,观察miR-30b-5p是否通过Sema3A影响HUVECs细胞的增殖、凋亡、迁移与血管形成,旨在为糖尿病足病伤口愈合机制的研究提供实验依据。
1 材料与方法
1.1 主要试剂与仪器
人脐静脉内皮细胞HUVECs购自美国模式培养物研究所;FBS、1%青霉素/链霉素均购自美国Gibco公司;DMEM培养基、Trizol购自美国Invitrogen公司;高糖(25 mmol·L-1)购自美国Sigma公司;CCK-8溶液及凋亡试剂盒购自上海碧云天生物技术有限公司;Matrigel购自Becton-Dickinson公司;RNA提取试剂盒购自北京天根生化科技有限公司;SuperScript Ⅳ试剂盒、PowerUpTMSYBRTMGreen Master mix均购自美国赛默飞公司;荧光素酶载体pGL3及双萤光素酶报告基因检测试剂盒购自普洛麦格生物技术有限公司。LiPofectamine 2000购自美国Invitrogen公司;mimic NC、miR-30b-5p mimic、pcDNA3.1-NC、pcDNA3.1-Sema3A均购自上海吉凯基因医学科技股份有限公司;多功能酶标仪购自美国BioTek公司;流式细胞仪及ABI ViiA 7 System均购自美国赛默飞公司。
1.2 方法
1.2.1 细胞培养与处理
HUVECs细胞用正常葡萄糖(5 mmol·L-1)或高糖(25 mmol·L-1)添加10% FBS和1%青霉素/链霉素DMEM培养基培养,取对数期生长细胞用于后续实验。
HUVECs细胞进行6种不同处理:blank组:正常葡萄糖培养的HUVECs细胞;HG组:高糖培养的HUVECs细胞;HG+mimic-NC组:高糖培养HUVECs细胞转染mimic-NC;HG+mR-30b-5p mimic:高糖培养HUVECs细胞转染miR-30b-5p mimic;HG+miR-30b-5p mimic+oe-NC组:高糖培养HUVECs细胞共转染miR-30b-5p mimic及pcDNA3.1-NC;HG+miR-30b-5p mimic+oe-Sema3A组:高糖培养HUVECs细胞共转染miR-30b-5p mimic及pcDNA3.1-Sema3A。
1.2.2 CCK-8实验
各组以3000 个·孔-1细胞密度接种于96孔板中,待细胞贴壁后,培养0、12、24、48、72 h后加入10 μL CCK-8溶液处理1 h。使用多功能酶标仪测定各孔450 nm处的OD值。
1.2.3 流式细胞术
各组细胞用0.25%胰蛋白酶消化后按照细胞凋亡试剂盒说明书,用500 μL结合缓冲液将细胞重悬,依次向细胞中加入Annexin V(5 μL)和PI(10 μL),并在室温下避光孵育10 min。使用流式细胞仪检测细胞凋亡,ModFiLT软件(4.1版本)分析细胞凋亡率。
1.2.4 细胞划痕实验
各组以5×105个·孔-1细胞密度接种于六孔板中,培养至约100%融合后使用100 μL无菌微量移液器吸头进行划痕,用PBS清洗细胞2次,并用无血清培养基继续培养。在划痕后0、24 h分别在相同位置用倒置显微镜拍照,每组采集3个独立视野图像。使用ImageJ软件对划痕的宽度进行定量,评估迁移情况。
1.2.5 血管形成实验
24孔板中加入100 μL液化Matrigel,将孔板置于37 ℃下,直至Matrigel凝固。然后,将各组细胞接种于24孔板中。8 h后,使用倒置显微镜观察HUVECs的管状分枝形成情况并拍照。使用ImageJ软件对血管的分枝数目及长度进行量化。
1.2.6 实时定量PCR(qRT-PCR)
各组以1×105个·孔-1细胞密度接种于6孔板中,RNA提取试剂盒提取总RNA,SuperScript IV试剂盒进行逆转录合成cDNA,PowerUpTMSYBRTMGreen Master mix和ABI ViiA 7 System进行qRT-PCR。PCR条件:95 ℃初始变性120 s,95 ℃变性15 s,60 ℃延伸60 s,循环40次。用2-ΔΔCT方法[11]进行定量,U6作为miR-30b-5p的内参,GAPDH作为Sema3A的内参。引物序列见表1。

表1 引物序列
1.2.7 双荧光素酶报告实验
于Starbase(https://starbase.sysu.edu.cn/)、Targetscan(http://www.targetscan.org/vert_72/)、miRDB(http://mirdb.org/)网站进行miR-30b-5p和Sema3A的靶向结合位点预测分析,将结合序列及突变的序列分别克隆至荧光素酶载体pGL3中构建野生型(Sema3A-WT)和突变型(Sema3A-MUT)荧光素酶质粒。将Sema3A-WT或Sema3A-MUT分别与miR-30b-5p mimic或mimic NC共转染至HUVECs细胞中,48 h后收集细胞,用双荧光素酶报告基因检测试剂盒评估荧光素酶活性。
1.2.8 统计学方法
采用SPSS21.0软件和GraphPad Prism 8.0软件进行数据处理。所有数据均采用均值±标准差表示;2组间比较采用独立样本t检验;多组间比较采用单因素方差分析,采用Tukey检验进行多重比较。以P<0.05为差异有统计学意义。
2 结果
2.1 miR-30b-5p逆转高糖对HUVECs细胞的影响
qRT-PCR结果显示,HG组miR-30b-5p表达较blank组更低,而HG+miR-30b-5p mimic组miR-30b-5p的表达较HG+mimic-NC组更高(均P<0.05)。见图1A。CCK-8实验结果显示,HG组较blank组细胞活力更低,HG+miR-30b-5p mimic组细胞活力较HG+mimic-NC组更高(均P<0.05)。见图1B。流式细胞术结果显示,HG组细胞较blank组细胞凋亡率更高,HG+miR-30b-5p mimic组细胞凋亡率较HG+mimic-NC组更低(均P<0.05)。见图1C。细胞划痕实验显示,HG组细胞较blank组细胞迁移能力更低,HG+miR-30b-5p mimic组细胞迁移能力较HG+mimic-NC组更高(均P<0.05)。见图1D。血管生成实验显示,HG组分枝数量较blank组血管生成能力更少,HG+miR-30b-5p mimic组分枝数量较HG+mimic-NC组更多(均P<0.05)。见图1E。

A:qRT-PCR实验;B:CCK-8实验;C:流式细胞术;D:细胞划痕实验;E:血管生成实验。1组:blank组;2组:HG组;3组:HG+mimic-NC组;4组:HG+mR-30b-5p mimic组。*P<0.05。
2.2 miR-30b-5p靶向抑制Sema3A
3个网站预测miR-30b-5p的下游靶基因数目及交集情况,见图2A。miR-30b-5p与Sema3A的结合位点,见图2B。双荧光素酶报告实验显示,miR-30b-5p与Sema3A具有靶向结合关系(P<0.05)。见图2C。qRT-PCR结果显示,HG组Sema3A mRNA表达水平较blank组更高,而HG+miR-30b-5p mimic组Sema3A mRNA表达水平较HG+mimic-NC组更低(均P<0.05)。见图2D。
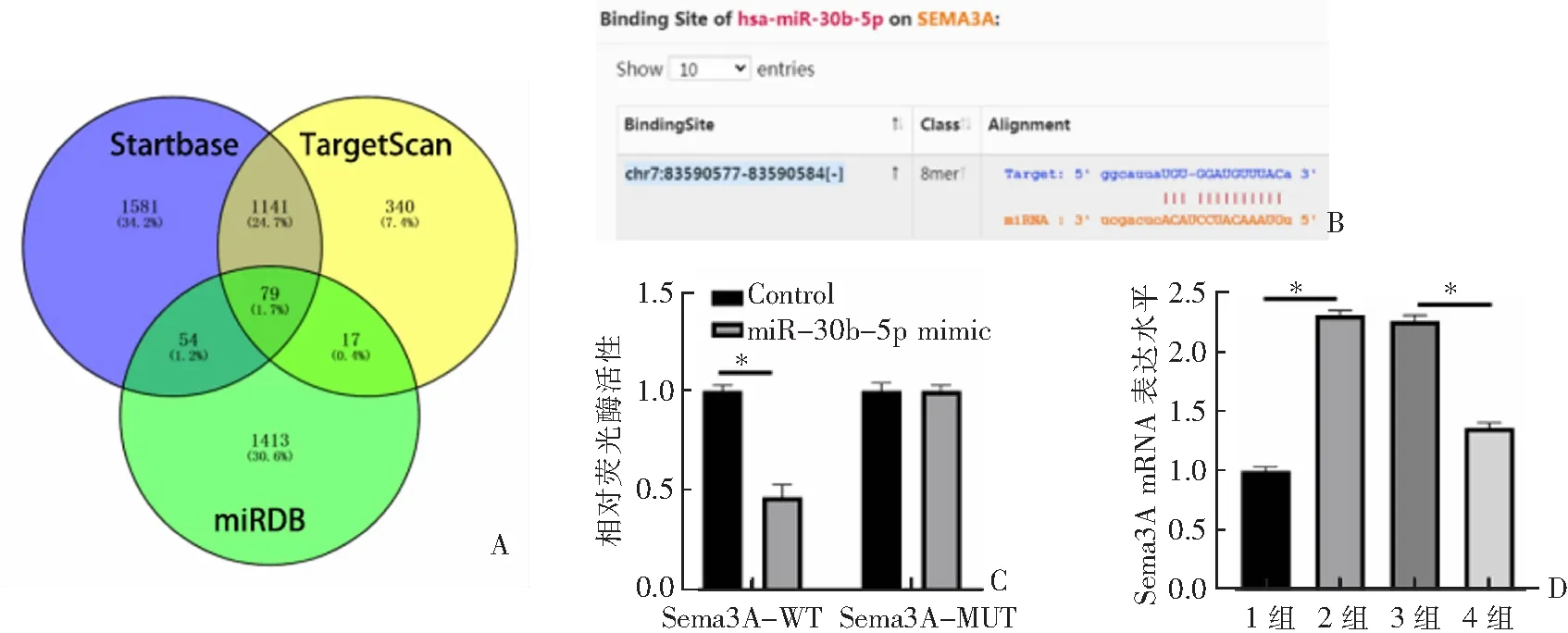
A:3个网站预测miR-30b-5p的下游靶基因情况;B:miR-30b-5p与Sema3A的结合位点;C:双荧光素酶实验;D:qRT-PCR实验。1组:blank组;2组:HG组;3组:HG+mimic-NC组;4组:HG+mR-30b-5p mimic组;*P<0.05。
2.3 过表达Sema3A部分抵消miR-30b-5p对高糖HUVECs细胞的保护作用
qRT-PCR结果显示,HG+miR-30b-5p mimic+oe-Sema3A组Sema3A mRNA表达较HG+miR-30b-5p mimic+oe-NC组上调(P<0.05)。见图3A。CKK-8结果显示,HG+miR-30b-5p mimic+oe-Sema3A组细胞活力较HG+miR-30b-5p mimic+oe-NC组下降(P<0.05)。见图3B。流式细胞术结果显示,HG+miR-30b-5p mimic+oe-Sema3A组细胞凋亡率较HG+miR-30b-5p mimic+oe-NC组增加(P<0.05)。见图3C。细胞划痕实验显示,HG+miR-30b-5p mimic+oe-Sema3A组细胞迁移能力较HG+miR-30b-5p mimic+oe-NC组更低(P<0.05)。见图3D。血管生成实验显示,HG+miR-30b-5p mimic+oe-Sema3A组分枝数量较HG+miR-30b-5p mimic+oe-NC组更少(P<0.05)。见图3E。
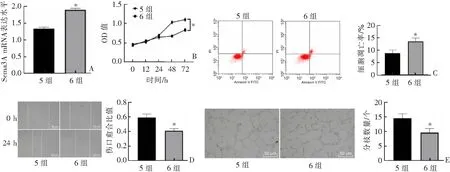
A:qRT-PCR实验;B:CCK-8实验;C:流式细胞术;D:细胞划痕实验;E:血管生成实验。5组:HG+miR-30b-5p mimic+oe-NC组;6组:HG+miR-30b-5p mimic+oe-Sema3A组。*P<0.05与5组比较。
3 讨论
作为细胞生理的关键调节因子,miRNAs的紊乱可导致许多病理状态[12]及疾病[13]。差异表达的miRNAs与2型糖尿病及其并发症相关[14],故这些miRNAs可用于糖尿病及其并发症诊断或治疗的生物标志物。DFU患者的内皮细胞衰老且其血管生成能力不足[15],而内皮细胞血管生成能力与高水平葡萄糖之间存在直接联系[16]。大量研究[17-19]显示,恢复人脐静脉内皮细胞HUVECs的功能可以加速DFU的伤口愈合。本研究建立高糖HUVECs细胞模型,探讨miR-30b-5p在HUVECs增殖、凋亡、迁移和血管生成中的作用。本研究发现,高糖培养条件下miR-30b-5p表达水平显著下降,且HUVECs细胞增殖、迁移和血管形成能力受到抑制,细胞凋亡率增加,而上调miR-30b-5p表达能够部分逆转HUVECs的增殖、凋亡、迁移、血管形成能力。这些研究提示,miR-30b-5p可能通过促进血管内皮细胞的血管形成影响DFU伤口愈合的发生发展。
Sema3A由结合受体neuropilin1和信号受体plexinA作为共受体,参与细胞迁移、血管生成等过程调节[20]。此外,ZHANG等[21]研究显示Sema3A对糖尿病性骨病成骨分化能力具有调控作用。本研究结果显示,高糖促进Sema3A mRNA表达,而过表达miR-30b-5p可抑制其mRNA表达;同时,双荧光素酶报告实验显示miR-30b-5p对Sema3A存在靶向调控关系。进一步通过外源性过表达Sema3A发现,过表达Sema3A可抑制HUVECs细胞增殖、迁移和血管形成能力,增加细胞凋亡率。这些研究表明miR-30b-5p靶向负调控Sema3A,Sema3A过表达可部分抵消miR-30b-5p对HUVECs增殖、迁移、凋亡和血管形成能力的作用。
综上,本研究在细胞水平证实miR-30b-5p表达可减轻高糖诱导的HUVECs细胞的损伤作用,且miR-30b-5p的这种作用可能是通过负调控Sema3A而实现的,这将为进一步探讨糖尿病足病防治机制研究提供理论基础。然而,本研究局限于细胞水平,未来应在动物整体水平对结果进行验证。
