基于LC-MS/MS 多反应监测技术的食管鳞状细胞癌能量代谢物分析
2023-11-11董宇航高海霞崔晓宾
董宇航, 高海霞, 崔晓宾,3, 李 锋
(1.石河子大学医学院病理系,新疆 石河子 832002;2.新疆医科大学附属肿瘤医院病理科,新疆乌鲁木齐 830011;3.南京大学医学院附属鼓楼医院病理科,江苏 南京 210008)
食管癌在全球恶性肿瘤中发病率为第7 位,死亡率居第6 位[1]。食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)是最常见的食管癌组织亚型,主要特征是进行性发展且预后较差[2]。虽然手术切除和放化疗等综合治疗可以提高患者的生存率,但ESCC 患者的5 年生存率仅为15%~25%[3]。探讨ESCC 的差异能量代谢物有助于早期识别ESCC。恶性肿瘤发展的显著特征是代谢过程和代谢重编程的改变,因此代谢组学成为近年来研究的热点之一,代谢失调已被证明是上消化道肿瘤发生的基础。研究[4]显示:食管癌患者的血清代谢组学(糖酵解、三羧酸循环、能量代谢和氨基酸代谢)均有变化。研究[5]显示:食管癌患者多发生氨基酸、脂肪酸、糖和三羧酸循环等代谢紊乱。尽管血清代谢物在多种肿瘤的发生发展中发挥重要作用,但尚未有研究聚焦于ESCC 能量代谢, ESCC 发生与血清能量代谢物的关系尚未完全阐明。本研究将非靶向代谢组学与靶向代谢组学结合, 采用超高效液相色谱串联质谱 (liquid chromatography-tandem mass spectrometry,LC-MS/MS)技术检测ESCC 患者和健康志愿者的血清代谢组分, 并采用多反应监测(multi-response monitoring,MRM)模式筛选潜在的差异性能量代谢物,寻找异常能量代谢途径,为阐明ESCC 患者和健康人群之间的能量代谢差异及其本质提供依据。
1 资料与方法
1.1 研究对象
收集2021 年3—5 月石河子大学第一附属医院确诊的7 例ESCC 患者作为ESCC 组,对照组研究对象为 2021 年 5 月在石河子大学第一附属医院体检的7 名健康成年人。诊断标准:符合中国国家卫生健康委员会发布的食管癌诊疗规范(2018 年版)临床诊断标准,并经病理学确诊。纳入标准:①符合ESCC 的临床诊断标准的初治患者;②自愿参与研究,并签署知情同意书。排除标准:①妊娠或哺乳期妇女;②糖尿病;③患有严重的血液系统疾病;④存在重要脏器功能损害;⑤存在其他原发性肿瘤。本研究经石河子大学第一附属医院伦理委员会审批,伦理学审批编号:KJ2021-057-01。
1.2 主要试剂和仪器
乙酸铵、甲醇和乙腈为能量代谢标准品。质谱仪:AB Triple TOF 6600 和5500 QTRAP,Agilent 1290 Infinity LC 超高效液相色谱仪。
1.3 代谢物提取
采集2 组研究对象肘静脉血,收集血清存放于-80 ℃。4 ℃溶解,血清、甲醇乙腈分别为100 和400 μL,1 min 涡旋混匀,置于-20 ℃冰箱60 min 使蛋白缓慢沉淀,低温离心20 min 后取上清,冷冻干燥后于-80 ℃保存。检测时加入 0.1 mL乙腈混匀,离心15 min(14 000 r·min-1)。代谢物等级鉴定:按照2017 年澳大利亚布里斯班代谢组学学会年会上定义的代谢物鉴定可靠性等级[6]进行代谢物的等级鉴定,采用中科新生命本地自建标准品数据库[7-8]搜库。
1.4 LC-MS /MS 技术检测血清代谢物水平
1.4.1 色谱条件 样品采用Agilent 1290 Infinity LC 的超高效液相色谱系统分离。柱温25 ℃,流速500 μL·min-1,进样量2 μL;流 动 相: A 为 水+25 mmol·min-1氨水+和25 mmol·min-1乙酸 铵,B 为乙腈。液相梯度:0~0.5 min,95% B;0.5~7.0 min,95%~65% B;7~8 min,65%~40% B;8~9 min,40% B;9.0~9.1 min,40%~95% B;9.1~12.0 min,95% B。
1.4.2 质谱条件 AB Triple TOF 6600 质谱仪采集一级和二级谱图。电喷雾离子源(electrospray ionization,ESI) 条件:离子源气体(ion soursce gas,Gas) 1-60,Gas2-60,源温度设置为600 ℃,离子喷雾浮动电压(ionsapary voltage floating,ISVF) 为5 500 V,气帘气(curtain gas,CUR)为30。二级质谱采用信息依赖采集(information dependent acquisition,IDA) 和high sensitivity 模式获得。
1.5 MRM 模式靶向筛选差异能量代谢物
1.5.1 色谱条件 流动相:A 为10 mmol·min-1乙酸铵水溶液,B 为乙腈。柱温45 ℃,流速300 μL·min-1, 进 样 量2 μL。 液 相 梯 度: 0~18 min,90%~40% B; 18.0~18.1 min, 40%~90% B;18.1~23.0 min,90% B。
1.5.2 质谱条件 在负离子模式下,质谱分析采用5500 QTRAP 质谱仪。ESI 条件:Gas1-45,Gas2-45,source temperature 450 ℃,ISVF-4500 V,CUR-30。MRM 模式检测待测离子对。
1.6 统计学分析
Wiff 格式的原始数据经 ProteoWizard 转换成mzXML 格式,采用 XCMS 软件进行峰对齐、保留时间校正和提取峰面积。采用Multiquant 软件分析色谱峰的面积和保留时间,保留时间校正采用能量代谢物质标准品。采用Prism 8.0 统计软件对数据进行统计学分析。2 组研究对象血清中代谢物定量值均符合正态分布,以±s表示,2 组间样本均数比较采用两独立样本t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 非靶向能量代谢实验数据质量评级
2.1.1 总体样本主成分分析(principal component analysis,PCA) 将收集到的血清样本和 质量控制(quality control,QC)样本(由ESCC 组和对照组研究对象血清样本等量混合制成)提取得到的峰进行 PCA 分析,结果显示:QC 样本在正离子和负离子这2 种模式下均紧密聚集,表示本实验重复性高。见图1。
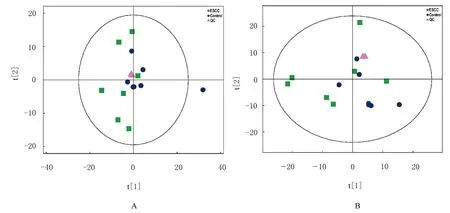
图1 正(A)和负(B)离子模式下总体样本的 PCA 分析Fig.1 PCA analysis on overall samples with positive (A) and negative (B) ion modes
2.1.2 QC 样本Pearson 相关性 对QC 样本进行Pearson 相关性分析。通常相关性系数(r)>0.9代表相关性较好。QC 样本间的r均在0.9 以上,说明本实验重复性较好。见图2。
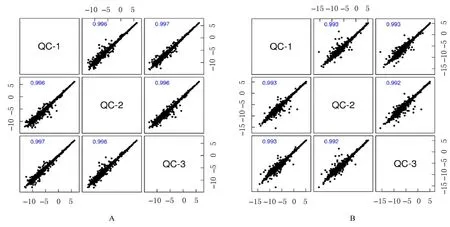
图2 正(A)、负(B)离子模式 QC 样本相关性图谱Fig.2 Correlation maps of QC samples with positive (A) and negative (B) ion modes
2.2 代谢物等级鉴定结果
主要从相对分子质量(误差<25 ppm)、二级碎裂谱图、保留时间和碰撞能等方面对代谢物与本地数据库中的信息进行匹配,并鉴定代谢物结构,经过人工核对,等级至少为2 级。
2.3 非靶向代谢物鉴定数量统计结果
正和负离子2 种模式合并后共鉴定到266 种代谢物,2 种模式分别鉴定到164 及102 种代谢物。
2.4 偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)模型
通过PLS-DA 模型,可以从数据集中筛选出与分组相关的差异代谢物,区分2 组样本。在正、负离子模式下ESCC 组和对照组样本均有一定的区分度,提示2 组血清样本存在代谢差异。见图3。
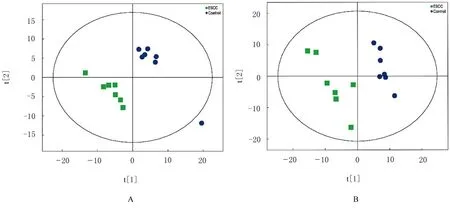
图3 正(A)和负(B)离子模式 PLS-DA 得分图Fig.3 Diagrams of PLS-DA scores with positive (A) and negative (B) ion modes
模型 Q2>0.5,可靠;0.3< Q2≤0.5,较好;若Q2<0.3,可靠性较低。模型评价参数结果显示:正离子模式Q2=0.768,稳定可靠,负离子模式Q2=0.478,稳定性较好。见表1。

表1 PLS-DA 模型参数Tab.1 PLS-DA model parameters
2.5 正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)模型
OPLS-DA 模型结果显示:在正、负离子模式下ESCC 组和对照组均具有一定的区分度,提示2 组血清样本存在代谢差异。见图4 和表2。

表2 PLS-DA 模型参数Tab.2 PLS-DA model parameters
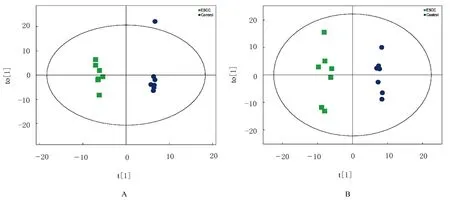
图4 正(A)和负(B)离子模式下OPLS-DA 得分图Fig.4 Diagrams of OPLS-DA scores with positive (A) and negative (B) ion modes
2.6 单变量统计分析
对代谢物进行差异分析时基于单变量分析。采用火山图对变异倍数(fold change,FC) < 0.05或 FC>1.50 的差异代谢物可视化展示见图5。
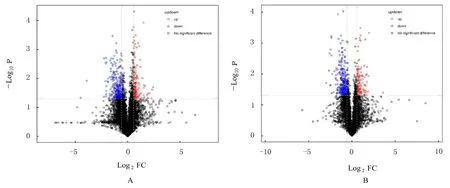
图5 正(A)和负(B)离子模式火山图Fig.5 Volcano maps with positive (A) and negative (B) ion modes
2.7 非靶向代谢物化学分类
根据非靶向代谢物的化学分类归属将鉴定到的 266 种代谢物进行分类,可见脂质和类脂质分子在有化学分类归属的代谢物中占比最高,为18.421%。见图6。
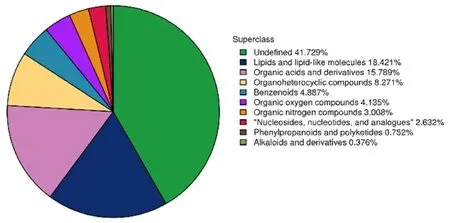
图6 代谢物在各化学分类中占比图Fig.6 Diagram of proportions of metabolites in each chemical classification
2.8 靶向能量代谢物稳定性评价
通过QC 样本评价靶向能量代谢实验的重复性和稳定性。计算代谢物在QC 样本中的相对标准偏差(relative standard deviation, RSD)。 RSD<30%说明本实验所测能量代谢物在样本中的数据稳定可靠。见图7。
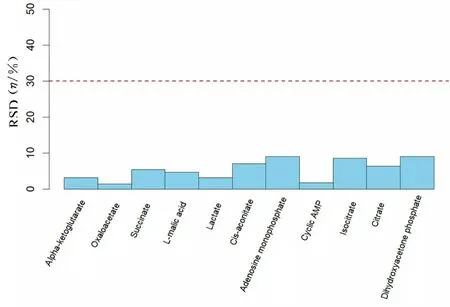
图7 QC 样 本 的RSD 分 布Fig.7 RSD distribution of QC samples
2.9 2 组血清样本中能量代谢物水平
检测氧化磷酸化、糖酵解和三羧酸循环过程中的重要能量代谢物。以P<0.05 为标准,通过MRM 技术筛选 ESCC 组和对照组研究对象血清样本中差异能量代谢物。见表3。显著性差异能量代谢物有环磷腺苷(cyclic adenosine monophosphate,cAMP)、L-苹果酸和异柠檬酸3 种。
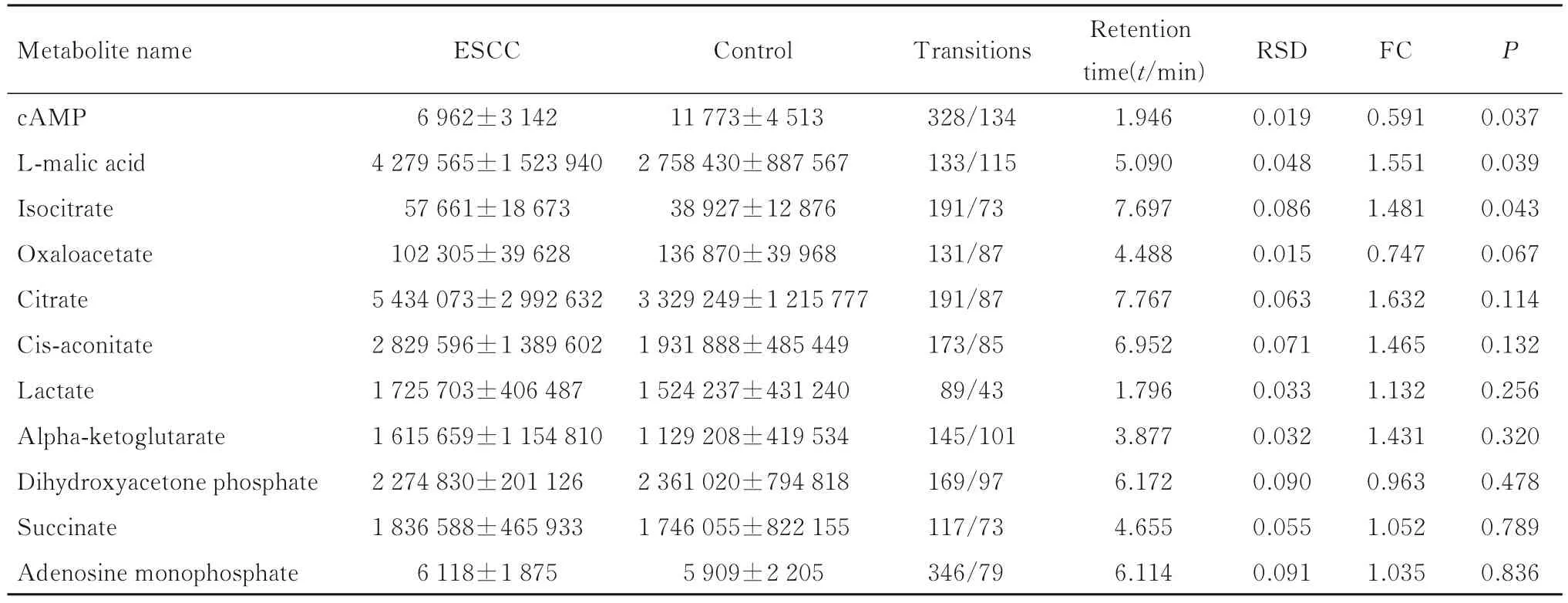
表3 MRM 技术筛选能量代谢物Tab.3 Energy metabolites sreened out by MRM technology
MRM 技术检测结果显示:与对照组比较,ESCC 组患者血清中cAMP 水平降低,而L-苹果酸和异柠檬酸水平升高(P<0.05),其他能量代谢物水平差异无统计学意义(P>0.05)。见图8。
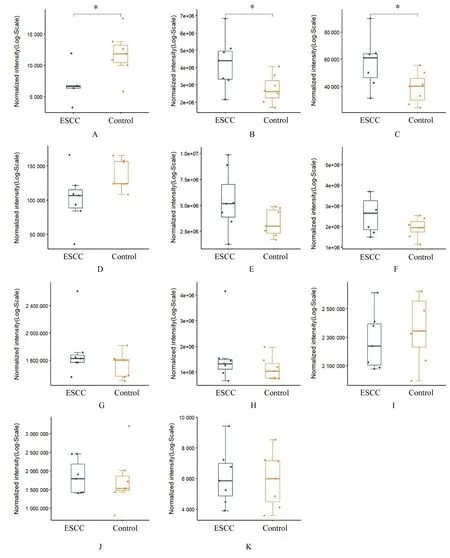
图8 能量代谢物表达量趋势图Fig.8 Trend diagrams of expression amounts of energy metabolites
2.10 显著性差异能量代谢物聚类分析结果
差异能量代谢物聚类热图显示:ESCC 组和对照组研究对象能量代谢物存在差异。见图9。
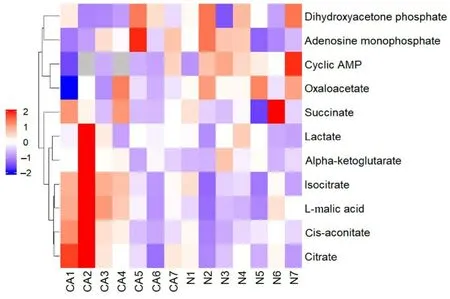
图9 差异能量代谢物层次聚类热图Fig.9 Hierarchical clustering heat map of differential energy metabolites
2.11 差异能量代谢物京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路富集分析
采用MetaboAnalyst 在线网站对差异代谢物进行KEGG 信号通路富集分析确定受到能量代谢影响的通路有三羧酸循环和Warburg Effect 通路。见图10。
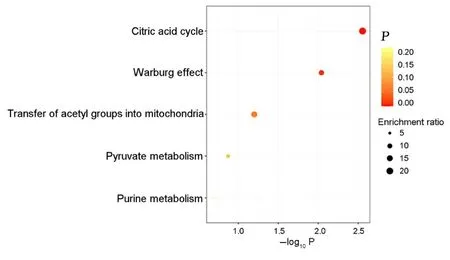
图10 差异能量代谢物KEGG 信号通路富集分析Fig.10 KEGG signaling pathway enrichment analysis on differential energy metabolites
3 讨 论
代谢组学能够更准确、更直接地反映生命体的变化[9]。从检测方式上,代谢组学主要分为非靶向分析和靶向分析2 类。非靶向分析模式通常适合项目前期的基础研究,能够对样本中的各类代谢物进行无偏向、大规模和系统性检测;靶向分析模式通常用于对目标代谢物进行目的性的检测以及对非靶向代谢组筛选到的差异代谢物进行验证。
本研究收集7 例ESCC 患者和7 名健康志愿者血清,鉴定样本中代谢物的结构,结果显示:正和负离子模式合并后鉴定到266 种代谢物。单变量统计分析结果显示:ESCC 组和对照组研究对象血清代谢物存在显著差异,且脂类分子在有化学分类归属的代谢物中占比最高。有研究通过LC-MS/MS技术确定甘油磷脂代谢是与ESCC 发生发展相关的辅因子[10]。氨基酸是癌症中最常改变的代谢物,其与癌症患者氧化代谢、糖异生和能量产生增加有关[11]。脂质和类脂质分子是人体产能的三大营养素之一,因此本研究进一步对血清能量代谢物进行靶向代谢组学分析,从三羧酸循环、氧化磷酸化和糖酵解过程中的重要代谢物中筛选出3 种差异能量代谢物。本研究结果显示:与对照组比较,ESCC组研究对象血清中L-苹果酸和异柠檬酸水平升高,cAMP 水平降低。L-苹果酸和cAMP 是氧化磷酸化途径的重要代谢物,异柠檬酸与三羧酸循环相关。将这3 种差异性能量代谢物通过KEGG 通路富集分析, 结果显示: 其显著富集在三羧酸循环和Warburg Effect 通路。
ESCC 组织中L-苹果酸和异柠檬酸表达上调。L-苹果酸是生物体代谢过程中所产生的重要有机酸。在微生物中,其与多条重要的代谢途径有关,出现于三羧酸循环及其支路乙醛酸循环中[12]。L-苹果酸是生物体细胞内存在的一种活性物质,易于吸收,可以迅速通过细胞膜,进入线粒体内可直接参与能量代谢[13]。异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)可催化异柠檬酸变成α-酮戊二酸(α-ketoglutarate,α-KG) 以及可逆过程的还原羧化[14]。野生型IDH1 和IDH2 可以催化异柠檬酸的氧化脱羧,从而产生α-KG 和CO2[15]。迄今为止,多数关于IDH 在癌症中的研究都集中在其突变状态[16]。研究[17]显示:与癌症相关的IDH1 突变也导致催化异柠檬酸转化为α-酮戊二酸的能力“简单”丧失,从而导致异柠檬酸在体内堆积。本实验研究结果与上述研究结论一致,ESCC 异柠檬酸水平明显升高。
三羧酸循环是能量代谢最为重要的途径之一,其中间产物都被验证可在肿瘤中发挥某些非代谢的功能[18]。研究[19]显示:癌细胞利用三羧酸循环的方式不同于正常细胞,这使得癌细胞可能对三羧酸循环中重新编程的代谢途径的抑制剂更敏感。另一项研究[20]显示:某些癌细胞严重依赖三羧酸循环来产生能量和合成大分子。因此,探讨ESCC 与三羧酸循环或其中间代谢产物的关系可能为ESCC 的靶向治疗提供有效策略。
正常细胞依靠线粒体氧化磷酸化供能。但在氧气充足的情况下,癌细胞也更依靠无氧糖酵解而非氧化磷酸化来产生能量[21-22]。糖酵解通量的增加是肿瘤细胞的代谢策略,以确保细胞在营养缺乏的环境中存活和生长。Warburg Effect 通路可能是一个适应性代谢的过程,其发生是为了避免当细胞被供给 大 量 葡 萄 糖 时 糖 酵 解 停 止[23]。研 究[24]显 示:Warburg 效应促进了许多导致耐药性的肿瘤特征,包括增加的药物流出和DNA 损伤修复、药物的代谢失活、表观遗传改变、药物靶标的突变、存活途径的激活和逃避细胞死亡。此外,Warburg Effect通 路 可 降 低 人ESCC 细 胞 对5-FU 的 敏 感 性[25]。Warburg Effect 通路可能对ESCC 能量代谢发挥关键作用。
本课题组采用非靶向代谢组学方法对 ESCC 患者和健康志愿者血清代谢物进行分析,检测结果显示:在有化学分类归属的代谢物中占比最高的代谢物是脂质和类脂质分子,因此聚焦于能量代谢。基于MRM 技术进一步筛选ESCC 组和对照组研究对象血清中差异能量代谢物,KEGG 通路富集分析发现3 种差异性能量代谢物富集在三羧酸循环和Warburg Effect 通路。本研究结果为指导能量代谢物在ESCC 早期诊断中的应用提供了依据。
