单羧酸转运蛋白1在动物体内的转运调控机制
2023-11-10张佳俐姜雅慧李江凌
张佳俐 代 鹏 姜雅慧 李江凌
(1.四川农业大学动物营养研究所,四川省牛低碳养殖与安全生产高校重点实验室,成都 611130;2.四川农业大学动物科技学院,成都 611130;3.四川省畜牧科学研究院,成都 610066)
动物机体内的乳酸、酮体、丙酮酸、挥发性脂肪酸等单羧酸是细胞内重要的分解代谢产物,也是机体代谢途径中的底物。其中,乳酸和挥发性脂肪酸在机体中发挥重要作用,主要是为机体供能,还能够调控细胞增殖分化、抗炎、增强免疫等,从而维持细胞稳态[1-2]。然而这些单羧酸代谢物的吸收和再分配需要多种转运蛋白协助才能发挥生物学功能,机体内转运单羧酸的蛋白主要为单羧酸转运蛋白(monocarboxylate transporters,MCTs),它们属于溶质转运蛋白家族16(solute carrier family 16,SLC16)。MCTs家族目前已发现14位成员,其中单羧酸转运蛋白1(monocarboxylate transporter 1,MCT1)作为MCTs家族中最早的成员,广泛分布于动物机体组织细胞的质膜上,通过转运单羧酸对维持细胞基本稳态起着关键作用[3]。并且,MCT1的异常表达或功能失活会导致多种不良反应,包括乳酸转运缺陷症(symptom defect lactate transporter,SDLT)、高胰岛素血症(hyperinsulinism)、单羧酸转运蛋白1缺乏症(monocarboxylate transporter 1 deficiency,MCT1D)等[4]。此外,MCT1在多种癌症细胞中的高表达与癌症的发展密切相关[5]。MCT1在动物机体中参与营养物质转运、调节细胞内pH以及控制机体代谢平衡等,这些功能决定了其在动物组织中广泛分布,单胃动物中主要分布在结肠,反刍动物中主要分布在瘤胃和网胃。MCT1在动物体内的表达受转录、翻译以及蛋白质等水平的调控[6]。基于此,本文主要对MCT1在动物体内的定位分布、表达差异、生物学功能及转运调控机制做了系统综述,以期进一步了解MCT1在动物体内的功能和调控机制,以及为动物的营养代谢稳衡提供新的方法。
1 MCT1的基本概述
1.1 MCT1的基因结构
MCTs家族的基因结构已被预测,其中MCT1基因研究最为广泛。MCT1基因位于人类1号染色体12.0~13.2区带附近,长度约44 kb。MCT1上有5个外显子和4个内含子,第1个内含子位于5’端非编码区(5’UTR),其长度大于26 kb,约占整个转录单元的60%,外显子约含500个核苷酸。MCT1基因上具有多个转录调控位点,包括基因启动子特异性蛋白1(specificity protein 1,SP1)、活化因子蛋白2(activity protein 2,AP2)、核因子-κB(nuclear factor-kappa B,NF-κB)[7]等。
1.2 MCT1的蛋白结构
MCT1的蛋白结构目前已被广泛研究,MCT1蛋白由494个氨基酸构成,有C端和N端2个末端,C端的氨基酸更具特异性。疏水性分析表明,MCT1蛋白的二级结构由位于质膜内的N端、C端和12个跨膜α螺旋结构域(transmembrane domain,TM)组成(图1),其中TM6和TM7之间具有一个大的细胞内环,而膜外无大的环状结构,并且TM4和TM5之间存在一个保守序列,对于底物选择和蛋白质稳定性具有重要作用[8]。

图1 MCT1蛋白的二级结构
运用大肠杆菌甘油三磷酸转运蛋白(Escherichiacoliglycerol-3-phosphate transporter,GLpT)的结构和定点突变对MCT1的三维结构进行了建模[9],该三维结构上具“封闭”和“开放”2种构象(图2),并通过膜通道蛋白上的“摇臂开关”机制转换2种构象,从而实现底物的转运。其中,赖氨酸38(K38)、天冬氨酸302(D302)和精氨酸306(R306)残基对MCT1的转运具有重要影响,位于蛋白中央的K38残基对MCT1具有关键作用[10]。
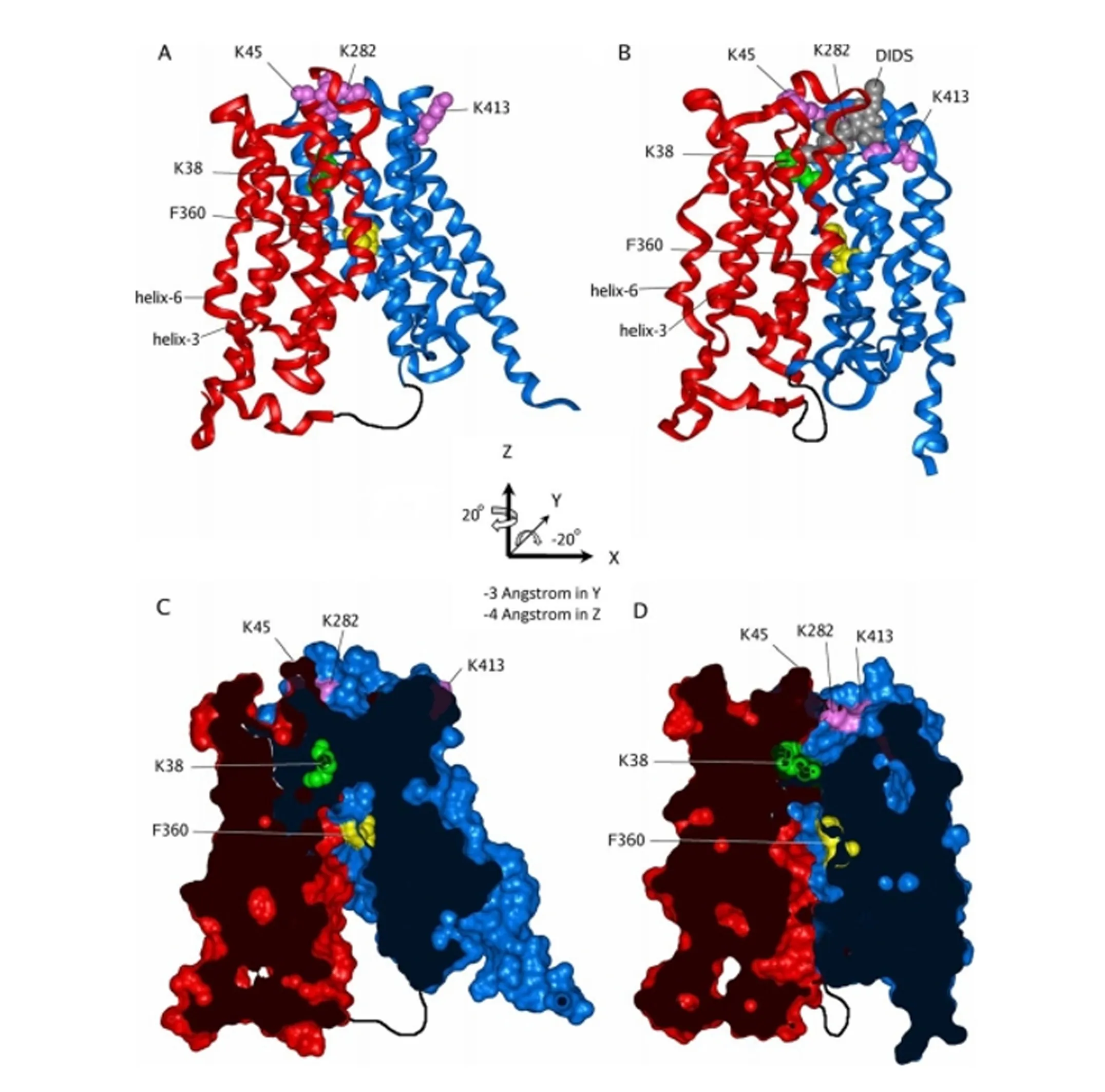
K:赖氨酸 lysine;F:苯丙氨酸 phenylalanine;helix:螺旋;-3 Angstrom in Y:Y轴上平移3埃的距离 translate distance of 3 angstrom on the Y-axis;-4 Angstrom in Z:Z轴上平移4埃的距离 translate distance of 4 angstrom on the Z-axis;DIDS:4,4′-二异硫氰酸基-2,2′-二苯乙烯磺酸二钠 4,4′-diisothiocyano-2,2′-disodium diphenylethene sulfonate。
1.3 MCT1的伴侣蛋白
Kirk等[12]在研究非洲爪蟾卵母和哺乳动物细胞系中发现,共表达MCT1和某种跨膜糖蛋白的细胞中乳酸转运速率比仅表达MCT1的细胞显著增强,这种糖蛋白被验证为CD147,也称为basigin,是一种高度糖基化的单次跨膜蛋白。CD147具有2个免疫球蛋白结构域和1个含谷氨酸跨膜结构域,此结构使得每2个MCT1单体结合1个basigin二聚体,以此帮助MCT1在膜上定位,从而更好地发挥转运功能,故其被称为MCT1的伴侣蛋白[13]。MCT1还可与另一种免疫球蛋白超家族Embigin(又名GP70)结合。免疫共沉淀研究表明,通常CD147与MCT1和单羧酸转运蛋白4(monocarboxylate transporter 4,MCT4)结合,而Embigin与单羧酸转运蛋白2(monocarboxylate transporter 2,MCT2)结合,但缺乏Basigin时,MCT1可与Embigin结合(图3),其结合位置为MCT1的TM3和TM6之间的跨膜区域[10,12]。
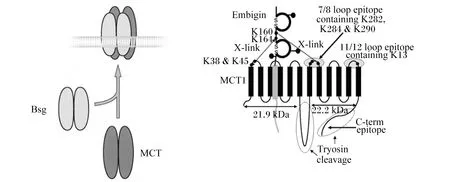
Bsg:Basigin;MCT:单羧酸转运蛋白 monocarboxylate transporter;K:赖氨酸 lysine;C-term epitope:C-末端抗体表位;X-link:X形连接;7/8 loop epitope containing K282,K284 &K290:肽链上7/8环的第282位、284位和290位赖氨酸;11/12 loop epitipe containing K13:肽链上11/12环的第13位赖氨酸;Tryosin cleavage:胰蛋白酶裂解。
2 MCT1在动物体内的分布和表达
2.1 神经系统
生长中的神经元能够通过MCT1在血脑屏障中转运单羧酸获得能量,此外,机体处于病理情况(糖尿病、长期饥饿、高血糖、脑缺血)下神经元更偏向利用乳酸和酮体作为能源物质[15]。神经胶质细胞为大脑血脑屏障的组成部分,通过体外培养的人脑细胞研究发现,MCT1分布在星形胶质细胞、少突胶质细胞、小胶质细胞、室管膜细胞中,并且星形胶质细胞中分布较多[16]。周围神经系统也表达MCT1,蛋白质免疫印迹和原位杂交结果显示,MCT1与葡萄糖转运蛋白1(glucose transporter1,GLUT1)共表达于小鼠的坐骨神经的神经外鞘中[17]。小鼠中进一步研究表明,MCT1定位在有髓神经纤维上的施万细胞中[18]。
2.2 运动系统
剧烈运动时,肌细胞无氧呼吸产生大量乳酸,MCT1转运乳酸为运动系统中的骨骼肌供能,MCT1在骨骼肌中表达较丰富。根据肌球蛋白和线粒体数量,骨骼肌可被分为3种类型:慢缩氧化型(slow oxidative,SO)、快缩氧化糖酵解型(fast oxido-glycolytic,FOG)和快缩酵解型(fast glycolytic,FG)。大鼠中检测到MCT1分布在骨骼肌的SO和FOG纤维膜上[19]。大鼠中缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)对MCT1的表达研究进一步表明,MCT1的表达量顺序为质膜>三联管膜>肌质网膜=T小管膜>细胞内膜[20]。
2.3 生殖系统
乳酸是生殖细胞的优先能源底物,睾丸中的支持细胞产生乳酸和丙酮酸,并将其提供给精原细胞和精子。Garcia等[21]首次在仓鼠生精小管和附睾导管中检测到MCT1,并在附睾导管尾部消失。小鼠和大鼠中检测到MCT1表达于精子、精原细胞、精母细胞中,且精原细胞中表达量较高;同时MCT1在支持细胞和间质细胞中也表达,但其研究结果有所差异[22]。而MCT1在女性整个生殖道都表达,其主要定位于颗粒细胞、输卵管纤毛细胞和阴道上皮细胞中,其中颗粒细胞中表达量最高[23]。
2.4 消化系统
胃肠道是哺乳动物消化系统的主要组成,对营养物质的消化吸收起着重要作用,其中,碳水化合物通过发酵在胃肠道中产生大量单羧酸,故MCTs在胃肠道表达最为丰富。MCT1是胃肠道最重要的MCTs亚型,且在胃肠道的不同部位表达有所差异。MCT1在单胃动物结肠(或盲肠)中表达丰富,小肠和胃次之,小肠的表达强度取决于绒毛和隐窝位置。小鼠和大鼠的盲肠中MCT1表达最为丰富,其次是结肠,但在胃和小肠中略低[24];猪的大肠中MCT1表达量大约是小肠的20倍[25];人肠道中MCT1的表达量顺序为结肠>小肠>胃[26];肠上皮细胞属于单层细胞,其细胞膜分为顶膜和外侧膜2层。最初在猪和人中发现MCT1定位于的结肠顶膜和外侧膜上参与丁酸盐的运输,之后在小鼠和大鼠检测到MCT1主要定位于在肠上皮细胞基底外侧膜[27-28]。反刍动物的胃肠道中MCT1表达也很丰富,但其分布表达与单胃动物有所不同。成年绵羊中MCT1的表达量顺序为瘤胃>网胃>瓣胃>盲肠>结肠>皱胃>小肠[29]。而犊牛MCT1的表达量顺序为瘤胃>网胃>瓣胃,结肠、空肠、盲肠、回肠、盲肠的MCT1表达量差异不大,皱胃和十二指肠的MCT1表达量相对较低[30]。MCT1在小牛和成年母奶牛的胃肠道中存在,瘤胃中表达最丰富[31]。瘤胃中4个部位的MCT1表达量顺序为瘤胃腹囊>瘤胃前庭>后背盲囊>瘤胃背囊[32]。瘤胃上皮细胞与肠上皮细胞有所不同,其由角质层、颗粒层、棘状层和基底层4层细胞构成,MCT1大量分布在瘤胃棘层和基底层的细胞基底外侧膜[33]。
3 MCT1在动物体内的生物学功能
3.1 参与营养物质的转运
碳水化合物通过单胃动物的后肠和反刍动物瘤胃中的微生物产生的大量单羧酸(短链脂肪酸、乳酸)被机体作为能源利用,研究表明,单羧酸必须通过MCT1的主动转运进入循环系统才能作为能源物质被机体利用[34]。此过程中,MCT1有2种运输机制,从而使得单羧酸转运到血液循环中,第一种是氢离子(H+)共转运机制,单羧酸解离产生大量H+使得MCT1上的赖氨酸(Lys)38发生质子化,从而有利于将单羧酸盐结合在转运蛋白上,单羧酸再被传递给MCT1上的天冬酰胺(Asp)和精氨酸(Arg)电子对(Asp302-和Arg306+),并通过Lys38去质子化和Asp302-、Arg306+暴露于细胞质,从而单羧酸被释放于血液中,此机制中H+和羧酸盐以1∶1的比例同向转运,实现单羧酸的吸收,故称为H+共转运机制。同时,H+共转运机制中H+在小肠上皮刷状缘膜产生电化学梯度促进了氨基酸、小分子肽等与H+在小肠上的共转运[35]。第2种转运机制是与碳酸氢根(HCO3-)有关,已在大鼠远端结肠、豚鼠盲肠和近端结肠、人类结肠、猪近端结肠、小马结肠及绵羊结肠中证实,该过程中一部分未解离单羧酸和解离的单羧酸盐通过被动扩散交换HCO3-进入肠道细胞中,再通过MCT1的转运作用进入血液中,其具体的转运过程尚不清楚[36]。无论哪种机制都离不开MCT1的作用,因此,通过调控MCT1的表达强弱可间接影响单羧酸在动物体的能量利用过程。
3.2 作为癌症治疗的靶点
癌细胞中会发生Warburg效应,细胞代谢从氧化磷酸化转变为糖酵解,从而产生大量乳酸,会上调MCT1的表达,影响癌细胞与正常基质细胞的代谢[37]。Sun等[38]阐述了MCT1通过在癌细胞、正常基质细胞、免疫细胞之间运输乳酸从而对它们的代谢产生影响,如增殖、免疫等。Miranda-Gonçalves等[39]在胶质瘤细胞中发现AR-C155858分别对MCT1进行分子和化学抑制,导致MCT1转运乳酸减少,从而减少癌细胞和血管内皮细胞生成。Guan等[40]在小鼠乳腺癌中比较AZD3965(MCT1的特异性抑制剂)和α-氰基-4-羟基肉桂酸(CHC)的抑制效果,相对于CHC,使用AZD3965减少了肿瘤体积和白细胞数量。此外,MCT1还参与癌细胞摄取化疗药物,通过它们在癌细胞中的高表达可以介导化疗剂进入细胞并选择性杀死癌细胞,即MCT1将成为化疗反应的介体[41]。目前,靶向MCT1来调控癌细胞的代谢,从而开发治疗癌症的抑制剂是MCT1的一个研究热点[42]。
3.3 维持葡萄糖代谢平衡
在缺氧条件下,细胞内的糖酵解作用产生大量乳酸、丙酮酸和酮体等物质。细胞内的单羧酸类代谢物(乳酸、丙酮酸、酮体)过多产生会使细胞内环境酸化,并阻碍细胞内糖酵解的进行,从而影响细胞生长。因此,细胞内单羧酸的外排对于细胞的正常代谢非常重要,MCT1是动物机体中表达最为广泛的MCTs亚型,可通过调控其活性,促进单羧酸进入血液循环,发生糖异生作用和生成其他脂质,从而实现葡萄糖稳衡。单胃动物肝脏中通过MCT1将L-乳酸转运到肝细胞中进行糖异生[43]。成年反刍动物中,胰岛素通过影响MCT1的启动子活性,从而调控肝脏中丙酸的糖异生作用[44]。
3.4 调节胃肠道细胞内pH
胃肠道中转运羧酸盐的同时,MCT1的2种转运机制都会导致H+大量进入细胞内,细胞内的pH也因此受到影响,特别是反刍动物瘤胃中表现明显。Kirat等[45]在牛盲肠中发现MCT1转运羧酸盐的同时调控细胞内的pH。Aschenbach等[46]阐述了瘤胃中转运单羧酸时pH的调控过程:一进入瘤胃上皮细胞内就会解离,产生大量H+,这些H+可通过钠离子(Na+)-HCO3-共转运中和或由Na+-H+交换从基底外侧膜排出细胞外,丁酸被代谢为酮体(即β-羟基丁酸、乙酰乙酸),丙酸在细胞内被部分代谢为乳酸。这些代谢产物通过MCT1从基底外侧膜排出,同时也排出了H+,从而调节细胞内pH。
4 MCT1的分子调控机制
4.1 转录水平的调控
MCT1在转录上的调控主要通过多种转录因子与启动子的作用来进行(图4)。Saksena等[47]在肠道细胞中丁酸盐的转运吸收中发现,蛋白激酶C(protein kinase C,PKC)激动剂佛波醇12-肉豆蔻酸13-乙酸酯(phorbol 12-myristate 13-acetate,PMA)通过诱导AP2活化因子过度表达刺激了MCT1的启动子,从而上调了MCT1表达。Borthakur等[48]在结肠Caco-2细胞系中发现,利用NF-κB抑制剂可显著抑制丁酸对MCT1启动子的上调作用,并且证明了MCT1启动子的作用区域为-229~+91。Doherty等[49]在淋巴瘤中发现原癌基因c-myc直接与MCT1的启动子相互结合,从而增强MCT1启动子的转录,促进了MCT1的表达。Wang等[50]在胃癌中发现,原癌基因MACC-1促进MCT1的表达。此外,Aveseh等[51]在乳腺癌中发现,运动通过激活雌激素相关受体α(estrogen-related receptor α,ERRα)抑制了MCT1的表达,其相关转录因子过氧化物酶体增殖物激活受体-γ共激活因子-1α(peroxisome proliferator-activated receptor γ coactivator-1α, PGC-1α)调控尚未证实。Diehl等[52]在结肠癌中发现MCT1 mRNA和蛋白质表达随着核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)表达的增加而增加,但是否与启动子作用尚不清楚。Benesch等[53]在绵羊瘤胃上皮细胞中发现,过氧化物酶增殖体激活受体α(peroxisome proliferator activated receptor α,PPARα)通过激活PPARα的靶基因脂酰辅酶A氧化酶(acyl-CoA oxidase,ACO)间接促进MCT1的基因转录,但这种上调并未观察到明显的蛋白表达增加。
4.2 转录后和翻译后水平的调控
MCT1转录后调控主要通过miRNA与MCT1 mRNA上的特异性序列结合,导致转录的MCT1 mRNA分子降解,如miR-29a、miR-29b、miR-495等[54]。Wu等[55]在胰腺导管癌中发现miR-124与MCT1的3′UTR非翻译区结合,从而使MCT1表达降低。Komoll等[56]在肝癌中发现MCT1 mRNA与miR-342-3p表达负相关,但结合的MCT1 mRNA的特定区域并不清楚。MCT1的表达还受翻译后调控。Smith等[57]研究发现,脑血管内皮细胞系(RBE4)中β肾上腺素能以受体介导的途径激活腺苷酸环化酶,进而环腺苷酸(cAMP)发出信号减少MCT1的磷酸化,从而MCT1的蛋白表达降低。Baaske等[58]研究发现,通过10 mmol/L丁酸盐激活绵羊瘤胃上皮中G蛋白偶联受体109(G protein-coupled receptor 109,GPR109)和游离脂肪酸受体2(free fatty acid receptor 2,FFAR2)可降低细胞内cAMP水平,从而减少MCT1的磷酸化,增加MCT1蛋白的活性。Liu等[59]发现RBE4中通过激活Wnt/β-连环蛋白(β-catenin)信号通路,减少了溶酶体系统中MCT1的泛素化,从而上调MCT1表达,并且该调控需要在Notch信号途径的作用下才能发生。Diers等[60]在乳腺癌中发现MCT1蛋白上的半胱氨酸通过巯基亚硝化作用抑制MCT1的表达。
4.3 蛋白质的间接调控
MCT1的表达也可通过间接与蛋白质作用改变其活性从而调控。CD147是MCT1的辅助蛋白,即CD147的表达对于MCT1的活性起着重要作用。Aspatwar等[36]在非洲爪蟾卵母细胞中发现催化无活性的碳酸酐酶Ⅱ(carbonic anhydrase Ⅱ,CAⅡ)可通过CAⅡ的64位上组氨酸(His)残基与MCT1 C末端的谷氨酸(Glu)残基簇结合来提高MCT1的活性。Slomiany等[61]在肿瘤中发现透明质酸与透明质酸受体(CD44)结合有利于乳腺癌细胞质膜中的MCT1定位和转运功能。Hashimoto等[62]在L6大鼠骨骼肌细胞中发现MCT1和乳酸脱氢酶、细胞色素C氧化酶在线粒体中共免疫沉淀,表明至少在这些细胞的线粒体水平上,MCT1和乳酸脱氢酶、细胞色素C氧化酶存在相互作用,并与线粒体乳酸氧化复合物的形成有关。Sun等[38]进一步在大脑和癌症中指出LDH的一种调节机制:糖酵解型细胞中存在高糖酵解代谢,脑中葡萄糖通过葡萄糖转运蛋白(glucose transporters,GLUTs)进入糖酵解型细胞中,并依次通过糖酵解和乳酸脱氢酶A的作用生成乳酸和ATP,乳酸通过MCT1转入到氧化型细胞,在乳酸脱氢酶B作用下氧化成丙酮酸。这表明LDH与MCT1之间的调控机制与转运方向有关,但该机制还存在争议。
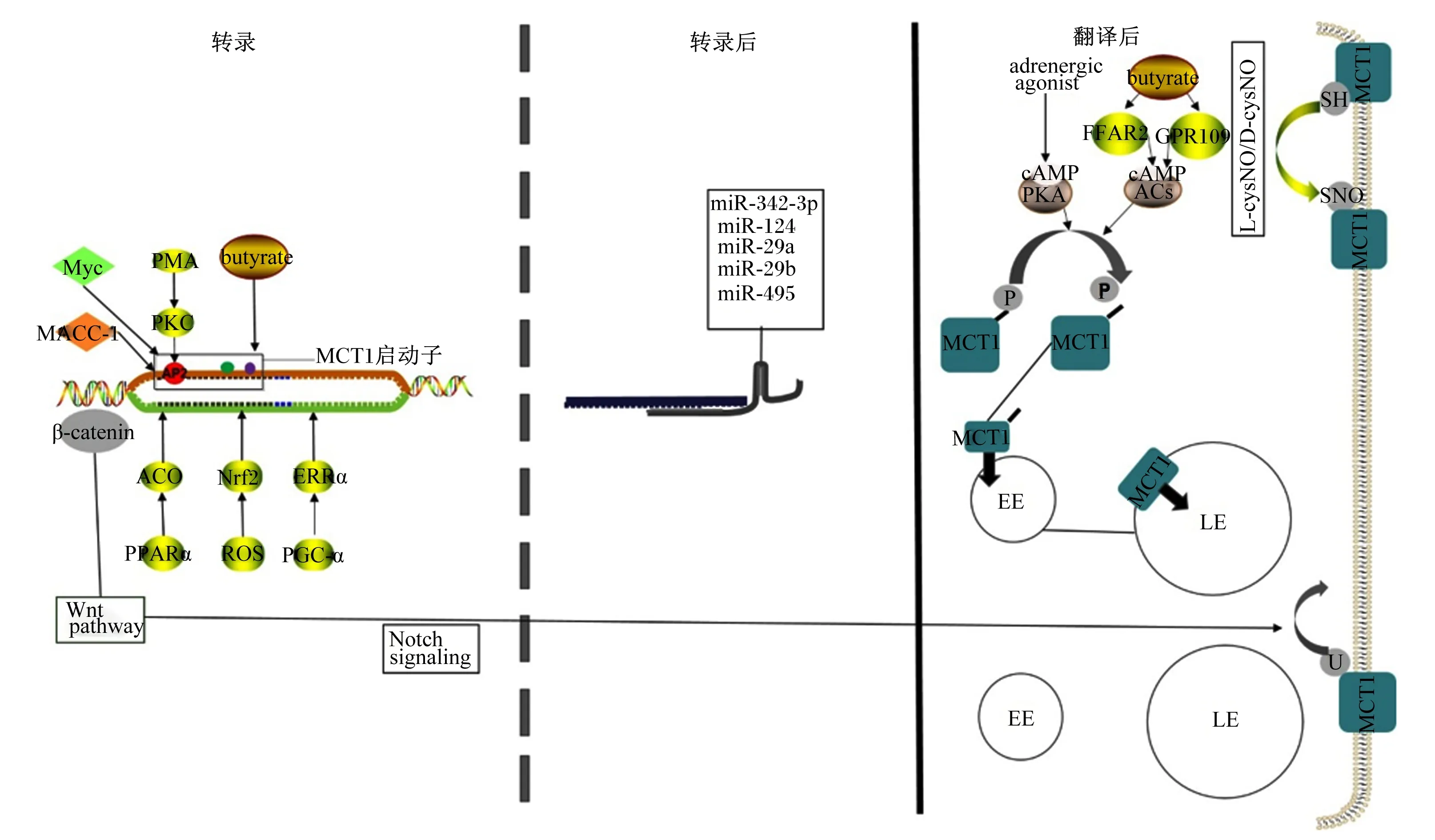
AP2:活化因子蛋白2 activity protein 2;Myc:原癌基因Myc protooncogene Myc;MACC-1:原癌基因MACC-1 protooncogene MACC-1;β-catenin:β-连环蛋白;Wnt pathway:Wnt通路;Notch signaling:Notch信号;PMA:佛波醇12-肉豆蔻酸13-乙酸酯 phorbol 12-myristate 13-acetate;PKC:蛋白激酶C protein kinase C;PPARα:过氧化物酶增殖体激活受体 peroxisome proliferator activated receptor-α;ACO:脂酰辅酶A氧化酶 acyl-CoA oxidase;ROS:活性氧 reactive oxygen;Nrf2:核因子E2相关因子2 nuclear factor E2-related factor 2;butyrate:丁酸;adrenergic agonist:肾上腺素能激动剂;MCT1:单羧酸转运蛋白1 monocarboxylate transporter 1;PKA:蛋白激酶A protein kinase A;FFAR2:游离脂肪酸受体2 free fatty acid receptor 2;AC:腺苷酸环化酶 adenylate cyclase;GPR109:G蛋白偶联受体109 G protein-coupled receptor 109;EE:早期内体 early endosome;LE:次级内体 late endosome;U:泛素化 ubiquitination;P:磷酸化 phosphorylation;-SH:巯基 sulfydryl;SNO:S-亚硝化 S-nitrosation;L-cysNO:L型S-亚硝基半胱氨酸 L-S-nitroso cysteine;D-cysNO:D型S-亚硝基半胱氨酸 D-S-nitroso cysteine。
5 小 结
MCT1在动物体中广泛分布,通过参与单羧酸、酮体运输发挥着参与营养物质转运、调节pH、作为癌症治疗的靶点、调控代谢平衡的生物学功能,并通过多种分子调控机制调控MCT1的表达。转录水平,通过激活AP2、PPARα、Nrf2、HIF-1α、ERRα、原癌基因和NF-κB途径调控MCT1的转录;转录后水平,通过miRNA靶向结合其mRNA的3′-非翻译区来下调MCT1的表达;翻译后水平,通过cAMP、Wnt/β-catenin、Notch信号途径来影响泛素化或磷酸化作用来调控MCT1蛋白的表达量,以及巯基亚硝化作用;CD147、CAⅡ、乳酸脱氢酶、细胞色素C氧化酶、CD44等蛋白质与MCT1蛋白的相互作用也影响着MCT1的活性和转运功能。因此,进一步细化MCT1在动物体各个部位的调控通路研究,并且继续研究MCT1的专一有效抑制剂,这对于动物的高效生产、疾病治疗起着重要作用。
