银催化炔酮的自由基烷基化/5-endo环化反应研究
2023-11-09王庆归郑汉良朱钢国
王庆归, 郑汉良, 朱钢国
(浙江师范大学 化学与材料科学学院,浙江 金华 321004)
0 引 言
环戊酮是重要的有机结构单元,在化学合成中,常作为关键中间体被广泛应用于复杂分子的构筑.同时,环戊酮也是大量药物与生物活性分子的核心结构[1].因此,发展高效的环戊酮合成方法具有重要意义.
常见的环戊酮合成方法包括环戊醇的氧化[2]、环戊烯的Wacker氧化反应[3]及过渡金属催化的烯基醛分子内氢酰化反应[4]等.近年来,炔酮的自由基加成/环化反应成为一种高效的环酮合成策略[5-7].2017年,Yan等[8]报道了铜催化1,3-二芳基炔酮的自由基硅基化/环化反应,一步构建了α-硅基茚酮类化合物.随后,Wen等[9]与Xiong等[10]又分别报道了1,3-二芳基炔酮的电氧化自由基砜基化/环化与铁催化自由基烷基化/环化反应.与上述反应中烯基自由基对芳环邻位加成/氧化脱氢生成茚酮历程不同的是,另一些文献也报道了烯基自由基对芳环本位加成/氧化去芳构化构筑螺环戊烯酮的历程.例如,2020年,Li等[11]发展了1例吲哚亚甲基炔酮的自由基三氟甲基化/去芳构化反应,高效构筑了螺吲哚环戊烯酮衍生物.随后,Chen等[12]与Ho等13]又分别报道了相同底物的自由基砜基化与硫化/去芳构化反应,进一步拓展了反应的适用范围.2020年,Sahoo等[14]实现了更具挑战性的苄基炔酮硒基化/去芳构化反应,为螺环己二烯酮环戊烯酮的合成提供了新思路.但需要指出的是,在上述报道中,自由基加成炔酮产生的烯基自由基都直接发生对芳环的加成从而构筑环戊烯酮衍生物,而由炔酮直接构建环戊酮的方法仍非常少见.
对此,本研究设计使用含有β-C(sp3)-H的芳基炔酮为底物,使自由基对炔烃加成所形成的β′烯基自由基与β-C(sp3)-H发生快速的1,5-氢迁移(1,5-HAT)[15-17],从而避免烯基自由基直接对邻近芳环直接加成.随后,产生的烷基自由基经历5-endo环化生成α-羰基自由基,最后通过分子间氢原子转移或者还原质子化历程,实现环戊烷的构建(见图1).依据上述思路,本研究以廉价易得的烷基羧酸为自由基前体,通过氧化脱羧产生烷基自由基后经历上述历程,实现了炔酮的α-烷基化/5-endo环化反应,为α-烷基取代的环戊酮的构建提供了一种简便方法.

图1 由炔酮合成环戊酮的设计思路
1 实验部分
1.1 试剂与仪器
烷基羧酸、硝酸银(AgNO3)、过硫酸钾(K2S2O8)、乙腈(MeCN)均为分析纯.1H NMR和13C NMR使用Bruker 400 MHz或600 MHz核磁共振仪测定,四甲基硅烷为内标.
1.2 实验步骤
在10 mL史莱克管中,氮气氛围下,加入AgNO3(0.04 mmol)、K2S2O8(0.2 mmol)、烷基羧酸(0.4 mmol)和MeCN与水的混合溶剂(2 mL,V(MeCN)/V(H2O)=1/1),接着加入芳基炔酮(0.2 mmol).反应体系在100 ℃搅拌8 h后,加5 mL水淬灭.所得混合物以乙醚(15 mL)萃取3次,有机相合并后加入无水硫酸钠干燥,随后通过旋转蒸发仪浓缩得粗产品.粗产品经硅胶(300~400目)柱色谱(洗脱液:V(石油醚)/V(乙醚)=50/1)分离纯化,得纯产物.
2 结果与讨论
2.1 反应条件优化
选取苯基炔酮(1a)与特戊酸(2a)的烷基化/5-endo环化反应为模板反应(见图2),对反应条件进行了优化,具体结果见表1.首先以AgNO3为催化剂,K2S2O8为氧化剂,MeCN与水为混合溶剂,在100 ℃下搅拌8 h,反应以65%的收率生成了期望的环戊酮产物3a,同时以24%的收率生成了副产物环戊烯酮4a(见表1中序号1).随后对不同的银催化剂进行了筛选,反应结果表明,以Ag2O,AgOAc和AgSbF6为催化剂时,3a收率分别下降至40%,34%和30%(见表1中序号2—4).保持AgNO3为催化剂,随后测试了不同比例MeCN与水的混合溶剂对反应的影响,实验结果表明,增加混合溶剂中MeCN或水的含量都会略微降低3a的收率(见表1中序号5—6).考虑到副产物环戊烯酮4a的生成可能是使用了过量K2S2O8所致,紧接着对K2S2O8的用量进行了调整.降低K2S2O8的用量至1.0当量时,反应以83%收率生成3a,且未检测到副产物4a的生成(见表1中序号7),进一步降低K2S2O8的用量至0.5当量时,3a的收率也随之下降至52%(见表1中序号8).最后,控制实验表明,在没有氧化剂K2S2O8(见表1中序号9)或催化剂AgNO3(见表1中序号10)存在的条件下,均没有反应发生,说明K2S2O8和AgNO3对于反应都是必须的.
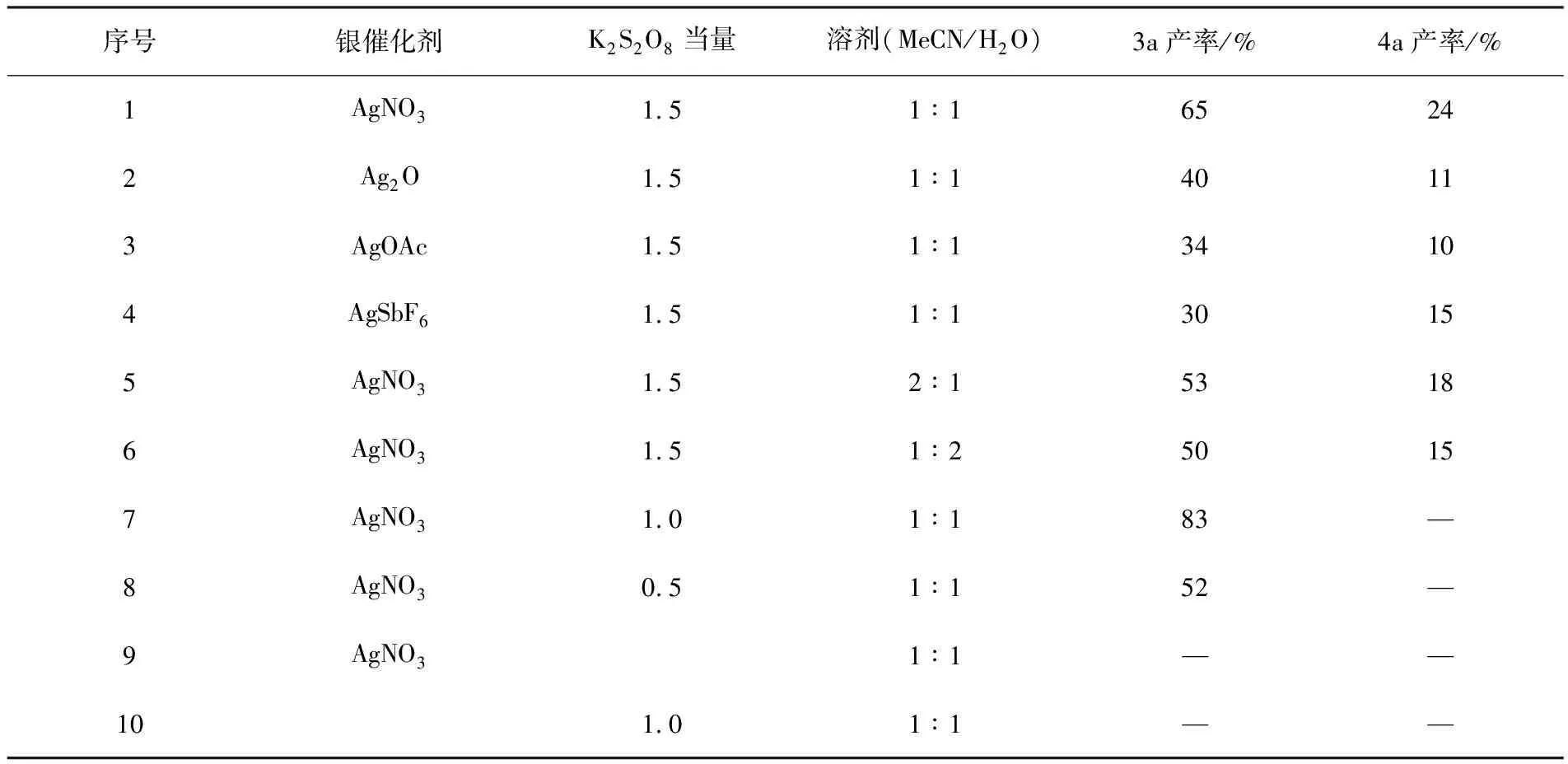
表1 苯基炔酮(1a)与特戊酸(2a)烷基化/5-endo环化反应的条件优化

图2 模板反应的选取
2.2 反应底物的拓展
为了拓展反应的适用范围,考察了不同炔酮及烷基羧酸在反应中的兼容性,反应结果见图3.首先,以特戊酸为烷基自由基前体,对含有不同取代基的苯基炔酮进行了考察.实验结果表明,对位氰基(1b)、酯基(1c)与氯(1d)等吸电子基取代的苯基炔酮都能较好地兼容反应,以中等以上的收率生成期望的环戊烷酮产物3b—3d.另外,对位给电子取代基,如甲基(1e)与甲氧基(1f)取代苯基炔酮的反应同样能以较高的收率生成对应产物3e和3f.上述结果表明,芳环上取代基的电性对该反应的影响不大.需要指出的是,反应同样兼容杂环炔酮,如2-噻吩炔酮的反应能够以68%的收率得到对应产物3g.随后,以苯基炔酮为底物,测试不同烷基羧酸的兼容性.以同样产生三级烷基自由基的1-甲基-1-环已羧酸(2h)为前体,反应以58%的收率生成预期产物3h.使用产生二级烷基自由基的环己基甲酸(2i)为前体,对应产物的收率3i为56%.使用产生一级烷基自由基的丙酸(2j)为前体,3j的收率急剧下降至26%,然而以产生较稳定的一级自由基的苯氧乙酸为前体时,反应则以较60%的收率生成产物3k,上述结果说明,生成的烷基自由基的稳定性对反应至关重要.
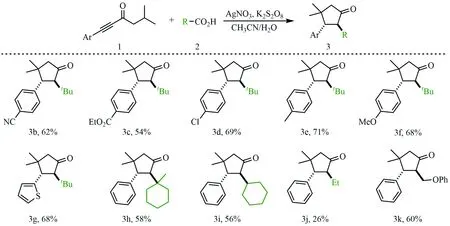
注:反应条件为芳基炔酮(0.2 mmol),烷基羧酸(0.4 mmol),AgNO3(0.04 mmol),K2S2O8(0.2 mmol),2 mL混合溶剂V(CH3CN)∶V(H2O)=1∶1,在100 ℃下搅拌8 h.所有收率均为分离收率,如无额外说明,产物的非对映选择性均大于20∶1
2.3 产物的结构与表征
1)化合物3a:反式4,4-二甲基-2-叔丁基-3-苯基环戊酮,黄色液体,收率83%;1H NMR(600 MHz,CDCl3)δ:7.34~7.31(m,2H),7.26(dt,J=2.58,2.58 Hz,1H),7.23~7.19(m,2H),3.11(d,J=10.9 Hz,1H),2.58(d,J=10.9 Hz,1H),2.31~2.22(m,2H),1.13(s,3H),0.89(s,9H),0.69(s,3H);13C NMR(151 MHz,CDCl3)δ:218.9,140.2,131.0,128.1,126.5,59.6,57.2,56.0,37.8,34.3,28.4,27.4,23.5.
2)化合物3b:反式4,4-二甲基-2-叔丁基-3-(4-氰基苯基)环戊酮,黄色液体,收率62%;1H NMR(400 MHz,CDCl3)δ:7.63(d,J=7.8 Hz,2H),7.33(d,J=7.7 Hz,2H),3.15(d,J=10.9 Hz,1H),2.53(d,J=10.9 Hz,1H),2.28(d,J=2.0 Hz,2H),1.12(s,3H),0.86(s,9H),0.67(s,3H);13C NMR(101 MHz,CDCl3)δ:217.3,146.2,131.8,127.5,118.8,110.5,59.7,56.9,56.1,38.0,34.4,28.3,27.3,23.4.
3)化合物3c:反式4,4-二甲基-2-叔丁基-3-(4-乙氧羰基苯基)环戊酮,无色液体,收率54%;1H NMR(400 MHz,CDCl3)δ:8.01(d,J=7.8 Hz,2H),7.35~7.26(m,2H),4.38(q,J=7.1 Hz,2H),3.16(d,J=10.9 Hz,1H),2.58(d,J=10.9 Hz,1H),2.33~2.21(m,2H),1.45~1.33(m,3H),1.12(s,1H),0.87(s,9H),0.67(s,3H);13C NMR(101 MHz,CDCl3)δ:218.2,166.5,145.7,130.9,129.4,129.1,128.9,126.6,60.9,59.7,57.0,56.0,38.0,34.4,28.3,27.3,23.4,14.4.
4)化合物3d:反式4,4-二甲基-2-叔丁基-3-(4-氯苯基)环戊酮,无色液体,收率69%;1H NMR(400 MHz,CDCl3)δ:7.29(d,J=7.6 Hz,2H),7.14(d,J=7.9 Hz,2H),3.08(d,J=10.9 Hz,1H),2.48(d,J=10.9 Hz,1H),2.26(s,2H),1.10(s,3H),0.88(s,9H),0.67(s,3H);13C NMR(101 MHz,CDCl3)δ:218.3,138.8,132.2,128.3,128.0,59.7,57.0,55.4,37.8,34.3,28.4,27.3,23.4.
5)化合物3e:反式4,4-二甲基-2-叔丁基-3-(4-甲基苯基)环戊酮,无色液体,收率71%;1H NMR(400 MHz,CDCl3)δ:7.09(q,J=7.9 Hz,4H),3.06(d,J=10.9 Hz,1H),2.53(dd,J=10.9,1.4 Hz,1H),2.36(s,3H),2.28~2.21(m,2H),1.11(s,3H),0.89(s,9H),0.68(s,3H);13C NMR(101 MHz,CDCl3)δ:219.2,137.2,135.9,130.9,128.7,126.5,59.6,57.2,55.5,37.8,34.3,28.4,27.4,23.5,21.0.
6)化合物3f:反式4,4-二甲基-2-叔丁基-3-(4-甲氧基苯基)环戊酮,无色液体,收率68%;1H NMR(600 MHz,CDCl3)δ:7.10(t,J=6.6 Hz,2H),6.86(d,J=9.8 Hz,2H),3.81(s,3H),3.03(d,J=10.9 Hz,1H),2.47(dd,J=10.9,1.4 Hz,1H),2.29~2.18(m,2H),1.09(s,3H),0.87(s,9H),0.66(s,3H);13C NMR(151 MHz,CDCl3)δ:219.3,158.2,132.3,113.3,59.7,57.1,55.2,55.1,37.9,34.3,28.4,27.3,23.4.
7)化合物3g:反式4,4-二甲基-2-叔丁基-3-(2-噻吩基)环戊酮,淡黄色液体,收率68%;1H NMR(600 MHz,CDCl3)δ:7.28(t,J=7.9 Hz,1H),6.98(m,1H),6.96(d,J=6.1 Hz,1H),3.10(d,J=10.7 Hz,1H),2.44(d,J=10.7 Hz,1H),2.25(s,2H),1.16(s,3H),0.90(s,9H),0.70(s,3H);13C NMR(151 MHz,CDCl3)δ:218.9,141.7,124.7,60.8,56.8,51.2,37.7,34.2,28.2,27.5,23.7.
8)化合物3h:反式4,4-二甲基-2-(1-甲基环己基)-3-苯基环戊酮,无色液体,收率58%;1H NMR(400 MHz,CDCl3)δ:7.33~7.29(m,2H),7.27~7.22(m,2H),7.20~7.18(m,1H),3.17(d,J=10.6 Hz,1H),2.62(dd,J=10.6,1.8 Hz,1H),2.34~2.22(m,2H),1.62~1.16(m,10H),1.12(s,3H),0.92(s,3H),0.68(s,3H);13C NMR(101 MHz,CDCl3)δ:219.3,140.3,131.0,128.1,127.6,126.9,126.4,59.7,57.6,55.1,37.8,37.5,36.3,35.8,27.4,26.0,23.8,21.7,21.6,21.0.
9)化合物3i:反式4,4-二甲基-2-环己基-3-苯基环戊酮,无色液体,收率56%;1H NMR(400 MHz,CDCl3)δ:7.35(t,J=14.4 Hz,2H),7.30(d,J=7.2 Hz,1H),7.22(t,J=6.7 Hz,2H),3.09(d,J=12.3 Hz,1H),2.71~2.67(m,1H),2.36~2.16(m,2H),1.79~1.31(m,8H),1.23~0.97(m,6H),0.76(s,3H);13C NMR(101 MHz,CDCl3)δ:219.5,138.7,128.9,128.0,126.7,56.5,56.2,55.2,38.8,38.0,30.7,30.2,27.6,26.7,26.2,23.0.
10)化合物3j:反式4,4-二甲基-2-乙基-3-苯基环戊酮,无色液体,收率26%;1H NMR(600 MHz,CDCl3)δ:7.34(d,J=15.1 Hz,2H),7.29(d,J=8.7 Hz,1H),7.20(t,J=9.54 Hz,2H),2.91(d,J=12.7 Hz,2H),2.74~2.70(m,1H),2.37~2.20(m,2H),1.62~1.53(m,2H),1.12(s,3H),0.79~0.76(m,3H);13C NMR(151 MHz,CDCl3)δ:219.4,137.9,128.9,128.1,126.9,57.7,54.9,52.2,38.0,27.8,22.9,21.7,11.2.
11)化合物3k:反式4,4-二甲基-2-苯氧甲基-3-苯基环戊酮,无色液体,收率60%;1H NMR(600 MHz,CDCl3)δ:7.49~7.47(m,3H),7.30~7.24(m,4H),6.96(dd,J=8.1,1.2 Hz,1H),6.87(td,J=7.6,1.2 Hz,1H),6.78(dd,J=7.8,1.6 Hz,1H),4.99(s,2H),1.96(dd,J=13.4,6.7 Hz,1H),1.80(d,J=6.9 Hz,2H),0.69(d,J=6.7 Hz,6H);13C NMR(151 MHz,CDCl3)δ:203.3,155.4,141.7,136.4,131.4,129.6,128.8,128.7,128.4,124.3,121.6,66.5,51.1,23.8.
3 结 论
本研究以AgNO3为催化剂,K2S2O8为氧化剂,烷基羧酸为自由基前体,发展了1例炔酮的自由基烷基化/5-endo环化反应,为环戊酮衍生物的合成提供了新途径.与之前炔酮的自由基加成/环化反应所不同的是,本研究通过在炔酮中引入β-C(sp3)-H键,借由快速1,5-HAT历程将烯基自由基转化为烷基自由基,从而避免了烯基自由基直接对芳环加成而生成环戊烯酮类化合物.本研究所发展的反应具有效率高、官能团兼容性好等优点,有望在复杂环戊酮衍生物的合成中发挥重要作用.
