20E诱导家蚕抗菌肽CecropinB6的上调表达
2023-11-09王禹生田小利黄浩贤邓小娟
王禹生,田小利,肖 阳,张 杰,梁 宽,黄浩贤,邓小娟*
(1. 华南农业大学动物科学学院/广东省农业动物功能基因组学与分子育种重点实验室/广东省蚕桑工程技术研究中心,广州 510642;2. 广东省农业科学院蚕业与农产品加工研究所,广州 510610)
昆虫具有极强的适应性,是地球上种类最多、分布最广的类群,这主要是因为它们具有强大的先天免疫系统。当微生物突破昆虫的第一道防线——物理屏障时,被宿主模式识别受体(PRR)识别并激活宿主的先天免疫(Luetal., 2020)。先天免疫系统由细胞免疫和体液免疫两部分组成,细胞免疫由血细胞执行的吞噬、包囊和凝结等组成,而体液免疫包括黑化作用、合成和分泌抗菌肽(Antimicrobial peptides, AMPs)与溶菌酶等(Lemaitre &Hoffmann, 2007;Yangetal., 2021)。细胞免疫和体液免疫发挥各自不同的作用,并协同工作以清除外来的病原物(Haineetal., 2008)。AMPs是一类重要的抗菌效应分子,受病原诱导并能在昆虫持续存在达数周之久(Makarovaetal., 2016)。微生物诱导AMPs的产生主要通过进化保守的Toll、IMD和JAK/Stat等信号通路进行调控(Yangetal., 2021),1990s Toll受体在果蝇Drosophilamelanogaster中激活抗感染免疫功能的阐明(Lemaitreetal.,1996)促进了哺乳动物Toll样受体(Toll-like receptors, TLRs)的发现,并极大地推动了先天免疫分子机制的研究(Vijay, 2018)。
除了病原微生物的感染,AMPs的表达也受到非感染因素的诱导,如营养剥夺(Uncklessetal., 2015)、激素(Reynoldsetal., 2020)和DNA损伤(Karpacetal., 2011)等。饥饿信号能降低果蝇ILS水平激活丝氨酸/苏氨酸激酶Akt,进而导致转录因子FoxO被激活进入细胞核内,启动AMPs基因的表达(Beckeretal., 2010; Zhangetal., 2018)。类固醇激素20-羟基蜕皮酮(20E)作为昆虫发育和变态的重要调节因子,也调控AMPs基因的表达(Flatetal., 2008; Hanetal., 2017),现有的研究表明20E可以通过调控肽聚糖识别蛋白(PGRP)进而调节AMPs的表达(Rusetal., 2013; Wangetal., 2014; Hanetal., 2017),也可以通过20E信号通路中关键因子BR-C调控AMPs的表达(Maietal., 2017)。
随着家蚕基因组计划的完成,在家蚕基因组中发现和鉴定了Attacins、Cecropins、Moricins, Gloverins、Enbocins、Lebocins和Defensins 7个AMPs家族的37条基因序列,部分序列的抗菌功能得到鉴定(Chengetal., 2006; Yangetal., 2011)。基于抗菌谱、抗菌活性和微生物对AMPs基因的转录诱导活性,推测BmCecB6、BmcecD和Bmmor在清除微生物感染的免疫过程中起重要作用(Yangetal., 2011)。20E对家蚕AMPs表达的影响及其分子机制的研究较少,Tian等(2010)发现20E抑制家蚕Moricin和Cecropin等AMPs基因的转录水平。本研究对20E调控家蚕抗菌肽BmCecB6的表达进行研究,并对BmCecB6的启动子进行截短和双荧光素酶启动子活性分析,以期为进一步揭示昆虫的发育与免疫之间的联系奠定基础。
1 材料与方法
1.1 材料
家蚕幼虫:品种为大造,五龄幼虫在25℃±1℃以新鲜桑叶饲养。家蚕细胞卵巢细胞系Bm-12用含有10%(v/v)胎牛血清(Gibco)和90%(v/v)TNM-FH培养基(Sigma Aldrich,USA),在27℃恒温培养箱中培养。
pGL3-Basic萤火虫荧光素酶质粒载体和pRL-Null海肾荧光素酶质粒载体(美国Promega公司)由华南师范大学昆虫研究所李胜研究员提供,pRL-Null插入Actin5报告基因构建成pRL-Null-Actin5海肾荧光素酶重组内参质粒用于检测细胞中的本底荧光值。
大肠杆菌EscherichiacoliDH5α感受态细胞购自北京天根生物公司。
Phospho-Drosophila Akt (Ser505)和Akt抗体为Cell signaling technology公司产品,Tubulin 单克隆抗体和HRP标记的山羊抗兔及HRP标记的山羊抗小鼠二抗购自碧云天生物技术研究所。
蜕皮激素(20-hydroxyecdysone,20E)为美国Sigma Aldrich公司产品。Trizol Reagents总RNA抽提试剂盒,限制性内切酶、反转录用试剂盒(PrimeScript RT reagent Kit with gDNA Eraser)、T4 DNA ligase、Primer-STAR DNA聚合酶均购自TaKaRa宝生物工程大连有限公司。实时荧光定量PCR试剂SsoFast EvaGreen Supermix为美国Bio-Rad产品。Effectene Transfection Reagent转染试剂盒为德国Qiagen公司产品。Dual-Luciferase Report Assay System试剂盒为Promega公司产品。
1.2 方法
1.2.120E处理方法
20E注射家蚕幼虫:取家蚕5龄第3天幼虫,以微量注射器从腹部最后一对足处注射5 μL 20E工作液(相当于5 μg/头),3、6、9和12 h后收集脂肪体。为了探讨不同剂量的20E对AMPs表达的影响,设置0.05、0.5、5和10 μg/头的处理组,注射6 h后进行样品收集和预处理,并以注射等体积的20%乙醇为对照。将5头家蚕的脂肪体作为一个样品,每个处理取3个重复样品。
20E处理离体培养的家蚕脂肪体组织:取家蚕5龄第3天幼虫,以75%酒精进行体表消毒、晾干,用解剖剪剖开体腔后从腹部刮取脂肪体,于无菌的昆虫生理盐水中漂洗后转移至含有Grace昆虫培养基(Antibiotic-Antimycotic)的6孔板中进行无菌培养。培养3 h后加入20E使终浓度为5 μg/mL,处理4、8和12 h后收集脂肪体备用,以加入等体积的20%酒精处理作为对照。
20E处理Bm-12细胞:在对数生长期的Bm-12细胞中分别加入20E,使终浓度为0.01、0.1、1和10 μg/mL,处理4、8和12 h后收集细胞备用,以加入等体积的20%酒精作为对照。
1.2.2qRT-PCR对AMPs基因的表达定量
为检测AMPs基因的表达水平,取家蚕五龄幼虫脂肪体和Bm-12细胞,根据MIQE指南的标准(Bustinetal., 2010)进行实时荧光定量PCR(qRT-PCR)。首先按TRIzol Reagent RNA(Invitrogen)提取试剂使用说明书提取总RNA,总RNA经PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒反转录合成cDNA,在CFX96定量PCR仪(Bio-rad)检测AMPs、胰岛素受体InR和20E受体初级转录因子E75a的转录活性,参考Zhang等(2018)设计定量引物,序列见表1。采用SYBR Green荧光定量PCR试剂盒(Bio-rad),反应体系为:SsoFast EvaGreen Supermix (2×)10 μL,引物(10 μmol/L)各0.2 μL,cDNA 0.1 μL(相当于10 ng 总RNA),加ddH2O至总体积20 μL。反应程序为:95℃预变性1 min;(95℃ 15 s,55℃ 30 s,72℃ 45 s)循环40次;溶解曲线在65~95℃每隔0.5℃采集1次,每次采集5 s。以rp49(核糖体蛋白,ribosome protein,rp49)作为内参基因,采用2-ΔΔct法(Livak &Schmittgen, 2001)计算基因相对表达量。

表1 qRT-PCR引物序列
1.2.3BmCecB6启动子序列的扩增
取家蚕脂肪体,利用Tissue DNA Kit (OMEGA,USA)抽提基因组DNA,根据家蚕基因组数据库Silkbase 3.0获得的BmCecB6启动子序列,设计扩增不同长度的启动子序列引物。上游引物序列见表2,下游引物BmCecB6_R:5′-GAAGATCTGTTCACTCGTACACGGCTCAAAC-3′,下划线序列分别为BglII酶切位点。PCR反应体系:TaKaRa Ex Taq(5 U/μL)0.25 μL,10×Ex Taq Buffer(Mg2+Plus)5 μL,dNTP Mixture(各2.5 mmol/L)4 μL,上下游引物(20 μmol/L)各1 μL,基因组模板DNA 2.5 ng,加ddH2O补充到50 μL。PCR反应参数为:94℃ 4 min→(94℃ 1 min→58℃ 30 s→72℃ 1.2 min)×30 cycles→72℃ 10 min→4℃ ∞。经琼脂糖凝胶电泳分析获得与预期大小相符的条带,按AxyPrepDNA凝胶回收试剂盒说明书进行目的条带的回收与纯化。
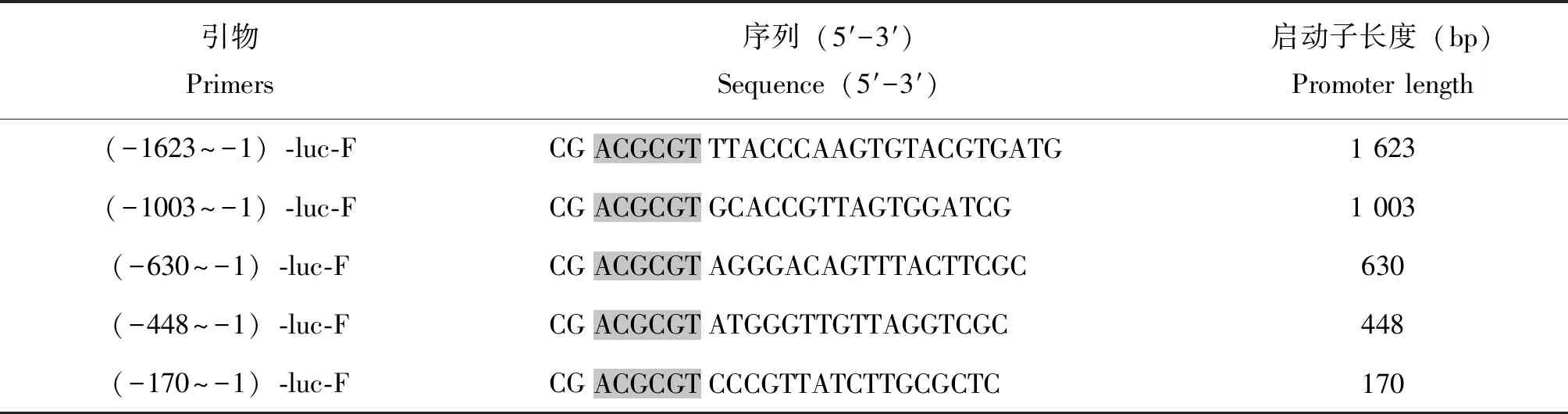
表2 扩增截短的BmCecB6启动子引物序列
1.2.4构建BmCecB6不同长度启动子的pGL3-Basic重组载体
使用限制性内切酶MluI和BglII对pGL3-Basic启动子载体和BmCecB6启动子序列(野生型,wt)进行双酶切,分别回收大片段后于16℃连接过夜。将连接产物转化大肠杆菌DH5α感受态细胞,经amp筛选和PCR鉴定,将阳性克隆送上海生工生物技术有限公司进行测序确认,构建成功的重组载体命名为pGL3-BmCec6_wt。
1.2.5构建缺失FoxO结合位点的BmCecB6启动子的pGL3-Basic重组载体
BmCecB6启动子上游1 623 bp区域存在5个可能的FoxO结合位点(TXTTTAY;X-N,Y-C/T),采用重叠PCR方法按1~5的顺序依次进行FoxO结合位点的缺失突变(Zhangetal., 2018),引物序列见表3。由于第2、3、4三个位点紧密相邻,可将3个位点同时进行缺失突变,经过3轮定点突变后,即可获得缺失FoxO结合位点的BmCecB6_△FoxO1-5上游序列。按1.2.4的方法将缺失FoxO结合位点的BmCecB6启动子序列插入pGL3.0-Basic,构建成功的载体命名为pGL3-BmCecB6_△FoxO1-5。

表3 BmCecB6启动子序列缺失FoxO结合位点的重叠PCR引物序列
1.2.6启动子活性分析
利用Effectene Transfection Reagent转染试剂盒分别将重组质粒pGL3-BmCecB6_wt和pGL3-BmCecB6_△FoxO1-5与内参质粒pRL-Null-Actin5共转染Bm-12细胞,转染48 h后,用20E(1 μg/mL)处理细胞8 h,室温1 000 r/min离心10 min收集细胞,弃上清。用0.1 mol/L PBS清洗细胞,收集到的细胞按双荧光素酶报告检测试剂盒检测双荧光值,计算萤火虫荧光素酶(Fluc luciferase, Fluc)与海肾荧光素酶(renilla luciferase,Rluc)比值。
1.2.7免疫印迹检测
用细胞裂解液裂解细胞后提取总蛋白,上样进行12% SDS-PAGE,然后将蛋白转移到PVDF膜,5%脱脂奶粉封闭30 min后,用p-Akt抗体Phospho-Drosophila Akt (Ser505)、总Akt抗体、Tubulin抗体室温孵育过夜,TBST清洗3次后用二抗室温孵育2 h,再用TBST清洗3次,最后用ECL化学发光检测试剂盒进行显色反应。
1.2.8数据处理
实验中采用3个独立的家蚕脂肪体样本或3个独立的细胞培养液,每次实验分析中的每个样品采用3~5个重复。使用GraphPad Prism 8.0软件t-检验方法对数据进行统计分析,星号表示差异显著(*,P<0.05;**,P<0.01;***,P<0.001)。
2 结果与分析
2.1 20E上调家蚕BmCecB6的表达
20E调控家蚕蜕皮的信号通路中,E75是20E的初级应答基因,E75家族中E75a对20E响应较为明显(Lietal., 2016)。为测试家蚕对20E的应答,取5龄第3天的幼虫按5 μg/头的剂量注射20E,通过qRT-PCR检测对20E处理后的幼虫脂肪体中BmE75a基因的转录活性,结果如图1所示。20E注射后,家蚕幼虫脂肪体中BmE75a在3 h、6 h转录活性上调显著,9 h和12 h转录活性降低,与对照没有显著差异(图1-a)。为检测AMPs基因对20E的应答,本研究检测了20E处理的AMPs转录水平变化,结果表明BmCecB6(BmCecropinB6)在20E诱导6 h有明显的上调,而家蚕BmdefB(BmDefensinB)和Bmmor(BmMoricin)的表达在20E处理后没有显著的变化(图1-b),因此选择BmCecB6作为后续检测应答20E的抗菌肽靶基因。
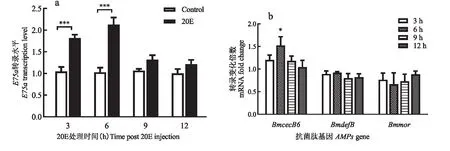
图1 注射20 E后家蚕幼虫脂肪体中 E75a和AMPs的转录水平
为了确定20E的最佳处理剂量,本研究测试了每头幼虫注射不同剂量的20E对BmE75a和BmCecB6的诱导效果,结果表明低浓度的20E(0.05 μg/头和0.5 μg/头)处理后,BmE75a和BmCecB6的转录活性均没有明显的变化;5 μg/头20E能显著上调BmE75a和BmCecB6的表达(见图2)。高剂量的20E(10 μg/头)注射后48 h左右,家蚕出现体节发黑、口吐黄色液体的现象,有少部分家蚕死亡。可见10 μg/头的剂量严重影响了家蚕的生理和发育。因此,处理5龄幼虫20E的合适剂量为5 μg/头。
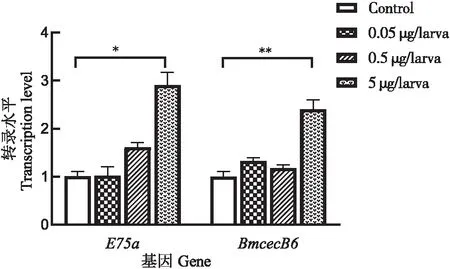
图2 注射不同剂量的20E后家蚕幼虫中脂肪体中E75a和BmCecB6的转录水平
20E处理促进家蚕5龄幼虫脂肪体中的抗菌肽BmCecB6的表达上调,那么20E是否同样能上调游离培养的脂肪体和Bm-12细胞中BmCecB6基因的表达?qRT-PCR结果显示20E也能上调离体培养的脂肪体和Bm-12细胞中BmCecB6的转录水平(图3)。
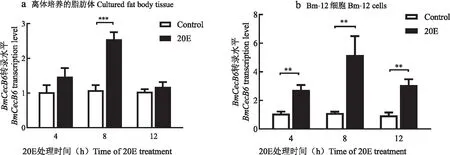
图3 20E诱导家蚕游离培养的脂肪体和Bm-12细胞中BmCecB6的表达
为探索20E处理Bm-12细胞的最佳处理浓度,本研究设置了4个不同浓度的20E(0.01、0.1、1和10 μg/mL细胞培养液)处理Bm-12细胞,8 h后收集细胞检测BmCecB6的转录表达活性,结果显示:0.01 μg/mL 20E处理的Bm-12细胞中,BmCecB6
的表达无明显变化;0.1、1、10 μg/mL的20E均显著上调BmCecB6的转录活性,以1 μg/mL和10 μg/mL诱导的效果最为明显(图4)。虽然1 μg/mL与10 μg/mL的20E处理细胞后BmCecB6的表达上调明显且无明显差异,但鉴于高浓度的20E对Bm-12细胞正常生长有一定的影响,后续的细胞实验采用的20E处理浓度为1 μg /mL。与红头丽蝇Calliphoravicina脂肪体细胞中报道的结果(Gordyaetal., 2016)不同,Bm-12细胞中没有出现高浓度20E抑制免疫应答的现象。
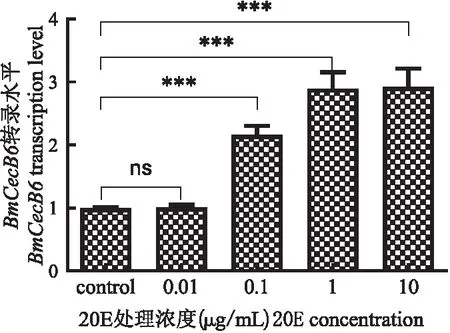
图4 不同浓度的20E处理家蚕Bm-12细胞诱导BmCecB6的转录活性
2.2 截短型BmCecB6启动子活性分析
为探讨20E诱导AMPs表达的分子调控机制,使用在线软件MatInspector (http://www. genomatix.de/products/index.html)对BmCecB6启动子区进行转录因子结合位点的预测分析,发现BmCecB6的1.6 kb启动子区存在NF-κB、FoxO和EcR、BR-C、E74A等转录因子的结合位点(图5)。根据这些转录因子结合位点在启动子中的位置,将1 623、1 003、630、448和170 bp共5个不同长度的启动子序列,通过双荧光素酶活性分析测定不同长度的启动子对20E的响应情况,结果如图6所示。图6显示-1 003~-1、-630~-1和-448~-1启动子活性和野生型启动子无明显差异,而20E对-170~-1启动子的诱导转录活性明显下降,说明BmCecB6对20E的应答元件在-448~-170启动子区域。该区域存在1个NF-κB、3个FoxO、2个BR-C和1个E74A位点。
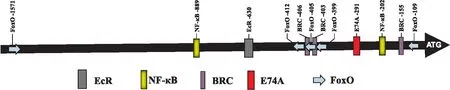
图5 BmCecB6启动子区域潜在转录因子结合的预测分析
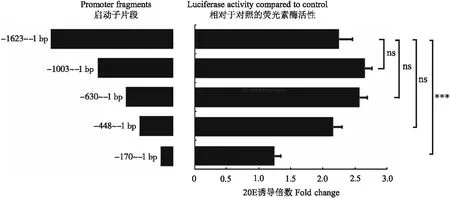
图6 不同长度的BmCecB6启动子活性分析
2.3 FoxO不是直接调控BmCecB6的转录因子
BmCecB6在-448~-170启动子区域存在对20E的可能应答元件NF-κB、FoxO、BR-C和E74A位点,其中NF-κB为昆虫体液免疫通路(Toll和Imd信号通路)中的关键转录因子,参与微生物感染诱导的免疫机制(Lemaitre &Hoffmann, 2007);FoxO为类胰岛素信号(ILS)中的重要转录因子,近年来发现FoxO也参与饥饿诱导的免疫(Beckeretal., 2010; Zhang &Palli, 2018);BR-C和E74A是响应20E信号的初次级转录因子,在家蚕中已经证明BR-C调控20E诱导变态发育期中肠抗菌肽lebocin的表达(Maietal., 2017)。为了验证FoxO是否参与20E诱导的BmCecB6表达调控,首先通过qRT-PCR检测FoxO的靶标基因胰岛素受体(BmInR)的表达是否上调来判断20E处理后是否激活家蚕转录因子FoxO,qRT-PCR结果如图7所示,显示20E处理后的家蚕幼虫脂肪体、离体培养脂肪体和Bm-12细胞中BmInR的表达上调,暗示了20E处理减弱类胰岛素信号通路(ILS)水平,激活的转录因子FoxO入核调控靶标基因BmInR的表达。对Akt磷酸化水平的检测结果显示20E处理导致Akt磷酸化水平下降(图8),证实了上述的实验结果。20E处理导致ILS水平下降,FoxO去磷酸化而被激活入核,与Hossain等(2013)报道的结果相符。
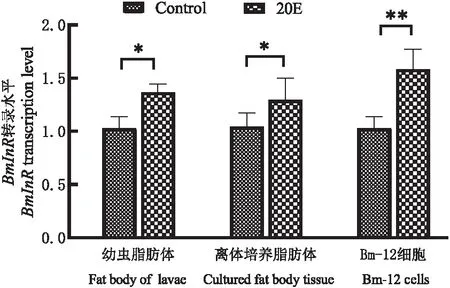
图7 20E处理导致BmInR表达上调
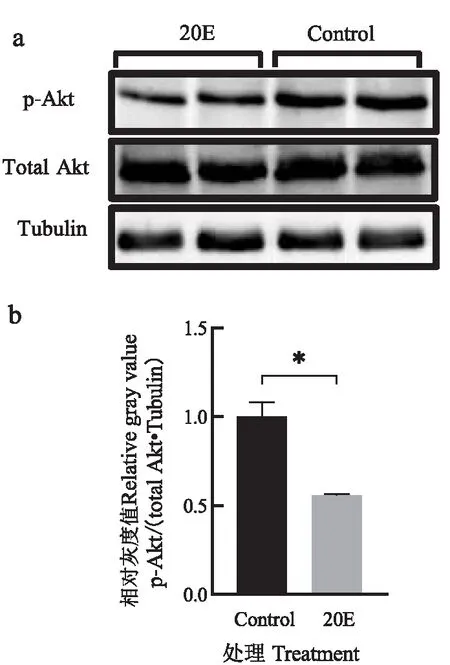
图8 20E处理导致Bm-12细胞中Akt磷酸化水平降低
为了进一步FoxO的激活是否参与20E诱导的BmCecB6表达调控,将BmCecB6启动子区(1.6 kb)的FoxO位点利用重叠PCR的方法进行缺失(Deletion)突变后,测序正确后插入pGL3 Basic载体,构建成缺失FoxO位点的pGL3-BmCecB6_△FoxO1-5重组载体。采用双荧光素酶活性分析缺失FoxO位点对BmCecB6应答20E活性的影响,将pGL3-BmCecB6_△FoxO1-5和野生型启动子重组载体pGL3-BmCecB6_wt转染Bm-12细胞,检测双荧光素活性,结果显示缺失FoxO位点对启动子活性没有明显的影响(图9),可见BmCecB6启动子对20E的应答活性不是通过FoxO结合到BmCecB6启动子区的顺式元件直接起作用的。
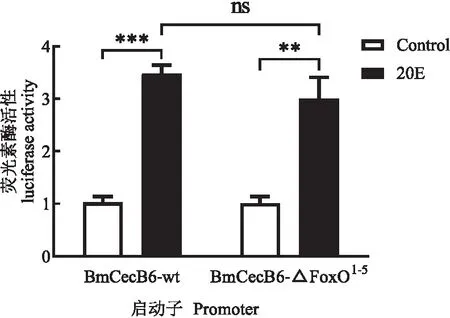
图9 缺失FoxO结合位点对BmCecB6启动子活性的影响
3 结论与讨论
在昆虫中,20E与JH协同作用,调节蜕皮、变态和发育繁殖(Riddifordetal., 2003; Zhuetal., 2021)。越来越多的证据表明20E还参与昆虫先天免疫过程,如吞噬和AMPs的产生(Dimarcqetal., 1997; Flattetal., 2008; Zhang &Palli, 2009; Rusetal., 2013; Nunesetal., 2021)。哺乳动物中的研究也表明类固醇激素及其受体对先天免疫和炎症反应起着重要的调节作用(Benagianoetal., 2019)。果蝇幼虫中微生物感染诱导体内产生抗菌肽diptericin,只有在3龄幼虫后期20E滴度达到足够的量时才会发生(Meister &Richards, 1996);感染前以20E预处理果蝇S2细胞可以提高AMPs基因的转录水平(Flattetal., 2008);本研究也证实了20E的处理可以激活家蚕BmCecB6的表达。Wang等(2014)发现,棉铃虫Helicoverpaarmigera在化蛹前的游走期,随着20E滴度增高,脂肪体中抗菌肽Attacin、Gloverin、Cecropin和溶菌酶Lysozyme等基因的转录表达上调。20E激活飞蝗AMPs基因表达的同时,也能激活体液免疫的其他成分,比如酚氧化酶系统(Hanetal., 2017; Hanetal., 2020)。
20E对昆虫免疫系统的影响,除了调节体液免疫,其滴度升高同时可以激活细胞免疫(Reganetal., 2013)。在冈比亚按蚊Anophelesgambiae(Ahmedetal., 1999;Reynoldsetal., 2020)、昔古比天蚕Hyalophoracecropia(Roxström-Lindquistetal., 2005)、印度谷螟Plodiainterpunctella(Ayeetal., 2008)和烟草天蛾Manducasexta(Zouetal., 2005)等昆虫中均报道了20E的免疫激活作用。值得注意的是,一方面20E促进昆虫的免疫反应,提高昆虫对病原微生物的抵抗能力;另一方面,微生物感染昆虫后可以通过 3-脱氢蜕皮激素-3β-还原酶(3DE-3β-reductase)促进20E滴度升高,同时促进免疫反应(Sunetal., 2016),表明昆虫的免疫与20E的激素水平存在相互作用的关系。
20E激活并增强昆虫的体液免疫作用,是与其生理发育相适应的。在完全变态昆虫由幼虫—蛹的变态发育过程中,20E结合到由脱皮激素受体(EcR)和超气门蛋白(USP)组成的异源二聚体上,并激活包括广泛复合体(BR-C)和E74在内的初、次级转录因子的信号级联反应(Baehrecke, 2000),最终导致幼虫组织的降解和蛹组织的再生。新旧组织的替换和更新过程中,昆虫容易受到微生物的感染,此时体内20E水平的升高激活的免疫反应对变态发育期的虫体起到重要的保护作用。然后,也有些研究显示20E具有免疫抑制的作用:Gordya等(2016)发现在红头丽蝇脂肪体细胞中,低浓度的蜕皮激素能够提高其免疫力,诱导AMPs的表达,而高浓度的蜕皮激素会抑制其免疫反应;20E处理可以抑制家蚕某些AMPs基因转录水平(Tianetal., 2010);Beckstead等(2005)报道20E以EcR依赖性的方式抑制抗菌肽defensin,cecropinC,attacinA,drosocin和drosomycin的表达,这或许表明激素对免疫的调节作用是剂量依赖性的。这种复杂性暗示了昆虫体内存在多种不同的调控机制,20E调控体液免疫的关键基因,这些基因的作用途径总结起来可以分为3类:(1) 依赖于Toll和IMD等先天免疫通路;(2) 依赖于胰岛素(Insulin)信号途径;(3) 依赖于20E信号通路因子BR-C等的直接调控(王远等,2019)。Rus等(2013)提出果蝇通过两个不同的机制调控AMPs的表达,一种机制是20E通过调控早期蜕皮激素诱导的转录因子(BR-C, Eip93F, Eip74EF, Eip78C和HR46)以及2个果蝇GATA因子(Serpent和Pannier),进而调控PGRP-LC ,通过IMD通路调控AMPs的表达;另一种是不依赖PGRP-LC而是通过BR-C、Serpent和Pannier影响一部分AMPs的表达,两条通路之间存在交叉重叠。该模型解释了在果蝇的先天性免疫中20E可以通过影响IMD信号途径进而调控AMPs表达的机制。
昆虫体液免疫主要由脂肪体(相当于哺乳动物的肝脏)中合成AMPs,分泌到血淋巴后通过开放的体液循环系统将其运送到其他组织器官,发挥系统性免疫作用(Lemaitre &Hoffmann, 2007; Eleftherianosetal.,2021)。20E对先天免疫的调节,既作用于昆虫的系统免疫(Systemic immunity),也调节局部免疫(Local immunity),即通过某些局部器官或组织如中肠、表皮、马氏管、气管中合成的AMPs产生的局部免疫反应。最近的研究发现:化蛹期的果蝇抗真菌基因drosomycin(drs)及其家族同系物成员drosomycin-like2和drosomycin-like5的表达显著增加,蜕皮激素信号调控脂肪体drosomycin和中肠drosomycin-like2的表达(Nunesetal., 2021)。果蝇胚胎气管上皮中抗菌肽drosocin的表达同样需要20E信号(Tanetal., 2014)。家蚕由幼虫向蛹发育的变态期中肠中的模式识别受体(PRR)和AMPs基因表达上调(Xuetal., 2012),Mai等(2017)的研究揭示中肠抗菌肽lebocin的表达上调受到BmBR-C Z4和BmEts的调控。
本研究表明20E诱导家蚕脂肪体抗菌肽BmCeB6的表达,调控BmCeB6表达的顺式元件存在于5′上游启动子区-448~-170之间,该启动子区域内存在的BR-C和E74A等结合位点是潜在的调控因子。下一步将通过对该启动子区域做更精细的截短和双荧光素酶活性分析,同时结合EMSA等方法获得BmCecB6应答20E的调控元件。
