我国入侵害虫西部喙缘蝽的溯源分析
2023-11-09黄志成刘腾腾
黄志成,刘腾腾
(山东师范大学生命科学学院,昆虫系统分类学和进化生态学实验室,济南 250358)
溯源分析在入侵害虫研究中扮演着重要的角色。通过对入侵害虫种群的来源、传播途径和时间等方面进行分析,可以更好地理解入侵害虫的来源和传播途径,并为制定更有效的防控策略提供参考。现代溯源分析方法主要有DNA条形码技术(Hebertetal., 2003)、SNP分型技术(Luikartetal., 2003)、微卫星分析技术(Selkoe and Toonen, 2006)等。DNA条形码技术是一种基于特定的遗传标记鉴定生物种类的方法,这种技术可以通过扩增和测序特定基因区域来确定样本的物种身份,并与现有数据库进行比较以确定其来源。在入侵害虫的溯源分析中,DNA条形码技术可以用于识别潜在的新物种或已知的害虫种类,以确定害虫来源,同时可以确定不同地区的害虫种群之间的遗传差异(Meusnieretal., 2008)。近年来,DNA参考条形码数据库正在不断丰富完善。微卫星分析技术是一种基于微卫星序列多态性的分子标记技术,适用于做入侵物种的起源和扩散的研究,但需要多次PCR扩增和电泳分离、测序等步骤(Estoupetal., 2002)。SNP分型技术是利用单核苷酸多态性(SNP)的分布在基因组中的不同位置来区分不同个体的方法,可用于追踪和鉴定生物入侵的源头和扩散,但生成的数据量较小(Luikartetal., 2003)。后面两种方法都受限于参考数据库不完善,不便于大尺度协作分析。在溯源分析中可以结合多种技术手段,以获取更加准确、全面的信息。
西部喙缘蝽LeptoglossusoccidentalisHeidemann, 1910属于缘蝽科Coreidae喙缘蝽属LeptoglossusGuerin Méneville, 1831,原产于北美洲西部,是针叶树的主要种实害虫。西部喙缘蝽的寄主植物主要属于松科Pinaceae,在欧洲主要危害石松Pinuspinea(Feduccietal., 2009)、海岸松P.pinaster(Sousa and Naves, 2011)、欧洲赤松P.sylvestris(Lesieuretal., 2014)、地中海松P.halepensis(Kment and Baňarˇ, 2008)、欧洲黑松P.nigra(Tescari, 2004)等。在北美洲主要危害欧洲赤松P.sylvestris(Schaffner, 1967)、红松P.resinosa(Katovich and Kulman, 1987)、花旗松Pseudotsugamenziesii(Schowalter and Sexton, 1990)等。在韩国主要危害赤松Pinusdensiflora、北美乔松P.strobus、黑松P.thunbergii和侧柏Platycladusorientalis(Kimetal., 2020),韩国还报道以冬青卫矛Euonymusjaponics为食(Kimetal., 2020)。
西部喙缘蝽1~5龄若虫的平均体长分别为3.07、4.76、8.77、13.56和15.53 mm(Leeetal., 2023)。成虫和若虫都以松科植物未成熟和成熟的种子为食,也以枝梢汁液为食,以雌成虫的危害最大,可以使发育早期的种子和球果败育,成熟种子的营养储备降低,进而可能导致种子发芽不良、苗木活力降低(Koerber, 1963; Blatt, 1997),在北美洲和欧洲,西部喙缘蝽对松子的破坏可达70%~95%(Kimetal., 2020)。西部喙缘蝽还可携带病原真菌Sphaeropsissapinea(Fr.) [=Diplodiapinea(Desm.)]的孢子,导致松树针叶和茎皮坏死,幼苗枯萎(Musolinetal., 2022)。
西部喙缘蝽在原产地美国加利福尼亚州1年1代,在墨西哥每年最多可以发育3代(Aukema, 2007)。在韩国西部喙缘蝽1年1代,成虫在5月中下旬出蛰,交配后在寄主针叶上产一排约5~15枚卵,10~15 d后若虫孵化;到6月中下旬,1龄若虫附着并吸食针叶;2龄若虫转移至球果上以种子为食,成虫活跃到10月中旬左右,从10月下旬开始越冬(Kimetal., 2020)。受聚集信息素的影响,西部喙缘蝽常在松散的树皮下越冬(Dennys, 1927),也可以在建筑物内集群越冬(Spencer, 1942; Schaffner, 1967)。Kitajimaetal.(2022)发现早春时节西部喙缘蝽倾向于吸食针叶树的雄球花,以获取更多的热量。
西部喙缘蝽的自然分布范围覆盖北美西部,广泛分布在不列颠哥伦比亚省(British Columbia)到墨西哥、太平洋海岸到科罗拉多州(Colorado)的地区(Koerber, 1963)。自二十世纪下半叶以来,西部喙缘蝽从北美西海岸向东扩展(Hoebeke and Wheeler, 1982;McPherson, 1990),并在2008年到达北美东部的新斯科舍省(Nova Scotia)(Scudder, 2008)。20世纪90年代末,西部喙缘蝽被引入意大利北部(Tescarietal., 2001),在随后的10年里,欧洲多国陆续报道了此种害虫。西部喙缘蝽在亚洲也在逐渐扩散,已经入侵到中亚(Barclay and Nikolaeva, 2018)和东亚地区,日本(Ishikawa and Kikuhara, 2009)和韩国(Ahn, 2013)都有分布报告。Zhu(2010)报道我国首次在天津口岸截获西部喙缘蝽,此后我国海关多次发现并截获该虫(徐梅, 2014),但并未确认该虫已在我国定殖。马如玉等(2023)在威海和青岛的黑松上发现西部喙缘蝽,为我国境内首次报道。除原产地外,西部喙缘蝽现在已经广布于欧洲(Farinhaetal., 2021)、亚洲、北非(Benetal., 2013; Gapon, 2015)、南非(Heyden and Faúndez, 2020)和南美洲(Faúndez and Rocca, 2017; Kun and Masciocchi, 2019; Heyden and Faúndez, 2020)。各国首次记录时间见表1。
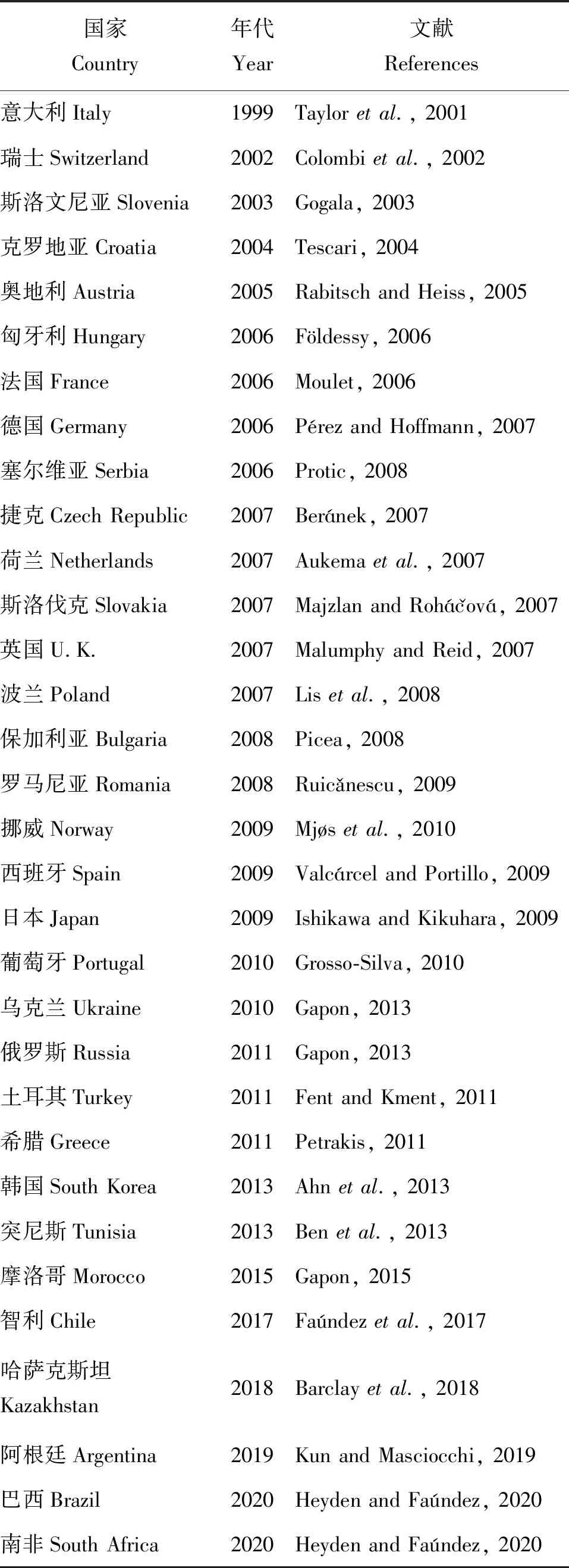
表1 西部喙缘蝽入侵的国家和首次报道文献
最近,山东烟台多地发现西部喙缘蝽的成虫和若虫,表明该种已经在国内定殖。目前国内对西部喙缘蝽的入侵来源、生物学特性等缺乏了解,这一状况不利入侵检疫、种群监测以及防治工作的开展。本研究以野外采集的西部喙缘蝽标本为研究材料,以COI基因为标记基因,利用系统发育和单倍型对其入侵来源进行了分析讨论,为更好地制定规制措施,开展防治工作提供科学依据。
1 材料与方法
1.1 标本采集
本研究所用3头西部喙缘蝽成虫(2♀,1♂)、1头3龄若虫(♂)标本于2022年采集于烟台市沿海防护林和烟台市牟平区昆嵛镇单耳山村。采集后浸泡于无水乙醇中,-20℃保存备用。
1.2 形态观察
使用佳能Canon 80D单反相机、100 mm微距镜头在野外拍摄生态照片,制作成干制标本后使用莱卡Leica S9E体视显微镜观察研究形态特征。综合山东若虫标本和韩国种群的若虫资料(Leeetal., 2023),对各龄若虫做了描述。
1.3 总DNA提取
采用北京诺贝莱生物科技有限公司生产的快速DNA提取试剂盒,提取纯化昆虫组织的DNA,参照试剂盒的说明书进行操作,使用Buffer SL和蛋白酶K溶液对取下的腹部和前足组织进行56℃裂解,然后使用Buffer VL孵育并混合无水乙醇将样品过柱处理,经过WB1和WB2漂洗离心进一步纯化后,使用Buffer EB将样品上柱,然后通过12 000 rpm的离心操作将其洗脱得到纯化后的DNA模板,保存在-20℃的低温环境中备用。
1.4 COI基因扩增、序列测定和分子鉴定
使用通用引物LCO1490/HCO2198进行DNA扩增(Folmeretal., 1994),反应扩增体系为25.0 μL,其中2×UrTaq Master Mix 12.5 μL,10 μmol/L的上、下游引物各1.0 μL、模板DNA 2.0 μL,dd H2O 8.5 μL,反应程序:95℃预变性2 min,95℃ 20s,53℃ 20 s,72℃ 1 min,35个循环;72℃延伸2 min,COI基因PCR扩增产物大小为685 bp。产物4℃保存,1.5%琼脂糖凝胶进行电泳检测。PCR产物经琼脂糖凝胶电泳检测确证后,送擎科生物科技有限责任公司进行测序。测序结果在NCBI数据库、BOLD数据库(Ratnasingham and Hebert, 2007)中进行比对,鉴定烟台标本所属物种,并与青岛西部喙缘蝽序列做同种验证。
1.5 序列和单倍型分析
测序结果保存在NCBI的GenBank数据库中,登录号为OQ457541~OQ457544,下载GenBank数据库中西部喙缘蝽COI基因的所有公共序列,通过MEGA 11软件(Tamuraetal., 2021)中的MUSCLE功能进行对齐,去除前后冗余碱基,得到566 bp数据集,使用Sequence Data Explorer功能分析碱基突变位点。
使用软件DNAsp V6(Rozasetal., 2017)计算核苷酸多样性(Nucleotide diversity, Pi)和单倍型多样性(Haplotype diversity, Hd)。在MEGA 11(Tamuraetal., 2021)中以喙缘蝽属的Leptoglossusclypealis(登录号KY818713)为外群,采用最大似然法(ML)构建系统发育树,使用ChiPlot(https://www.chiplot.online)作图。使用NETWORK 10.2.0.0软件(Bandeltetal., 1999)绘制单倍型网络图。
2 结果与分析
2.1 形态特征和危害
成虫体长约17~20 mm,宽约5~7 mm(测量3头成虫标本)(图1)。体红褐色,长椭圆形,密被半直立刚毛。头长约3 mm,向前延伸,两眼远离前胸背板前缘,单眼红色;头顶黑色,中间有 1道红色条纹;喙较长,至第4腹节;触角第1节、第4节黑色。前胸背板肩角钝圆,前胸背板前缘有两块对称分布的白色斑块,上面有数个黑色斑点;小盾片整体深褐色,与前胸背板相接处黑色;前翅革质部与膜质相交处的翅脉为对称横向分布的白色的“h”形结构(图2);膜片深褐色。前两对足腿节内侧有锯齿,每排2~4个,后足腿节外侧黑色,内侧有两排锯齿,每排6~8个;后足胫节扩张成两侧几乎对称的叶状,扩张部分有白色斑点对称分布,除靠近关节处外整体为黑色。头、胸部腹面均匀分布黑色斑点,腹部的黑色斑点密集分布在腹中线两侧,数量向后逐渐递减。

图1 西部喙缘蝽成虫形态
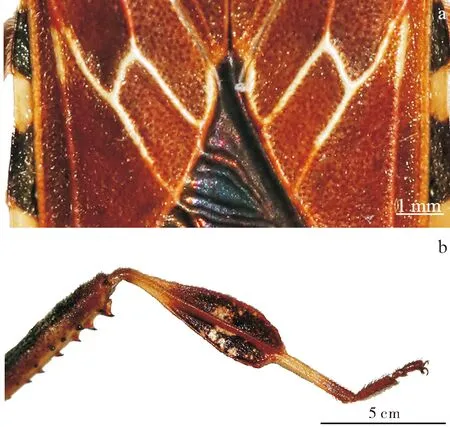
图2 西部喙缘蝽关键识别特征
若虫全身红褐色,其中5龄若虫体色较灰暗。1龄、2龄若虫的腹部较窄,与胸部等宽,从3龄若虫开始腹部宽度大于胸部;3龄若虫各腹节分界明显,4龄若虫腹部较3龄若虫饱满,颜色鲜艳;若虫第4~6腹节之间有显著的黑色臭腺孔,成虫消失。西部喙缘蝽在山东主要危害黑松和赤松,7月至8月中旬可见成虫和若虫在松树的嫩梢和1年生球果上吸食为害(图3),导致嫩梢枯萎发黄、长势减弱,球果发黄、变形、开裂。

图3 西部喙缘蝽在赤松球果上
2.2 分子鉴定
采集的4头标本的COI基因经DNAsp V6软件处理后确定属于同一单倍型,在NCBI数据库和BOLD数据库中的比对结果显示,这些标本的COI基因序列与西部喙缘蝽高度相似(NCBI:99.64%~100%,BOLD:99.23%~100%),证实属于同一物种。
2.3 单倍型分析
通过单倍型分析发现,全球存在10种不同的单倍型,可大致分为5个地理种群(北美西部、北美东部、欧洲、韩国、中国山东)(表2,图4)。山东烟台的序列OQ457541~OQ457544无新的突变位点,与单倍型H_2一致;山东青岛的OM883865属于H_8,OM883918和OM883922分别为新发现的单倍型H_9和H_10(表2),H_9与H_8之间只有1个突变位点,H_10和H_4之间有2个突变位点(表3)。
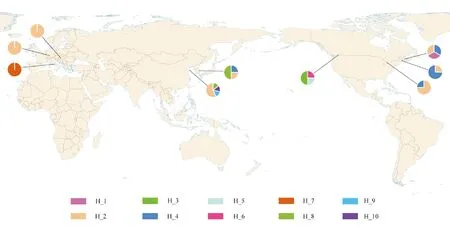
图4 西部喙缘蝽COI基因不同单倍型的世界分布
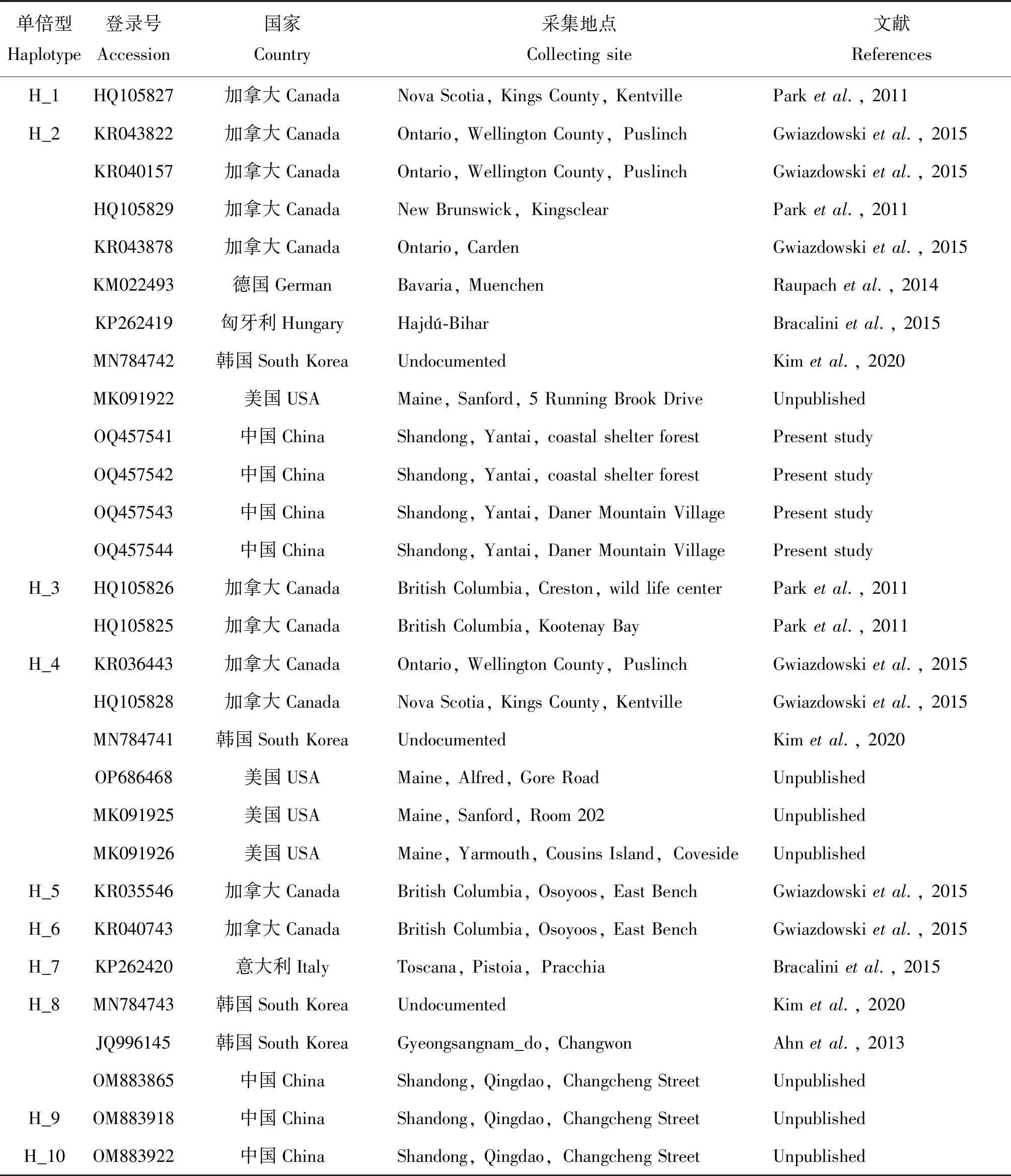
表2 西部喙缘蝽COI基因不同单倍型序列的GenBank登录号和地理分布
在13个位点检测到碱基变异,其中以C/T颠换和A/G颠换为主(表3),这些变异大多属于同义突变,这种变异可能使得基因更稳定(朱彦彬等, 2012)。所有单倍型均有明显的A+T偏向性,A+T的平均含量为63.7%,G+C的平均含量为36.2%,此为昆虫线粒体基因序列组成的一种共有特性(Nei and Kumar, 2000)。
H_3、H_5和H_6的采集地都位于加拿大不列颠哥伦比亚省(British Columbia),属于北美西部喙缘蝽原生分布范围(表2,图4)。结合西部喙缘蝽的传播过程,可以推测H_3、H_5和H_6属于起源于北美西部原生地的初始单倍型。在烟台种群发现之前,H_2分布于北美(加拿大、美国)、欧洲(德国、匈牙利)和韩国(表2,图4),烟台种群可能是从以上地区传播而来。H_2在北美的采集地为安大略省(Ontario);H_4已入侵至韩国,在北美的采集地位于新斯科舍省(Nova Scotia)、安大略省(Ontario)和缅因州(Maine)(表2,图4),以上表明H_2和H_4的传播源头都在北美东部。
H_1的采集地新斯科舍省(Nova Scotia)虽处于北美东部(表2,图4),但经过与初始单倍型(H_3,H_5,H_6)比对后发现,突变位点有3~5个(表3),亲缘关系较远,猜测北美西部还有初始单倍型尚未被发现。
单倍型网络图能够更加清晰地展示不同单倍型之间的遗传距离及其分布情况。在单倍型网络中,H_3、H_6~H_10与H_4联系密切;H_2已入侵至全球多个地区,表明H_2和H_4在西部喙缘蝽的入侵过程中发挥了较大的作用;H_1可能还存在1个初始单倍型(mv1)。除山东烟台外,在其它入侵地(北美东部、欧洲、韩国、中国青岛)均有新的单倍型产生(图5),表明西部喙缘蝽可能会通过基因突变以适应新的生境。
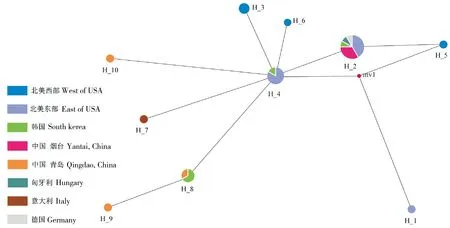
图5 西部喙缘蝽COI基因单倍型网络图
单倍型多样性(Hd)和核苷酸多样性(Pi)能够衡量一个群体线粒体DNA(mtDNA)变异程度,Hd和Pi值越大,群体的遗传多样性则越高(Smithetal., 2006)。中国种群的核苷酸多样性Pi为0.00423,在所有地区中最高;单倍型多样性Hd为0.714,在各地区中处于较高水平(表4)。这表明西部喙缘蝽中国种群具有较高的遗传多样性,其传播来源可能涵盖数个地区。
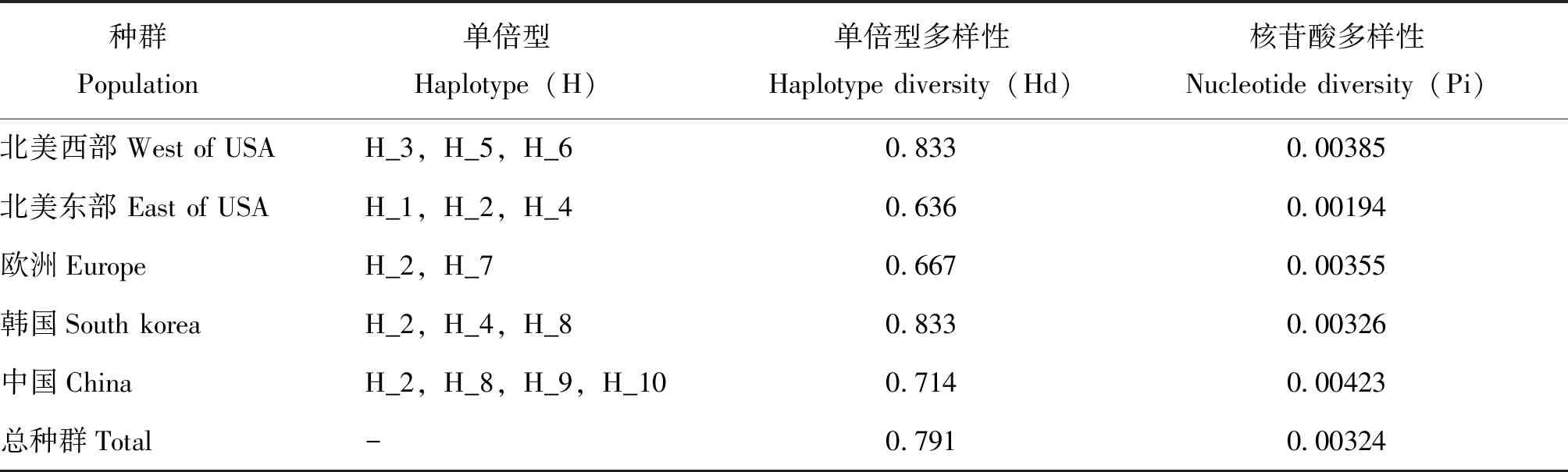
表4 西部喙缘蝽不同地理种群COI基因单倍型多样性、核苷酸多样性分析
2.4 遗传距离和系统发育分析
在系统发育树中,H_2与H_5共同组成一个进化分支,它们之间的遗传距离为0.18%,这表明它们的亲缘关系比较接近。H_4与H_3、H_6在系统发育树中处于同一个进化分支,它们之间的遗传距离同为0.18%(图6),表明H_3,H_6和H_4之间的亲缘关系非常接近。
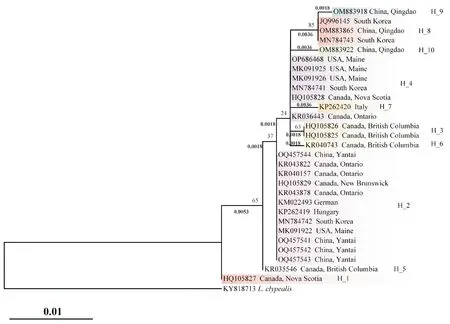
图6 使用ML法对西部喙缘蝽COI基因不同单倍型序列构建的系统发育树
H_8现分布于青岛和韩国。H_9与H_8构成了系统发育树中的一个分支,遗传距离为0.18%,亲缘关系非常接近。H_10与H_4的遗传距离最近,为0.36%(图6)。以上结果表明,青岛种群与韩国种群具有较高的遗传相似性。
山东烟台两个采集点的单倍型均为H_2(登录号OQ457541~OQ457544),和青岛的单倍型H_8(登录号OM883865)、H_9(登录号OM883918)和H_10(登录号OM883922)之间的遗传距离较远为0.54%~0.72%,在系统发育树中分别处于不同的进化分支(图6),表明两地的西部喙缘蝽可能来自不同的地区。以上分析表明,我国西部喙缘蝽种群可能来源于多次独立入侵事件,同时在国内发生了小范围的扩散迁移。
3 结论与讨论
通过本次分析,发现西部喙缘蝽在新入侵地(包括北美东部、欧洲、韩国和中国)的COI基因会进化出新的单倍型。这些单倍型主要是由同义突变引起的,这些突变有助于使基因更加稳定,以适应当地的环境。西部喙缘蝽在2010年前后入侵东亚地区,我国于2010年在天津海关首次截获西部喙缘蝽,推测西部喙缘蝽入侵胶东半岛最长时间不超过12年,入侵时间较短,且采样范围较小,仅限于昆嵛山周边地区,这可能是致使采集自烟台的样本中并未发现任何突变位点的原因。此外,西部喙缘蝽拥有较强的飞行能力(Farinhaetal., 2023),能够依靠寄主植物在入侵区域内传播(Lesieuretal., 2019),个体之间可以频繁进行基因交流,这也可能是导致未能发现新单倍型的原因之一。
北美地区拥有丰富的森林资源,是世界上主要的木材出口地区之一,其原木和锯材的出口量居于世界前列(刘莹, 2015)。结合以上分析,可以看出北美东部在西部喙缘蝽在向世界其他地区扩散的过程中扮演了“桥头堡”的角色(Lesieuretal., 2019)。
山东作为全国木材进口大省,其进口来源涵盖5大洲的80多个国家和地区,在2011-2016年期间,山东口岸截获的有害生物来源国主要为新西兰、乌克兰、罗马尼亚、俄罗斯和美国,其中从美国和俄罗斯进口的木材中截获的有害生物种类随着检疫力度的加强逐年增加(王凯等, 2017)。综合单倍型分析结果和山东口岸截获情况,推测烟台种群的入侵源头为北美东部地区。
Zhuetal.(2014)对西部喙缘蝽在全世界的潜在分布区进行预测,研究显示东亚地区高度适宜西部喙缘蝽生存,西部喙缘蝽的分布受其针叶植物寄主分布区和气候的限制。赵力等(2015)曾对西部喙缘蝽和红肩美姬缘蝽Jaderahaematoloma(Herrich-Schäffer, 1847)在中国的潜在分布区进行模拟,该研究显示基于美国西部种群构建的模型,胶东半岛对西部喙缘蝽的适生性较高,这一预测已被本研究证实。烟台市和青岛市地处胶东半岛,濒临黄海、渤海,与韩国、美国、日本和欧盟贸易往来频繁,且胶东半岛分布有大面积的黑松、赤松,有利于西部喙缘蝽的入侵和定殖,山东内陆山区,如蒙山、泰山等也广泛分布着松属植物,为西部喙缘蝽向内陆继续扩散提供了有利条件;红肩美姬缘蝽的入侵和扩散也应引起重视,此虫已在台湾形成稳定种群(Tsaietal., 2013),其寄主无患子科Sapindaceae植物在中国西南、东南、华南地区广泛分布,为其入侵提供了便利条件,因此需要提高警惕并加强防控。
西部喙缘蝽主要危害种实,影响松林的自主更新,还能给松科植物带来更多的病害,对针叶林经济和生态环境有一定的威胁。本研究推测了我国西部喙缘蝽种群的入侵来源。山东种群有两个不同的入侵来源:烟台种群可能来自北美东部,青岛种群可能来自韩国。由于SNP分型技术和微卫星技术受限于世界西部喙缘蝽基因数据库的不足,本研究采用DNA条形码技术对西部喙缘蝽进行溯源分析。为了对西部喙缘蝽的入侵过程进行更加明确地溯源分析,将来需要扩大国外标本的采集范围,同时深入调查国内入侵种群的分布现状,提取国内外不同种群的基因组信息,使用更加丰富的分子标记进行相互验证。
致谢:感谢论文中使用的公共序列的作者和单位,感谢青岛农业大学王俊平提供西部喙缘蝽青岛种群的公开序列。感谢当地林场、保护区管理局提供的便利和协助。
