糖基化豌豆分离蛋白稳定Pickering高内相乳液的贮藏稳定性
2023-11-09孙丛,谭智峰,董馨然,邵振文,徐献兵,3,宋亮,3
孙 丛, 谭 智 峰, 董 馨 然, 邵 振 文, 徐 献 兵,3, 宋 亮,3
( 1.大连工业大学 食品学院, 辽宁 大连 116034;2.青岛海智源生命科技有限公司, 山东 青岛 266000;3.大连工业大学 国家海洋食品工程技术研究中心, 辽宁 大连 116034 )
0 引 言
Pickering高内相乳液(Pickering HIPEs)通常是由固体颗粒稳定的内相体积分数超过0.74的乳液体系。Pickering HIPEs因其高比例的油相体积,在外界环境压力下和贮藏过程中稳定性较差,易发生相分离和脂质氧化等现象[1]。蛋白质颗粒具有良好的表面活性和界面稳定性,可动态平衡地吸附在油水界面并形成一层物理阻隔的界面膜,从而提高乳液液滴的稳定性[2]。
豌豆分离蛋白(PPI)是一种公认的非食品过敏原蛋白质,具有较高的营养价值和多样功能特性[3]。但PPI自身较低的乳化性和溶解性限制了其在食品体系中的应用。基于美拉德反应的糖基化蛋白已被证实是一种合适的Pickering稳定剂,用以构建Pickering乳液[4]。Zha等[5]已报道糖基化修饰提高了PPI的乳化性和溶解度,并提高了其稳定乳液的氧化稳定性,但并未深入研究乳液贮藏期间微观结构和流变特性的变化。不同糖基化程度的PPI界面特性会影响乳液的稳定性[6]。目前,关于Pickering HIPEs体系的贮藏稳定性,尤其贮藏对糖蛋白颗粒不可逆吸附形成的影响,仍然缺乏系统的研究和报道。
本研究以不同糖基化程度的PPI颗粒稳定Pickering HIPEs为研究对象,探究贮藏期间其微观结构、流变特性和氧化稳定性的变化规律,以期明确PPI的糖基化程度对Pickering HIPEs贮藏稳定性的影响。
1 材料与方法
1.1 材料与仪器
PPI,纯度85%,北京宝希迪有限公司;核桃油,青岛海智源生命科技有限公司。硫代巴比妥酸、三氯乙酸、硫氰酸铵,国药集团化学试剂有限公司;2,4-二硝基苯肼,上海阿拉丁生化科技有限公司;二氯甲烷,色谱级,上海斯百全化学有限公司;氯化胆碱(分析级)、乙腈(色谱级),上海麦克林生化科技有限公司。
M200多功能酶标仪,瑞士TECAN集团公司;T25均质分散机,德国IKA公司;荧光倒置显微镜,日本Nikon公司;紫外分光光度计,安捷伦科技有限公司;Discovery HR-2流变仪,美国TA公司;AB 5500 QTRAP质谱仪,美国AB SCIEX公司。
1.2 方 法
1.2.1 糖基化豌豆分离蛋白(gPPI)的制备
基于Fu等[7]报道的天然低共溶剂法(NADES)和湿热法制备gPPI,得到的gPPI分别为PGD和PGW。基于OPA法测定gPPI的糖基化程度[8],PGW和PGD的糖基化程度分别为27.97%和36.96%。
1.2.2 Pickering HIPEs的制备
将质量分数1%的PPI和两种gPPI,分别溶于pH 7的PBS溶液中,用1 moL/L的NaOH或HCl调节至pH 7。将3种蛋白溶液分别与核桃油以体积比1∶4混合,加入质量分数0.02%的NaN3作为抗菌剂,在8 000 r/min下均质2 min,得到3种油相比均为80%的Pickering HIPEs。
1.2.3 Pickering HIPEs的加速贮藏
将10 mL乳液样品在20 mL玻璃管中60 ℃烘箱中贮藏7 d[9],测定贮藏前后乳液的微观结构、流变特性和产生的醛、酮含量。间隔1 d从乳液中心部位取出1 mL样品,测定脂质过氧化氢、共轭二烯、共轭三烯和硫代巴比妥酸含量。
1.2.3.1 Pickering HIPEs微观结构的观测
采用荧光倒置显微镜观测新鲜与加速贮藏后Pickering HIPEs的微观形貌。基于Du等[10]报道的方法对乳液染色,使用20倍物镜观察乳液样品的微观结构。
1.2.3.2 Pickering HIPEs流变特性的检测
采用配备直径40 mm平行铝板的流变仪检测新鲜与加速贮藏后Pickering HIPEs的流变特性[10]。环境温度25 ℃,几何间隙1 000 μm。在应变扫描模式下,弹性模量(G′)和损耗模量(G″)以1.0 Hz的固定频率记录应变0.001%~1.0%;在频率扫描模式下,在0.1~10 Hz振荡,固定频率为1 Hz,所有测量均在确定的线性黏弹性区域内的1%应变下进行。在0.1~100 s-1的剪切速率下测量样品的表观黏度。
1.2.3.3 脂质过氧化氢含量的测定
根据Zeng等[1]报道的方法测定脂质过氧化氢含量。由过氧化氢标准曲线计算含量(y=0.773 5x-0.004 6,R2=0.999)。
1.2.3.4 共轭二烯和共轭三烯含量的测定
根据Bolea等[11]报道的方法测定共轭二烯和共轭三烯。乳液经过加速贮藏后,取0.05 g样品在5 mL异丙醇中稀释,12 000g离心5 min,在2 mL异丙醇中稀释1 mL上清液,采用紫外可见分光光度计在233 nm(共轭二烯)和268 nm(共轭三烯)测定吸光度。结果以每千克油中的氧化产物摩尔数表示,摩尔消光系数为27 000 mol-1·cm-1。
1.2.3.5 硫代巴比妥酸值的测定
根据Zeng等[1]报道的方法测定硫代巴比妥酸。硫代巴比妥酸值换算为每千克硝化的油脂中含有的丙二醛(mg/kg),通过丙二醛标准品制作的标准曲线获得系数为2.77,乘以吸光度即为硫代巴比妥酸值。
1.2.3.6 醛与酮含量的测定
基于Zhao等[12]报道的方法测定醛和酮含量。样品前处理:在100 mg乳液样品中加入40 μL EDTA-Na2(0.02 mol/L)溶液和500 μL HCl溶液(0.25 mol/L),涡旋振荡3 min;5 000g、5 min收集上清液,在上清液中加入100 μL DNPH(2 mg/mL乙腈),避光室温反应1 h;用500 μL二氯甲烷萃取,充分振荡后静置5 min,收集下层二氯甲烷至新试管中,重复一次,合并萃取液;氮吹,去除有机试剂,在残留物中加入乙腈,定容到2 mL容量瓶中,经0.22 μm纤维素膜过滤。高效液相色谱-质谱分析:根据Zhao等[12]的方法设置参数。
1.2.4 数据分析
结果以“平均值±标准偏差”的形式表示,所有统计分析均基于重复实验3次,使用SPSS 19.0软件分析数据,采用单因素方差分析(One-Way ANOVA)确定差异是否显著,使用邓肯式多重比较在5%水平评估处理样品之间差异的显著性,以p<0.05表示具有统计学意义上的显著差异。
2 结果与讨论
2.1 加速贮藏前后Pickering HIPEs的微观结构
如图1所示,与PPI稳定的乳液相比,gPPI(PGW和PGD)稳定的乳液油滴具有更厚的界面层,并且随着糖基化程度的增大,乳液粒径逐渐减小。这主要是因为gPPI(尤其是PGD)具有更好的乳化性能[6]。经加速贮藏后,PPI稳定乳液的外观出现析油现象,并且液滴之间出现了大量聚集油;PGW稳定乳液外观几乎没有变化,仅液滴有轻微聚集现象;PGD稳定乳液的外观未见变化,其液滴形貌也无变化。贮藏后乳液的微观形貌结果表明,gPPI颗粒(特别是糖基化程度更高的PGD)具备更好的界面润湿性[13],可以紧密吸附到油水界面,形成更厚的界面膜抵抗聚结。

(a) 新鲜PPI稳定HIPE
2.2 加速贮藏前后Pickering HIPEs的流变特性
如图2所示,各组乳液的G′均大于G″,即乳液样品均表现为以弹性为主的乳液黏弹性(图2(a),2(c))。而随着糖基化程度的升高,G′也随之增大,这是由于gPPI在界面上排列成更有序的网络(图1),而糖链提供的更强的空间作用力赋予HIPEs更强的黏弹性。经加速贮藏后,各组G′均明显下降,这可能是由于贮藏后乳液界面处吸附蛋白颗粒的结构重排[14]。但与PPI稳定Pickering HIPEs相比,gPPI稳定乳液的G′下降程度较低,这可能因为gPPI颗粒可以更好地维持乳液液滴间的紧密桥连结构,从而保持较好的黏弹性。如图2(b)所示,各组乳液样品均表现出剪切变稀行为,这可能与剪切速率增加时液滴之间的聚集变形和破坏有关[15]。随着PPI糖基化程度的增加,也观察到了较高的黏度,这可归因于gPPI在连续相中形成密集的界面层和牢固的网络结构。此外,加速贮藏后,各组黏度都有不同程度的下降。

(a) 新鲜乳液的频率
2.3 加速贮藏过程中Pickering HIPEs的氧化稳定性
2.3.1 脂质过氧化氢(LH)质量摩尔浓度的变化
如图3所示,浮液PPI稳定的LH质量摩尔浓度快速上升。相比之下,PGW和PGD的LH质量摩尔浓度均上升较缓,揭示gPPI可有效延缓其稳定乳液的氧化速率(p<0.05)。一方面由于gPPI本身具备一定的抗氧化活性[16],另一方面,与乳液微观形貌变化(图1)有关。除此之外,gPPI稳定乳液具有较高的凝胶强度,可有效地延缓氧化因子的移动[17]。相比于PGW稳定乳液, PGD稳定乳液具有更好的氧化稳定性,这是由于PGD更高的糖基化程度赋予了其稳定乳液更强的凝胶强度。
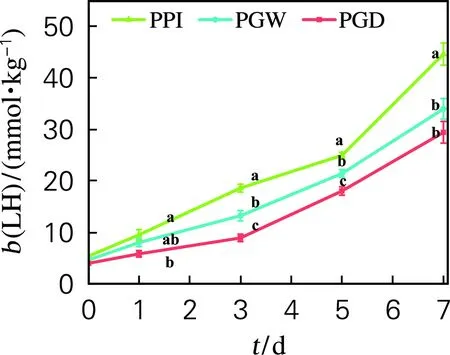
图3 加速贮藏过程中脂质过氧化氢质量摩尔浓度的变化Fig.3 Changes in lipid hydroperoxides during accelerate storage process
2.3.2 共轭二烯(CD)和共轭三烯(CT)质量摩尔浓度的变化
如图4所示,相比于PPI稳定乳液的CD和CT质量摩尔浓度在第7天均快速升高,PGW和PGD的CD和CT均缓慢升高。结果揭示,乳液的脂质氧化速率随PPI糖基化程度的升高而降低。这可能是由于随着糖基化程度的增加,PGD共价结合了更多的葡萄糖,其接枝的糖链在油滴周围形成了更厚的物理屏障,阻止了促氧化剂与脂质的接触[9],显著减少了CD和CT的产生(p<0.05)。

(a) 共轭二烯
2.3.3 硫代巴比妥酸(TBARS)值的变化
由图5可以看出,随着PPI糖基化程度的升高,TBARS的生成速率显著下降(p<0.05),表明gPPI稳定的乳液具有更强的抑制脂质氧化的能力,这主要与糖蛋白颗粒在油滴周围形成的巨大空间位阻有关[6]。
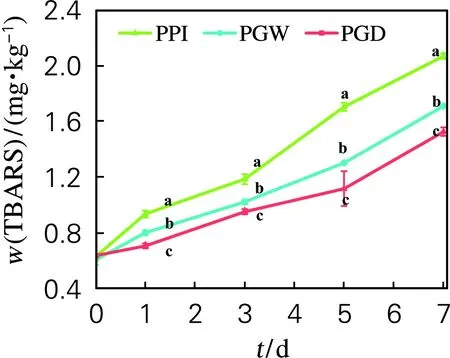
图5 加速贮藏过程中硫代巴比妥酸值的变化Fig.5 Changes in thiobarbituric acid reactive substances accelerate storage process
2.3.4 加速贮藏后Pickering HIPEs产生的醛和酮质量分数
如表1所示,贮藏后各组Pickering HIPEs 的醛和酮生成量均较高。与gPPI稳定Pickering HIPEs相比,天然PPI乳液中醛和酮浓度显著升高(p<0.05)。与PGW稳定乳液相比,PGD稳定乳液醛和酮的生成量显著降低,糖基化程度增大显著减少了乳液醛和酮的生成量(p<0.05)。结果表明,糖基化蛋白颗粒可有效地抑制HIPEs醛和酮的生成量。这可能是由于油水界面的gPPI颗粒赋予了乳液更高的抗氧化活性[16],并在油水界面形成了更厚的界面膜[6],延缓脂质氧化程度,减少了乳液中醛和酮的生成量。

表1 加速贮藏后HIPEs产生的醛和酮质量分数(n=3)Tab.1 The contents of aldehyde and ketone in HIPEs after accelerate storage μg/g
3 结 论
糖基化修饰可以赋予gPPI良好的乳化性和界面润湿性,其稳定的Pickering HIPEs具有良好的空间结构稳定性和较强的凝胶网络。经加速贮藏后,gPPI稳定Pickering HIPEs具有完整的液滴结构和良好的抗聚集性,以及更强的氧化稳定性。其中,PPI稳定Pickering HIPEs产生己醛11.06 μg/g,gPPI稳定Pickering HIPEs产生己醛5.68 μg/g,糖基化作用显著降低了乳液中醛和酮的生成(p<0.05)。Pickering HIPEs的贮藏稳定性随着PPI糖基化程度的升高而增强,揭示了较高糖基化程度的PGD颗粒可通过形成更厚的界面层和赋予乳液增强的凝胶网络结构来提高HIPEs的贮藏稳定性。
