组织样本RNA 完整性影响因素的研究进展
2023-11-09陈雷陈奕霖张鑫梁玮孙博许蜜蝶同济大学附属同济医院临床研究中心生物样本库中国医药生物技术协会组织生物样本库分会青年工作组上海000北京大学第一医院生物样本库中国医药生物技术协会组织生物样本库分会青年工作组北京000同济大学附属同济医院临床研究中心生物样本库上海000上海交通大学医学院附属新华医院生物样本库中国医药生物技术协会组织生物样本库分会青年工作组上海0009北京大学第一医院生物样本库北京000复旦大学附属肿瘤医院病理科组织库中国医药生物技术协会组织生物样本
陈雷,陈奕霖,张鑫,梁玮,孙博,许蜜蝶(.同济大学附属同济医院临床研究中心生物样本库,中国医药生物技术协会组织生物样本库分会青年工作组,上海000;.北京大学第一医院生物样本库,中国医药生物技术协会组织生物样本库分会青年工作组,北京 000;.同济大学附属同济医院临床研究中心生物样本库,上海000;.上海交通大学医学院附属新华医院生物样本库,中国医药生物技术协会组织生物样本库分会青年工作组,上海 0009;.北京大学第一医院生物样本库,北京000;.复旦大学附属肿瘤医院,病理科组织库,中国医药生物技术协会组织生物样本库分会青年工作组,上海 000)
生物样本库是医学研究的基石,其保藏样本的质量会对下游研究结果产生重要影响[1-2]。随着样本科学、分子生物学和组学研究的发展,基因表达分析的可靠性受RNA 质量影响已成为共识。RNA 完整性作为判断组织样本质量的关键指标,是评价组织样本质量的重要依据[3],也是下游生物信息分析,特别是基因组学研究的基础和保障。因此了解影响组织样本RNA 完整性的因素至关重要。
随着分子生物学技术的进步,RNA 完整性的评价方法也在不断更新,从northern 印迹杂交[4]、定量原位杂交[5]、聚合酶链式反应[6],向数字化、科学化、自动化方向发展。目前,基于微流控芯片和毛细管电泳技术可通过软件算法分析18 s 和28 s 的电泳数据并对RNA 质量进行分级,分析结果以数值表示。使用最广泛的是使用Bioanalyzer(Agilent Technologies)检 测 的RIN(RNA Integrity Number)[7]。 此 外 还 有 使 用Experion (Bio-Rad Laboratories)检 测 的RQI(RNA Quality Index)[8]等其他指标。不同指标的解读方法相似,取值范围为1 ~ 10,其中1 表示RNA 完全降解,10 表示RNA 完整。
通过文献检索,其中检索词:RIN tissue、RIN tissue types、RIN tumor、RIN tumor tissue、RIN different tumor types,检索途径是pubmed,检索范围是全部,本文对影响组织样本RNA 完整性的样本固有分析前变量和保藏分析前变量进行了汇总和分析,尝试总结不同器官样本的基础RIN 值,归纳影响组织RNA 完整性的关键分析前变量。为系统了解组织样本RNA 质量和保藏技术优化提供参考。
1 固有分析前变量对RNA 完整性的影响
影响样本RNA 完整性的样本固有分析前变量主要有:① 捐献者属性:主要包括年龄、性别和手术方式;② 样本属性:主要包括器官类型、解剖学位置、样本类型和病理属性(表1)。

表1 固有分析前变量对RNA 完整性的影响
1.1 捐献者属性:年龄、性别。有研究认为捐献者的年龄和性别对组织样本RIN 值无显著影响[9]。而Olsen 等[3]发现男性的正常结肠样本RIN 值显著低于女性。 这种差异有可能与男性和女性在吸烟、动脉粥样硬化或因其他合并症造成的代谢紊乱情况差异有关。
手术方式:手术方式可能影响组织样本RNA完整性。研究表明行腹腔镜切除术患者的结肠组织样本,RIN 值或RQI 值显著低于开放式手术[3,10]。也有研究认为手术方式对肝癌[9]和胃癌组织[11]样本的RIN 值无显著影响。手术方式对RNA 完整性的影响可能与麻醉时间、血管阻断时间、冷热缺血等因素有关,而其影响程度可能与不同器官的血供情况有关。
1.2 样本属性:器官类型。器官类型是影响组织样本RNA 完整性的关键因素。多项研究发现不同器官的RIN 值不同。有研究认为脑组织RIN 值最高,回肠和脾最低[12]。也有研究认为肝组织RIN值最高,脑最低,且不同器官类型的组织样本RIN达到7 的比例不同[13]。虽然各器官的RIN 值水平在研究之间不完全一致,这可能与不同研究纳入的样本种类、数量、取材和处理方法等差异有关,但研究结果普遍提示RIN 值存在器官异质性。这可能与RNA 降解的器官异质性[14]、昏迷、缺氧状态[15]和pH 值有关[16]。RIN 值器官异质性的成因和影响因素仍有待进一步研究和验证。
解剖学位置:一些研究认为样本的解剖学位置与RNA 的完整性有关。在结肠癌样本中发现左半结肠组织样本的RQI 值显著高于右半结肠[10],在胰腺样本中发现胰体和胰尾样本的RIN 值低于胰头[17]。而在和肝癌[9]和胃癌[11]组织样本中未发现RNA 完整性受肿瘤位置的影响。解剖学位置对RNA 完整性的影响可能与血供均匀程度、免疫细胞、结缔组织或脂肪含量、酶活性和菌群环境等因素有关[18]。
样本类型:多项研究发现肿瘤组织样本和正常组织样本的基础RIN 值不同。结肠癌肿瘤组织的RQI 高于正常组织[20],在肾细胞癌[19]和乳腺癌中也发现肿瘤组织的RIN 值高于正常组织[21]。有研究发现肿瘤组织中RIN ≥7 的比例显著高于正常组织[20]。此外也有研究认为结肠和肝脏的肿瘤与正常组织间RIN 值没有显著差异[3,22]。提示样本类型会对RIN 值产生影响,而其影响程度在不同器官中存在差异。
病理属性:病理属性包括肿瘤TNM 分期、分化程度及其他非肿瘤因素。有研究发现在非小细胞肺癌样本中高TNM 分期与低RIN 值(RIN <7)正相关[23],在肝癌样本中未发现分期与RIN 值的相关性,但发现低分化与低RIN 值正相关[9];在结肠癌肿瘤样本中也发现低分化与低RIN 值正相关[3]。分化程度低,TNM 分期高的肿瘤通常侵袭转移能力较强,其肿瘤细胞比例、间质微环境,如小血管、免疫细胞、成纤维细胞和坏死程度等因素可能对RNA 完整性产生负面影响。非肿瘤因素方面,有研究认为脂肪酶含量与胰腺样本RIN 值负相关[17],而HBV 感染情况与RIN 值不存在显著相关性[9]。
2 保藏分析前变量对RNA 完整性的影响
影响样本RIN 的保藏前变量因素主要有:① 采集过程主要影响因素:热缺血、冷缺血、样本大小及细胞比例;② 样本制备保存过程主要影响因素:显微切割、保存方式、储存时间(表2)。
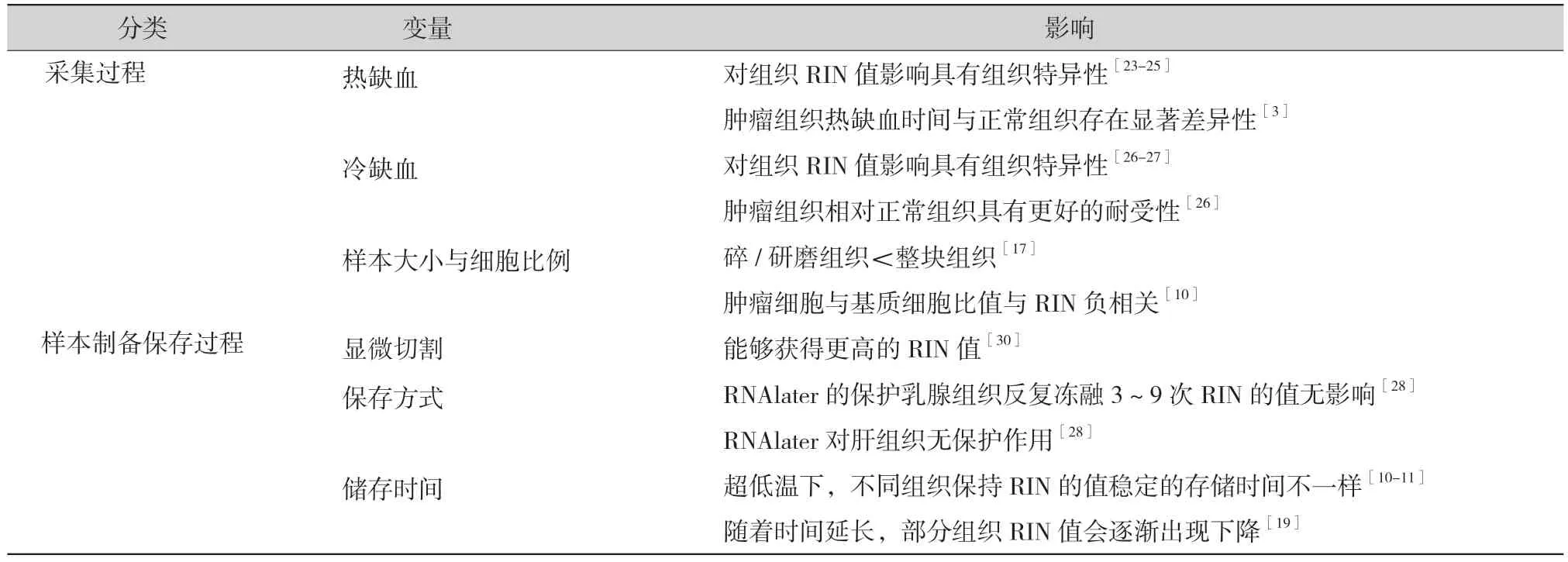
表2 保藏分析前变量对RNA 完整性的影响
2.1 采集过程主要影响因素:热缺血。组织样本供血停止到离体之前的缺血状态称之为热缺血。研究表明正常组织RIN 随着样本离体时间间隔(post mortem interval,PMI)的延长而下降,但不随储存时间的延长而下降,且呈现一定的组织类型特异性,具有不同的PMI 值。一般来说,脑、乳腺热缺血时间不能超过1 h[24-25];肺标本热缺血时间不能超过2 h[23]。而胃、肾脏、结直肠、食管和膀胱标本热缺血时间不超过2.5 h; 50 h 内热缺血时间与结肠、肝脏、肺、肾、胰腺、脾脏和皮肤的RIN 值呈负相关。而心脏和骨骼肌的RIN 与热缺血时间无相关性,它们能在样本离体时间间隔长达36 h 甚至更长时间呈现显著的稳定性,保持高质量的RNA[19]。另有研究表明肿瘤的分化等级可能是RNA 质量的唯一显著的预测因素[3]。正常结肠组织离体时间10 ~ 325 min 之间,热缺血时间与正常组织RIN 之间存在显著的相关性,而结肠肿瘤组织的热缺血时间与RIN 之间无相关性,造成组织间的这种差异的原因可能是由于肿瘤通过Warburg效应增加了糖酵解的活性,故而对热缺血有更强的恢复能力。
冷缺血:组织样本离体到低温转运/保存之前的缺血状态称之为冷缺血,冷缺血时间和温度对组织的质量的不利影响呈现一定的组织特异性。当缺血时间在15 min 以内时,无论是冷缺血还是室温缺血,肿瘤与邻近正常样本的RNA 质量均无差异。随着时间延长,当低温(4℃)缺血时间小于30 min 时,肝肿瘤组织的RIN 与缺血时间无显著相关性,而非肿瘤组织RIN 开始下降。因此,肝癌标本的冷缺血时间小于15 min,是维持组织中RNA 高完整性的关键[26]。不同组织的冷缺血时间不一样,其中脂肪组织的冷缺血时间应小于20 min[27],胃、肾脏、结直肠、食管和膀胱癌组织冷缺血时间不能超过30 min[12]。分析比较了16 种新鲜冷冻脏器肿瘤组织样本的指标,包括:肿瘤、纤维化、坏死、黏蛋白、炎症等,进行组织学评估并结合组织RIN 的值,表明新鲜的冷冻癌组织(如乳腺、结肠、胃、食道、胆囊、肾脏、肝脏、肺、卵巢、胰腺、小肠、脾脏、胆总管、腹膜、睾丸、膀胱),冷缺血1 h 不影响这些肿瘤组织的RNA 完整性[22]。如果将乳腺肿瘤组织收集并保存在RNAlater 溶液中,延长冷缺血时间不影响组织mRNA 的产量和完整性以及相关基因的表达评估[25]。
样本大小及细胞比例:样本大小及细胞比例对样本RIN 值也存在影响,胎盘样本直径介于0.1 cm ~ 1 cm 对样本的RIN 值无影响[28],碎/研磨的胰腺组织的RIN 值一般小于整块胰腺组织的RIN 值[17],胰腺组织切成重量小于100 mg 的小块,可提高RIN,而重量大于100 mg 胰腺肿瘤组织与正常的胰腺组织相比,组织中的RNA 降解明显[29],提示样本大小与RIN 值具有一定的相关性。在结肠肿瘤组织中,肿瘤细胞与基质细胞比值与RIN负相关[10],而肿瘤细胞面积比(95%)和坏死面积比(10%) 与RIN 无相关性[22]。
2.2 样本制备保存过程主要影响因素:显微切割。显微切割会对样本的RIN 存在一定影响,有研究表明,经过显微切割处理过的胰腺组织,能够获得更高的RIN 值。另有研究证明使用显微解剖分离的胰腺癌细胞的RIN 值下降1 ~2,但仍能保持其RIN 的值大于6[30]。
保存方式:在RNAlater 的保护环境下,乳腺组织可以反复冻融3 ~ 9 次RIN 的值无影响,但若无RNAlater 保护,乳腺组织冻融1 次即影响RIN的值。RNAlater 保护液对肝组织无保护作用,而对于胚胎组织,保存在RNAlater 样本组织比直接快速冷冻的新鲜组织具有更高且更一致的RIN 值[28]。
储存时间:生物标本样品处理必须控制和标准化储存时间,因此更好地了解时间对冷冻保存样本质量的影响非常重要。研究表明常见脏器(包括胰腺)超低温保存2 ~ 6 年无影响,结直肠、胃等组 织 超低 温 保存10 ~ 12 年 其RIN 的值 无 影响[10-11]。随着时间延长,部分组织RIN 值会逐渐出现下降。在19 ~ 24 个月和25 ~ 30 个月的肾癌样本中观察到有些许降解迹象,但检测结果显示其RIN 值一般在7 左右[19]。冻存8 年的胰腺组织的RIN 值随时间延长降低[17]。因此保存时间是影响生物标本低温保存过程中RNA 完整性的主要因素。
3 思考与结论
多项研究表明不同器官的基础RIN 值并不相同,存在器官异质性的趋势。正常组织与肿瘤组织的RIN 值差异在多种器官中被发现,通常认为肿瘤组织的RIN 值高于正常组织。手术方式对RNA完整性的影响可能与冷热缺血有关,通常较短的冷热缺血时间有利于获取较高质量的RNA。保护剂通常对RNA 完整性有保护作用,尤其在反复冻融条件下。随着储存时间延长,组织样本RIN 值呈下降趋势。
除以上因素外,仍有其他因素可能影响组织RNA 完整性但目前研究较少,值得进一步探索。固有分析前变量包括:① 既往病史及用药情况,如糖尿病、高血压、高血脂等代谢相关疾病。② 生活习惯,如吸烟、饮酒、运动等情况。③ 精神状态情况,如长期焦虑状态等。④ 除肿瘤外的其他疾病情况,如炎症、退行性疾病等。⑤样本属性,如细胞比例,间质微环境、酶含量等。⑥ 尸检样本的死亡原因等。保藏分析前变量包括:组织样本的大小,如块状、片状、末状等新型保护剂、真空等先进的保藏技术方法等均可能对RNA 完整性产生不同程度的影响。此外,随着近年来生物样本活库的长足发展,研究不同组织来源类器官样本的基础RIN 值以及影响复苏后RNA 完整性的因素也是未来值得深入研究的方向。
综上所述,个体差异以及采集、制备、储存等各保藏环节的条件差异均有可能对组织样本RNA质量产生影响,在研究中应注意通过严谨的实验设计和适宜的统计分析方法尽量排除其他因素干扰,以期获得更科学、更有价值的研究结果。研究组织样本RNA 完整性的影响因素有助于厘清与样本质量相关的关键信息,助力样本相关数据的完善和数据集的标准化,推动样本保藏技术流程的优化,靠近Fit-For-Purposed 的目标。同时应注意在考虑质量因素的同时评估新技术和新方法的经济性,从多维度出发,促进生物样本学的标准化和科学化发展。
