子痫前期患者胎盘组织Toll样受体表达与血清肿瘤坏死因子-α、白细胞介素-6的相关性分析
2023-11-09陈海霞
陈海霞 程 静 赵 华 梁 洁
江苏省无锡市妇幼保健院病理科 214000
子痫前期(PE)是妊娠期高血压的一种,多发生于妊娠20周后,具体表现为头痛、恶心、呕吐、眼花、胸闷等,容易引起供氧不足、肝肾心功能衰竭、胎儿窘迫、胎盘早剥、宫内生长发育受限等不良妊娠结局,对母婴生命安全构成一定威胁[1-2]。据调查显示:世界范围内PE的发生率高达2%~8%,每年由于PE死亡的孕产妇多达70 000万[3]。及早对PE患者病情作出判断,并预测不良妊娠结局发生风险,对临床及早展开个性化治疗具有重要指导意义。Toll样受体表达(TLRs)是一种模式识别受体,与免疫耐受、特异性免疫等有着极为密切的联系,可刺激机体释放大量的促炎因子,损伤血管内皮功能,引发PE或促进疾病进展[4-5]。肿瘤坏死因子(TNF)-α、白细胞介素-6(IL-6)是临床常见的促炎因子,与组织、血管内皮功能损伤联系密切,在维持Th1/Th2平衡方面具有重要意义[6-7]。基于此,为探究PE患者胎盘组织TLRs与血清TNF-α、IL-6的相关性,本文选定本院妇产科就诊的112例PE患者研究,具体如下。
1 资料与方法
1.1 一般资料 选定本院妇产科2020年11月—2022年10月就诊的112例PE患者为P组,另选定同期本院妇产科待产的112例健康产妇为I组。P组:孕周23~35周,平均孕周(29.12±0.64)周;产妇类型:70例初产妇、42例经产妇。I组:孕周25~36周,平均孕周(29.85±0.85)周;产妇类型:78例初产妇、34例经产妇。两组一般资料比较差异无统计学意义(P>0.05),可比较。
1.2 选择标准 (1)纳入标准:①P组患者均满足《妊娠期血压管理中国专家共识(2021)》[8]中对“PE”诊断标准。②患者均为首次发生PE。③产检资料齐全。④均为自然受孕、单胎妊娠。⑤均是自愿参与本次研究。(2)排除标准:①近1个月使用过阿司匹林等抗凝药物者。②合并出血性疾病者。③合并其他妊娠并发症者。④胎儿染色体异常或畸形者。⑤同期参与其他研究或中途从本研究退出者。⑥合并巨大胎盘血管瘤、动静脉瘘等疾病者。⑦合并红斑狼疮、风湿性疾病等疾病者。⑧存在酗酒、吸毒、吸烟史者。⑨合并狂躁症、焦虑症等精神障碍者。
1.3 方法 (1)胎盘组织TLRs:受检者娩出胎盘后,取与脐带距离3cm的1.0cm×1.0cm×1.0cm的胎盘组织,冲洗干净后固定在10%的甲醛溶液中,石蜡包埋,37℃环境下干燥,切片4μm,保存在4℃环境,采用反转录聚合酶链式反应(RT-PCR)法检测TLRs,TLRs上、下游引物序列是5’-TGGATACGTTCCTTATAAG-3’、5’-GAAATGGAGGCACCCCTTC-3’,内参U6上游、下游引物序列是5’-TCATGAAGTGTGACGTTGACATCCGT-3’、5’-CCTAGAAGCATTTGCGGTGCACGATC-3’,扩增反应条件,94℃下反应5min,94℃下反应30s,60℃下反应40s,72℃下反应90s,72℃下反应10min,共计35个循环,计算TLRs表达量,试剂盒均由北京百奥莱博科技有限公司提供。(2)血清TNF-α、IL-6:抽取所有受检者入院24h内5ml空腹静脉血,离心10min,4 000r/min离心速率,15cm离心半径,分离上层清液后保存在-80℃环境,以酶联免疫吸附法(ELISA)检测TNF-α、IL-6,试剂盒均由齐一生物科技(上海)有限公司提供。
1.4 观察指标 比较两组胎盘组织TLRs、血清TNF-α、IL-6水平,比较不同严重程度组胎盘组织TLRs、血清TNF-α、IL-6水平,比较有、无不良妊娠结局组胎盘组织TLRs、血清TNF-α、IL-6水平。出现早产、胎膜早破、产后出血、新生儿出现、胎儿死亡、胎儿窒息、低体重儿等均为不良结局。子痫前期严重程度分级标准[9]:蛋白尿≥0.3g/24h,收缩压(SBP)/舒张压(DBP)≥140/90mmHg(1mmHg=0.133kPa)是轻度;蛋白尿≥2g/24h,SBP/DBP≥160/110mmHg是重度。
2 结果
2.1 两组胎盘组织TLRs血清TNF-α、IL-6水平比较 P组胎盘组织TLRs及血清TNF-α、IL-6水平均高于I组(P<0.05),见表1。

表1 两组胎盘组织TLRs及血清TNF-α、IL-6水平比较
2.2 不同严重程度组胎盘组织TLRs及血清TNF-α、IL-6水平比较 重度组胎盘组织TLRs及血清TNF-α、IL-6水平均高于轻度组(P<0.05),见表2。

表2 不同严重程度组胎盘组织TLRs及血清TNF-α、IL-6水平比较
2.3 有、无不良妊娠结局组胎盘组织TLRs及血清TNF-α、IL-6水平比较 有不良妊娠结局组胎盘组织TLRs及血清TNF-α、IL-6水平均高于无不良妊娠结局组(P<0.05),见表3。

表3 有、无不良妊娠结局组胎盘组织TLRs及血清TNF-α、IL-6水平比较
2.4 TLRs与TNF-α、IL-6的相关性分析 TLRs与TNF-α、IL-6均呈正相关性(r=0.406、0.398,P<0.001)。
2.5 血清TNF-α、IL-6对PE患者不良妊娠结局预测效能 血清TNF-α、IL-6联合检测预测PE患者不良妊娠结局的AUC是0.919(95%CI:0.796~0.958),且其灵敏度、特异度均高于单一检测(P<0.05),见表4。
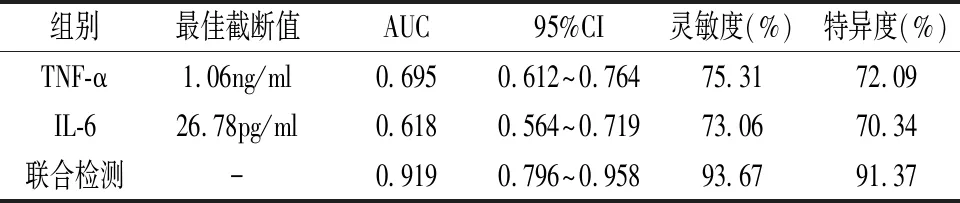
表4 血清TNF-α、IL-6对PE患者不良妊娠结局预测效能
3 讨论
目前,临床认为PE的发生与免疫失衡、内皮细胞损伤、滋养层细胞侵袭与增殖异常、氧化应激反应、炎症反应、营养因素、家族遗传等有着极为密切的联系[10]。PE患者由于滋养层细胞增殖、侵袭异常,会出现不同程度胎盘缺氧、缺血现象,释放大量的炎性因子、氧化应激因子,升高体循环动脉压,增加胎儿宫内生长受限等不良妊娠结局发生率[11-12]。目前,临床对于PE尚无治疗方法,只能通过终止妊娠、娩出胎儿与胎盘,才能保障孕妇生命安全。寻求一种有效、可靠的实验室指标,对PE患者病情作出判断并预测不良妊娠结局发生风险,是目前妇产科工作人员高度关注的内容。
TLRs与母胎免疫耐受联系密切,广泛存在于多种免疫细胞中,在母胎子宫T细胞、NK细胞中均有表达,可通过分泌趋化因子、细胞因子,促进NK细胞、巨噬细胞活化,并在母胎界面募集,对外源性病原微生物起到一定的抵抗作用,在维持母体免疫耐受及妊娠方面具有重要意义[13-14]。TNF-α可促进血管活性物质释放、内皮细胞黏附因子表达,增加血管通透性,引发血管内皮损伤及全身小动脉痉挛,最终导致血压升高[15-16]。IL-6是常见促炎因子,参与了免疫调节过程,在滋养细胞侵袭、胎盘血管形成等多方面均发挥着重要作用[17-18]。本研究结果显示:P组胎盘组织TLRs及血清TNF-α、IL-6水平均高于I组(P<0.05)。由此可见,PE患者机体胎盘组织TLRs及血清TNF-α、IL-6均呈异常高表达。分析如下:PE患者由于胎盘血管形成不足、滋养细胞侵袭异常,引起级联免疫应答,缺氧缺血性改变,刺激机体释放大量血管内皮损伤因子,诱发血管痉挛,促进动脉粥样硬化,从而增加TLRs、TNF-α、IL-6合成、分泌、释放量。血清TNF-α、IL-6表达量增高,会增加血浆纤溶酶原激活物、黏附分子,诱发、加重内皮细胞损伤,引起功能紊乱及全身细小动脉痉挛,刺激血管收缩,增加外周血管阻力,最终导致血压增高[19-20]。
本研究结果显示:重度组胎盘组织TLRs及血清TNF-α、IL-6水平均高于轻度组(P<0.05)。由此可见,病情越重的PE患者,TLRs、TNF-α、IL-6表达量越高,故在产检过程中,临床可通过定期检测血清TNF-α、IL-6变化,评估疾病进展程度,以便临床及早发现异常,及早终止妊娠,改善母婴结局。本研究结果显示:有不良妊娠结局组胎盘组织TLRs及血清TNF-α、IL-6水平均高于无不良妊娠结局组(P<0.05)。由此可见,持续性TLRs、TNF-α、IL-6高表达是诱发不良妊娠结局的重要因素,故一旦发现以上组织、细胞因子居高不下,应高度警惕不良妊娠结局,必要时完善相关检查,重点观测氧化应激反应、胎盘子宫组织学变化等。另外,临床可将抑制血清TNF-α、IL-6表达,作为治疗PE、改善妊娠结局的靶点与方向。本研究结果显示,TLRs与TNF-α、IL-6均呈正相关性(P<0.05)。提示临床可通过检测血清TNF-α、IL-6变化,评估胎盘发育状况、母胎免疫耐受。本研究结果显示,血清TNF-α、IL-6联合检测预测PE患者不良妊娠结局的曲线下面积是0.919,95%CI可信区间是0.796~0.958,灵敏度、特异度均高于单一检测(P<0.05)。由此可见,联合检测血清TNF-α、IL-6在预测不良妊娠结局方面的灵敏度、特异度均较高,且血清学指标检测具有可重复性强、操作简单、价格低廉、创伤性小等优点,在PE患者病情及预后诊断评估中具有广阔的应用前景。
综上所述,胎盘组织TLRs与血清TNF-α、IL-6异常高表达参与了PE疾病进展过程中,与患者病情严重程度、妊娠结局等存在密切联系,联合检测血清TNF-α、IL-6可提高对不良妊娠结局的预测灵敏度、特异度,从而指导临床及早根据个体差异性给予针对性治疗。
