草莓6种病毒多重PCR快速检测方法的建立
2023-11-09许腾飞侯圣凡董振飞赵晓丽王红清
李 素 许腾飞 侯圣凡 董振飞 赵晓丽 李 楠 王红清*
(1.中国农业大学 园艺学院,北京 100193;(2.北京万德园农业科技发展有限公司,北京 102211)
草莓是蔷薇科(Rosaceae)草莓属(Fragaria)的多年生宿根草本植物,其口感多汁,营养丰富,栽培面积广,可鲜食可加工,是一种重要的经济作物[1]。草莓产业在中国发展迅速,根据FAO统计,2020年草莓在中国大陆的种植面积是126 644 hm2,产量是3 326 816 t,种植面积和产量超过世界总量的1/3,稳居世界第一[2]。草莓生产中主要通过母株抽生的匍匐茎获得子苗,母株的病毒可以通过子苗进行扩散,再加上蚜虫和粉虱等传毒介体的大范围活动导致病毒大面积传播,这意味着草莓一旦感染病毒就会导致病毒在田间大肆蔓延。草莓病毒多为复合侵染,感病草莓表现为畸形、矮化、斑驳、皱缩和生长缓慢,甚至全株死亡等症状[3]。优质高产的草莓才具有经济价值和营养价值,而病毒病是导致草莓产量和品质下降的主要因素[4]。
已报道能够侵染草莓的病毒有30多种。常见的有草莓镶脉病毒(strawberry vein banding virus,SVBV)、草莓斑驳病毒(strawberry mottle virus,SMoV)、草莓皱缩病毒(strawberry crinkle virus,SCV)和草莓轻型黄边病毒(strawberry mild yellow edge virus,SMYEV)等,其中SCV在中国的检出率较低[5]。检测技术的升级和栽培地区的扩大导致草莓中不断有新的病毒株系和病毒种类被发现。草莓白化病毒(strawberry pallidosis-associated virus,SPaV)在澳大利亚、欧洲和美洲分布,2017年在中国发现了草莓白化病毒感染[6-8]。草莓病毒1(strawberrry virus 1,StrV-1),也被称为草莓伴随病毒1号(strawberry-associated virus 1,SaV1),是自2019年以来在捷克共和国和中国报道的一种感染草莓的新病毒[9-11]。2022年芸薹黄化病毒(brassica yellows virus,BrYV)感染草莓首先在中国被报道,其分布和对草莓的影响有待进一步研究[12]。
病毒检测是病毒病防治和脱毒苗生产的重要环节,目前没有有效方法可以治愈病毒病,田间植株一旦感染病毒将终生带毒且无法脱除,因此病毒检测对草莓产业的可持续发展有重要作用。草莓病毒病检测方法包括指示植物检测法、电镜检测法、血清学检测法和分子生物学检测法。PCR技术具有灵敏、特异和简单等优点,是生产中应用最为广泛的草莓病毒检测技术[13]。单重PCR一次只能针对一种病毒进行特异性检测,当需要进行多种病毒检测时,使用单重PCR试验耗时过长且耗材过多,因此建立能够同时检测多种病毒的多重PCR检测方法具有重要意义。
多重PCR是在一个PCR中加入多对引物,对多个模板进行扩增,从而实现同时检测多种病毒。多重PCR比单重PCR更高效经济。由于引物之间的相互配对、竞争性扩增以及不同模板的最适扩增条件不同,建立一套稳定的多重PCR反应体系较困难,需要对特异性引物、反应体系和反应条件等进行筛选优化。多重PCR并不是单重PCR的简单混合,引物设计是决定多重扩增效果的关键因素,并且多重条带大小之间需要存在差异以便电泳区分[14]。本研究根据病毒的基因保守区域设计引物并调整引物比例,首次建立了一种能够同时检测SVBV、SMoV、SMYEV、SPaV、StrV-1和BrYV的多重PCR方法,为草莓的田间病毒检测和脱毒苗诊断提供了一种快速经济的分子生物学方法。
1 材料与方法
1.1 试验材料
本研究所用的草莓植株来自中国农业大学上庄试验站,包括‘红颜’‘章姬’‘哈尼’‘全明星’等品种。2022年3—5月期间,采摘100株有病症的幼嫩草莓叶片由冰盒保存运输至实验室,将叶片进行液氮冷冻处理后放在-80 ℃冰箱保存备用。
1.2 试验方法
1.2.1总RNA提取
草莓叶片总RNA提取采用OMEGA的E.Z.N.A.®Plant RNA Kit(Omega Bio-tek,Georgia,USA),并参照说明书进行。
1.2.2反转录
采用M-MLV反转录酶(Takara,China)合成cDNA。反应体系为:RNA 2 μL,5×M-MLV buffer(Promega)4 μL,dNTP Mix(2.5 mmol)1 μL,随机引物(10 μmol)0.5 μL,Oligo(dT)18引物(10 μmol)0.5 μL,M-MLV Reverse transcriptase和RNase inhibitor 各0.5 μL,使用RNase free water补足体系至20 μL;充分混匀后,瞬时离心,37 ℃孵育1 h后置于-20 ℃冰箱保存备用。
1.2.3引物设计与合成
根据NCBI中SVBV(GenBank Accession No.FM867860.1)、SMoV(GenBank Accession No.AJ311876.1)、SMYEV(GenBank Accession No.D12517.1)、SPaV(GenBank Accession No.MN747002.1)、StrV-1(GenBank Accession No.MW795715)和BrYV(GenBank Accession No.ON060762)的基因组序列,将保守区域通过Primer Premier 6.0进行引物设计(表1)。引物长度在18~25 bp,GC含量在40%~60%。引物由擎科生物有限公司合成。
1.2.4单重PCR检测
对于单重PCR,每种病毒都建立了20 μL的反应体系,包括:2×SanTaq PCR Master Mix(Sangon Biotech,China)10 μL,正向引物1 μL(10 μmol/L),反向引物1 μL(10 μmol/L),模板1 μL(10 ng/μL),ddH2O 7 μL。对于多重PCR,20 μL的反应混合物中包括:2×SanTaq PCR Master Mix 10 μL,引物混合物4 μL(10 μmol/L),其中上下游引物各包括SVBV 0.25 μL、SMoV 0.50 μL、SMYEV 0.10 μL、SPaV 0.15 μL、StrV-1 0.50 μL、BrYV 0.50 μL,模板1 μL(10 ng/μL),ddH2O为5 μL。
PCR仪(BIO-RAD,T100,USA)的程序设定为:94 ℃预变性5 min,94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸120 s,最后72 ℃延伸10 min,循环数为35。反应结束后放在4 ℃冰箱保存。
取3 μL PCR产物进行电泳,检测扩增结果。其中琼脂糖凝胶浓度为2%,加入1/20 000体积的核酸染色剂Gelred(Tsingke,China),电泳缓冲液为1×TAE缓冲液。电泳电压设置为120 V,电泳时间为50 min,最后通过凝胶图像分析仪器(YPH-BIO,Tanon 1600,China)拍照成像。
1.2.5多重PCR引物浓度的优化
对于多重PCR,20 μL的反应体系包括2×SanTaq PCR Master Mix 10 μL,6种病毒的重组质粒各1 μL(10 ng/μL),正向引物(10 μmol/L)和反向引物(10 μmol/L)添加量参照表2计算,以进行多重PCR引物浓度的优化,PCR程序与单重PCR一致。引物添加量计算公式如下:
表2 病毒多重PCR的不同引物浓度组合
引物添加量(μL)=C1×V/C2
(1)
式中:C1为引物终浓度,μmol/μL;V为反应总体积,为20 μL;C2为引物初始浓度,为10 μmol/μL。
1.2.6多重PCR反应条件的优化
在单重PCR程序的基础上,设置了不同的退火时间(30、35、40和45 s)、延伸时间(75、90、105、120、135和150 s)、退火温度(50、53、55、58和60 ℃)和延伸温度(68、70和72 ℃)进行多重PCR反应条件的优化。
1.2.7多重PCR灵敏度检测
将6种病毒的重组质粒(10 ng/μL)通过双蒸水10倍梯度系列稀释为101~10-4ng/μL,等体积混合后用于多重PCR的灵敏度检测。计算公式如下:
灵敏度(copies/μL)=L×(C×10-9)/MW
(2)
式中:L为阿伏伽德罗常数;C为质粒质量浓度,ng/μL;MW为平均分子量,g/mol。
1.2.8PCR产物的克隆和序列分析
6种病毒经过单重PCR扩增后,经1%的琼脂糖电泳检测,纯化回收(Tsingke,China)后连接到pMD18-T(Takara,China)载体上;转化大肠杆菌DH5α(Biomed,China),挑取阳性克隆进行PCR检测,将含有目的片段的大肠杆菌送擎科生物有限公司测序;通过NCBI核苷酸数据库的BLAST搜索(https:∥blast.ncbi.nlm.nih.go-v/Blast.cgi)验证这些序列,将测序结果正确的大肠杆菌进行质粒提取(Tsingke,China)。
1.2.9多重PCR的田间样品检测
从已知感病情况的田间草莓中选取单一或者混合感染的12株样品,通过上述的多重PCR方法进行检测。
2 结果与分析
2.1 引物特异性扩增
为了检验引物的特异性,对每对引物都进行了单重PCR检测。从6株感染单一病毒的草莓植株中获得了预期大小的特异性扩增产物,其中SVBV为278 bp,SMoV为394 bp,SPaV为517 bp,BrYV为609 bp,SMYEV为861 bp,StrV-1为1 162 bp;从6株健康草莓植株中未获得扩增产物(图1)。上述PCR产物均通过了测序验证,表明表1中的引物符合多重PCR的检测规则。
M:D2000 DNA marker;泳道1~6:感病草莓植株的SVBV、SMoV、SPaV、BrYV、SMYEV和StrV-1引物特异性扩增;泳道7~12:健康草莓植株的SVBV、SMoV、SPaV、BrYV、SMYEV和StrV-1引物特异性扩增。
2.2 多重PCR引物浓度优化
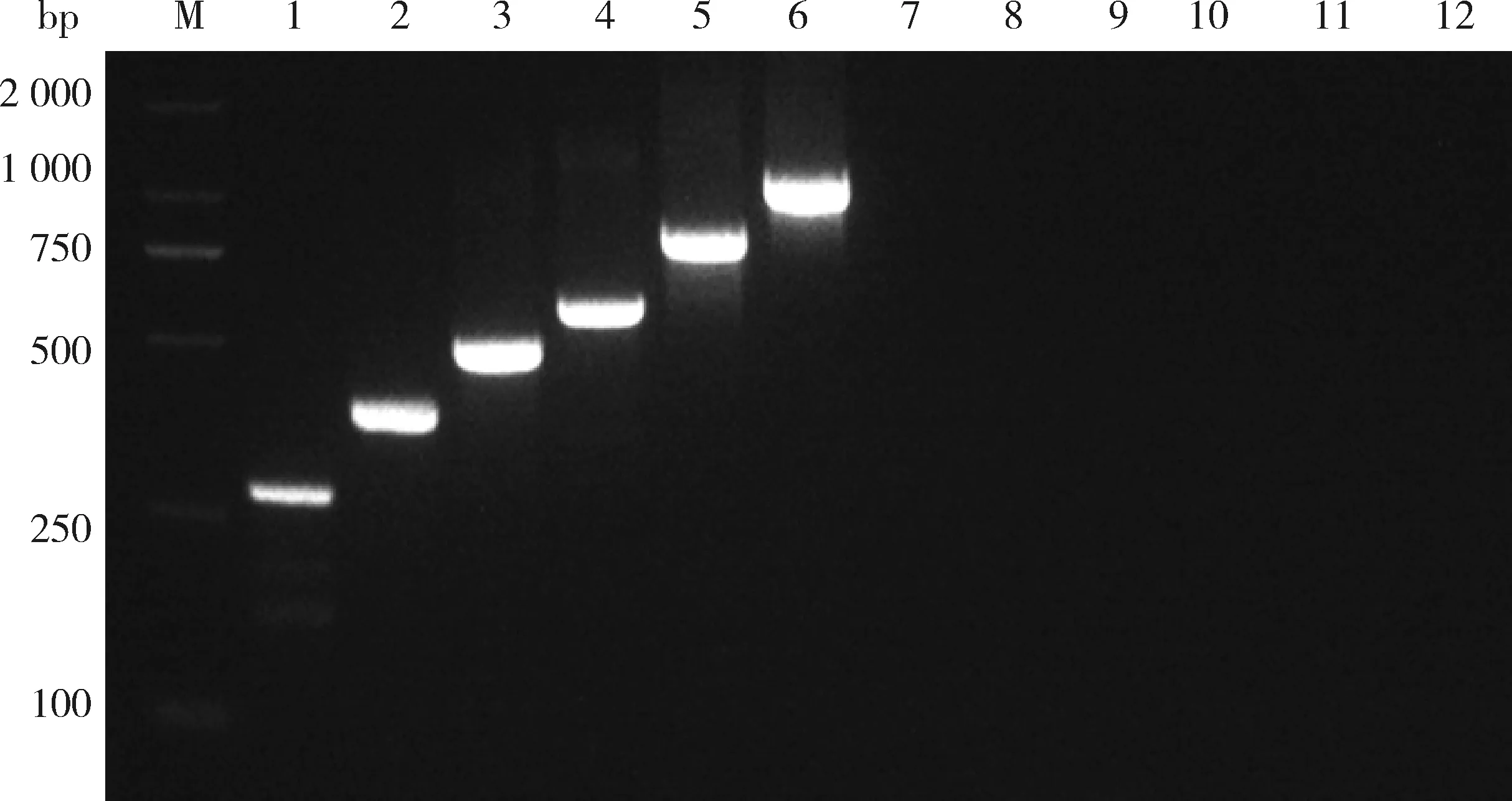
相较于其它引物组合,组合4中当上下游引物终浓度SVBV为0.125 μmol/L、SMoV为0.250 μmol/L、SMYEV为0.050 μmol/L、SPaV为0.075 μmol/L、StrV-1为0.250 μmol/L和BrYV为0.250 μmol/L时,6种病毒实现了同步扩增,扩增条带清晰明亮(图2)。因此选择组合4的反应体系进行后续多重PCR条件的优化。
M:D2000 DNA marker;泳道1~8:不同引物浓度组合的扩增结果;泳道9:健康样品。
2.3 多重PCR条件的优化
2.3.1退火时间
在多重PCR反应中设计了不同的退火时间(30、35、40和45 s),结果表明6种病毒都能扩增得到单一明亮的条带,扩增效果差异不大。从节省时间考虑,退火时间采用30 s(图3)。
M:D2000 DNA marker;泳道1~4:退火时间分别为30、35、40和45 s;泳道5:健康样品。
2.3.2延伸时间
在退火时间采用30 s的基础上,设计了不同的延伸时间(75、90、105、120、135和150 s),在这些延伸时间内,6种病毒都能良好扩增,其中延伸时间为120 s的条带亮度最好,扩增效果最佳(图4)。

M:D2000 DNA marker;泳道1~6:延伸时间分别为75、90、105、120、135和150 s;泳道7:健康样品。
2.3.3退火温度
在退火和延伸时间确定的前提下,本研究设计了一系列的退火温度(50、53、55、58和60 ℃)。当温度在50~58 ℃时,6种病毒都能特异性扩增。但是退火温度在50 ℃时StrV-1条带微弱,在58 ℃时SVBV和SMoV条带微弱,其中53 ℃和55 ℃时6种病毒的扩增效果都较好。从引物与模板结合的稳定性考虑,退火温度采用53 ℃(图5)。
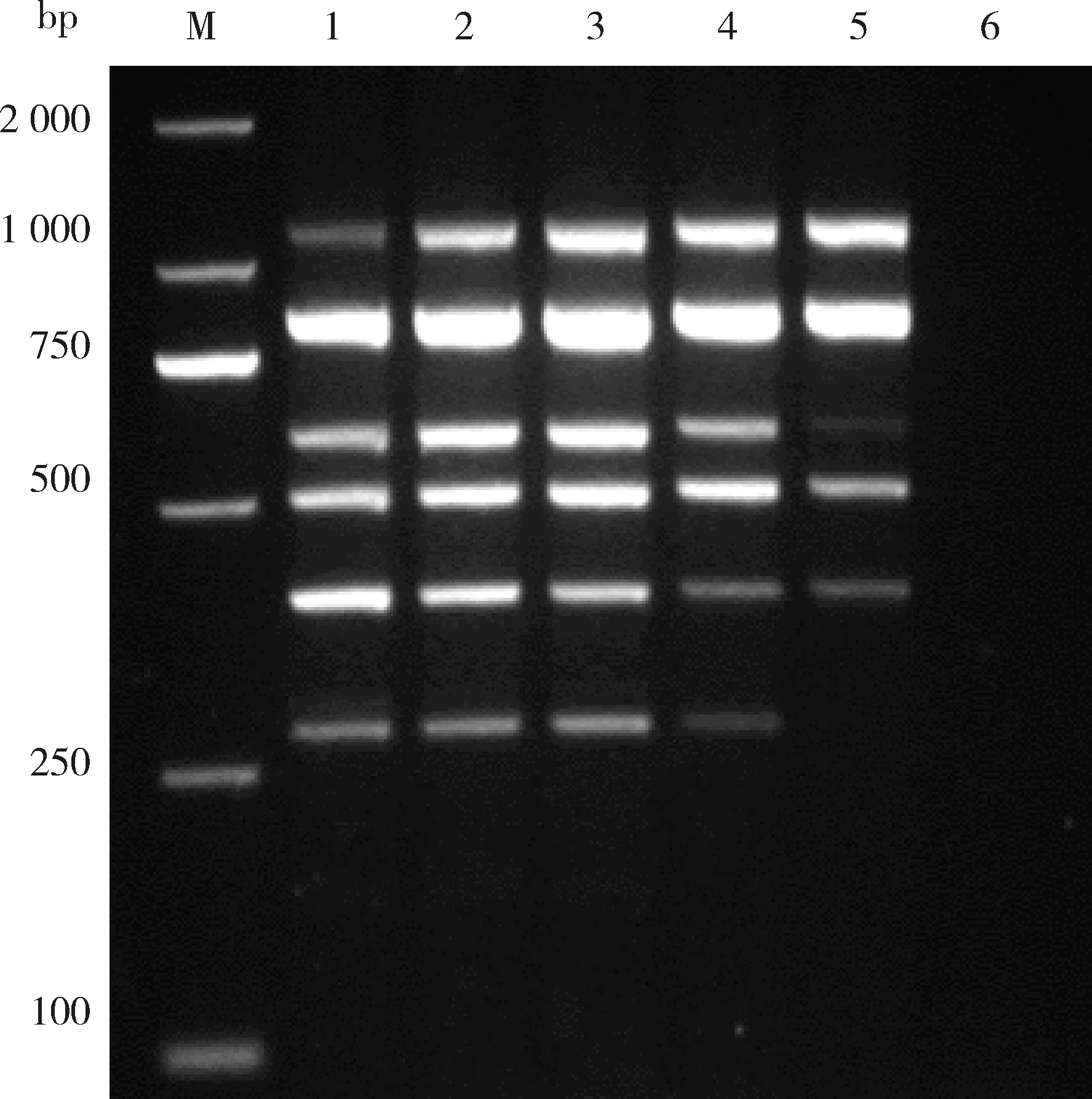
M:D2000 DNA marker;泳道1~5:退火温度分别为50、53、55、58和60 ℃;泳道6:健康样品。
2.3.4延伸温度
在上述研究基础上,设计了一系列的延伸温度梯度(68、70和72 ℃),在这个延伸温度范围内6种病毒都能扩增得到单一明亮的条带,扩增效果差异不大。从Taq酶的活性考虑,最终延伸温度采用72 ℃(图6)。

M:D2000 DNA marker;泳道1~3:延伸温度分别为68、70和72 ℃;泳道4:健康样品。
2.4 多重PCR的检测灵敏度
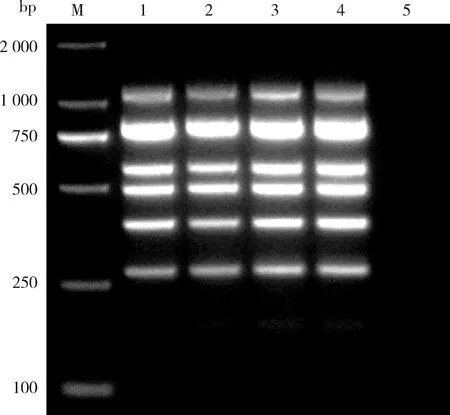
当重组质粒稀释至10-1ng/μL时,6种病毒仍能扩增出清晰明亮的条带(图7)。通过体系中各病毒模板的终浓度和对应的碱基数计算得出各病毒的最低检出拷贝数,SVBV为5.47×107copies/μL,SMoV为7.49×107copies/μL,SMYEV为3.42×107copies/μL,SPaV为5.71×107copies/μL,StrV-1为2.54×107copies/μL,BrYV为4.85×107copies/μL。因此该六重PCR的检测下限约为107copies/μL。

M:D2000 DNA marker;泳道1~6:病毒质粒分别为101~10-4 ng/μL;泳道7:健康样品。
2.5 多重PCR检测田间样本
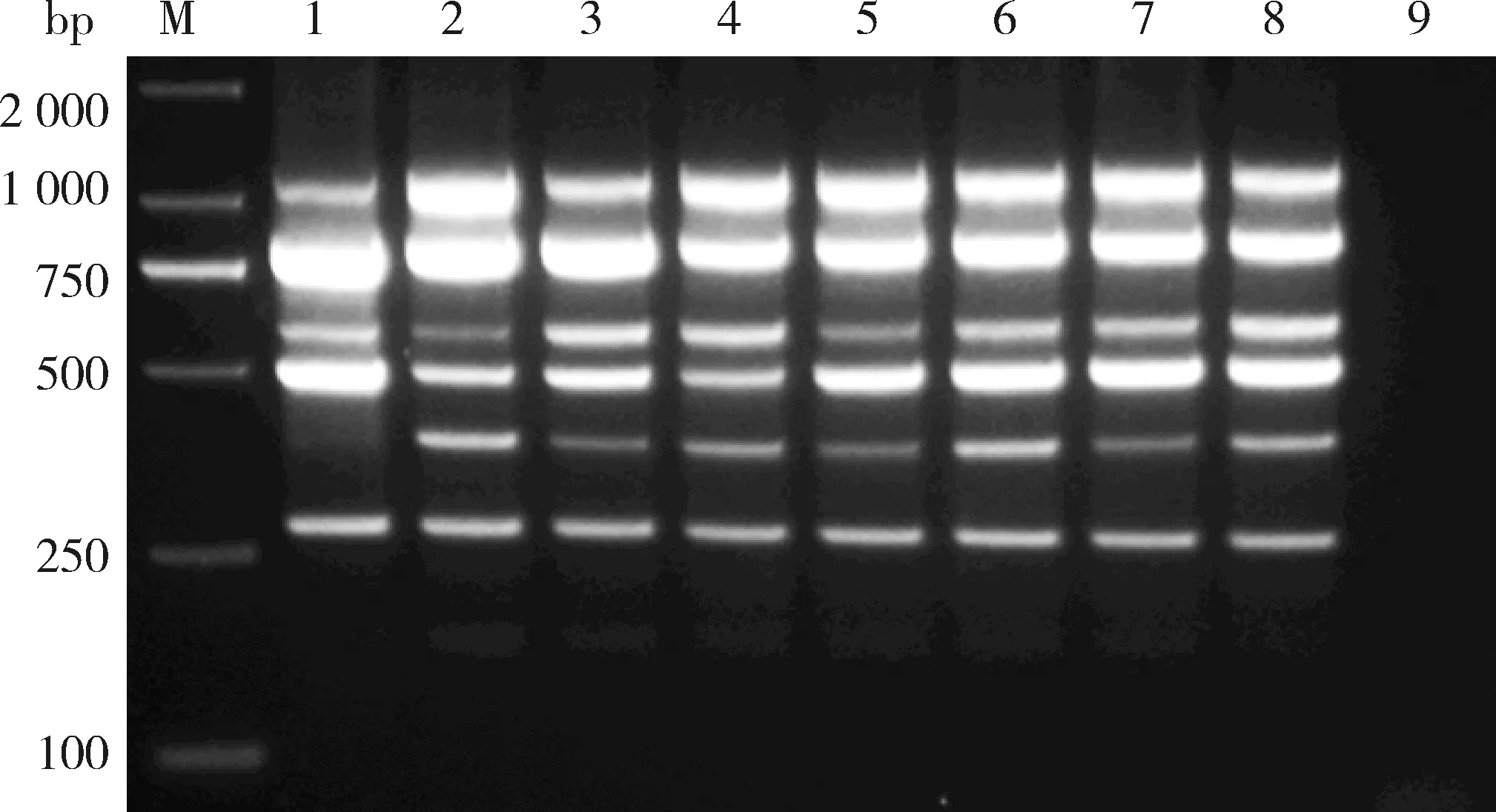
为验证多重PCR的可靠性和有效性,对已知感病情况的12株草莓植株进行病毒检测。不论是单一病毒侵染还是复合侵染,该反应体系均可以检测出相应病毒,并且病毒特异性扩增效果显著(图8),也证实了该多重PCR快速检测方法的实用性。
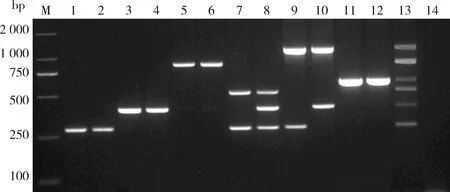
M:D2000 DNA marker;泳道1~2:感染SVBV的草莓样品;泳道3~4:感染SMoV的草莓样品;泳道5~6:感染SMYEV的草莓样品;泳道7:感染SVBV和SPaV的草莓样品;泳道8:感染SVBV、SMoV和SPaV的草莓样品;泳道9:感染SVBV和StrV-1的草莓样品;泳道10:感染SMoV和StrV-1的草莓样品;泳道11~12:感染BrYV的草莓样品;泳道13:阳性对照;泳道14:阴性对照。
3 讨论与结论
在草莓长期的营养繁殖中,病毒会通过匍匐茎和介体昆虫传播扩散,导致草莓病毒病发生越来越严重。SVBV、SMoV和SMYEV是世界高发的3种草莓病毒,SPaV、StrV-1和BrYV是中国近几年新出现的草莓病毒,对SPaV、StrV-1和BrYV的分布区域有待进一步的检测。
单一病毒侵染在多数草莓品种中没有明显症状,但是病毒复合侵染会引起严重的症状,造成巨大的经济损失[15]。仅仅根据症状难以区分病毒种类,快速、可靠且低成本的多重PCR检测方法在病毒鉴定上具有重要的应用价值。朱海生等[16]成功建立了4种草莓病毒的多重PCR体系,最终引物比例为SVBV∶SMoV∶SMYEV∶SCV=5∶7∶3∶5;韩晓玉等[17]成功建立了5种草莓病毒的多重PCR体系,引物比例为SVBV、SMoV、SMYEV、SPaV和SNSV等量混合。参考前人的研究结果,本研究首次在检测SVBV、SMoV、SMYEV和SPaV的同时实现了StrV-1和BrYV这2种新病毒的检测,目前还没有报道同时检测6种草莓病毒的多重PCR方法。本研究建立的多重PCR方法能够同时检测高发的草莓病毒和新出现的草莓病毒,提高了病毒检测的全面性。
在多重PCR的建立过程中,引物组合和比例对于实现PCR模板的同步扩增具有决定性作用[18-22]。本研究在朱海生等[16]和何成勇等[23]的基础上,针对SVBV、SMoV、SMYEV、SPaV、StrV-1和BrYV设计了多对引物,并进行了筛选。首先将所有引物组合中的引物浓度都设定为0.125 μmol/L,PCR扩增程序与单重PCR一致,筛选出了能同时检测6种病毒的引物组合。当6种引物浓度均为0.125 μmol/L时,SVBV条带清晰,SMYEV条带最宽最亮,SPaV条带很亮,而SMoV、BrYV和StrV-1条带微弱。通过增加SMoV、BrYV和StrV-1的引物量,减少SMYEV和SPaV的引物量,寻找合适的引物比例,最终选择引物比例为SVBV∶SMoV∶SMYEV∶SPaV∶BrYV∶StrV-1=5∶10∶2∶3∶10∶10。
在多重PCR中,优化退火温度、退火时间、延伸温度和延伸时间可以减弱引物之间的相互干扰[24-25]。本研究中退火时间(30~45 s)和延伸温度(68~72 ℃)对多重反应的影响不大,退火温度(50~60 ℃)和延伸时间(75~120 s)对于所建立的反应体系至关重要。退火温度太高会导致某些病毒扩增失败,推测与引物的退火温度、引物与模板结合的稳定性等有关[26]。延伸时间过短或过长都不利于6种病毒的同步扩增,过短会降低产物量,过长会增加非特异扩增的概率。
本研究建立的多重PCR可以在一个反应中鉴定SVBV、SMoV、SMYEV、SPaV、StrV-1和BrYV,节省了检测成本和时间。该方法为进一步明确草莓病毒的发生分布奠定了基础,具有广阔的应用前景。
