ICP-MS测定氟比洛芬酯注射液中多种无机元素杂质含量
2023-11-07张连义郭常川李文馨杨书娟窦艳丽徐玉文
张连义,郭常川,陈 真,李文馨,杨书娟,窦艳丽,王 雪,李 琳,徐玉文
(山东省食品药品检验研究院 国家药品监督管理局仿制药研究与评价重点实验室 山东省仿制药一致性评价工程技术研究中心,山东 济南 250101)
氟比洛芬酯注射液是一种非甾体类抗炎药(NSAIDS)[1],用于治疗术后疼痛和癌痛[2]。其成分较复杂,含有大豆油(供注射用)、甘油(供注射用)、蛋黄卵磷脂等。
因药品中可能含有的元素杂质不能提供任何治疗效果,所以杂质含量需被控制在可接受的限度范围内。元素杂质的来源有在合成中添加的催化剂残留,也可能是通过与生产设备或容器密闭系统相互作用产生或存在于药品的各个组分中[3-4]。按照药品的给药途径及其与包装材料发生相互作用的可能性分级,注射剂等制剂被列为可能与包装材料发生相互作用的高风险制剂。
原国家食品药品监督管理总局发布的《药用玻璃砷、锑、铅、镉浸出量限度》(YBB00172005-2015)[5]和《砷、锑、铅、镉浸出量测定法》(YBB00372004-2015)[6]规定检测和评价的对象只有砷(As)、锑(Sb)、铅(Pb)和镉(Cd)等4种元素,其中As、Sb浸出量采用紫外分光光度法,Pb、Cd元素浸出量采用原子吸收分光光度法,方法中需化学反应、萃取等前处理步骤,且灵敏度低,不能同时测定多种元素。电感耦合等离子体质谱法(ICP-MS)具有检测限低,动态线性范围宽,分析速度快,可同时测定多种元素等优点[7]。有文献报道中采用ICP-MS法测定药用玻璃容器中金属元素的浸出量[8],只考虑浸出量,未检测药液在长期存放过程中迁移情况。有文献采用ICP-MS测定脂肪乳注射液及包材中元素含量[9],需对样品消化处理,前处理步骤繁琐、耗时长。有文献方法学验证中准确度回收率偏低,且精密度不足[10]。本文参考《中国药典》(2020年版)附录通则9621药包材通用技术指导原则和ICH指导原则Q3D(R2)元素杂质指导原则[11],采用ICPMS,并经方法学验证,建立氟比洛芬酯注射液中的金属元素杂质测定的有效方法,对类似组成的注射剂同样具有参考价值。
1 仪器与试剂
1.1 仪器
PE NexLON2000电感耦合等离子体发射质谱仪(珀金埃尔默),CP225D型十万分之一电子天平(梅特勒公司),Q-POD ElementMilli-Q超纯水机(默克密理博)。
1.2 试剂
超纯水(自制),优级纯硝酸(江苏晶瑞),无水乙醇(天津康科德)。
1.3 元素对照品
元素标准溶液:镉(Cd,M2-CD659870)、铅(Pb,M2-PB655591)、砷(As,K2-AS654224)、汞(H g,M 2-H G 6 5 9 9 2)、钴(C o,K 2-CO02072)、钒(V,K2-V02108)、镍(Ni,M2-NI660480)、锑(Sb,K2-SB650297)、锗(Ge,K2-GE01122AA)、铟(In,K2-IN01118)、铋(Bi,N2-BI666938),购于美国Inorganic Ventures公司;锂(Li,184047-2)、铜(Cu,185025-3),购于国家有色金属及电子材料分析测试中心;金(Au,166660-73),购于上海安谱科技股份有限公司;以上元素标准溶液浓度均为1000 μg/ml。
1.4 试验样品
取2022年国家药品抽检样品,a企业41批、b企业32批,共计73批,中硼硅玻璃安瓿瓶。
2 方法与结果
2.1 仪器参数
ICP-MS工作参数见表1。

表1 ICP-MS工作参数
2.2 测定方法
采用内标法,待测元素同位素选择分别为111Cd、208Pb、75As、202Hg、59Co、51V、60Ni、7Li、121Sb、63Cu,其中111Cd、121Sb以115In为内标元素,202Hg、208Pb以209Bi元素为内标元素,其他元素以74Ge为内标元素。Au起稳定Hg元素的作用,不做测定。分别依次测定标准曲线及样品空白溶液、供试品溶液,采用标准曲线法计算各元素的浸出量。
2.3 溶液制备
混合对照储备溶液的制备:分别精密量取Cd、Pb、As、Hg、Co、V、Ni、Li、Sb和Cu元素标准溶液适量,用1 %硝酸溶液稀释制成每1 ml分别含有Cd 0.068 μg,Pb 0.2 μg,As 0.6 μg,Hg 0.12 μg,Co 0.2 μg,V 0.4 μg,Ni 0.8 μg,Li 4 μg,Sb 3.6 μg,Cu 4 μg的混合储备溶液,摇匀,即得。
Au元素储备溶液的制备:精密量取Au元素标准溶液适量,用1 %硝酸溶液稀释制成每1 ml中含Au 12 μg的溶液,摇匀,即得。
元素标准曲线溶液的制备:分别精密量取混合对照储备溶液125,250,500,750,1000 μl,置入50 ml量瓶,分别加入Au元素储备溶液0.5 ml,用1 %硝酸溶液稀释定容至刻度,摇匀,即得。各元素标准曲线浓度见表2。

表2 各元素杂质的标准曲线浓度/μg·L-1
内标溶液的制备:分别精密量取Ge、In、Bi元素标准溶液适量,用1 %硝酸溶液稀释制成含Ge、In、Bi元素各80 μg/L的混合内标溶液。
供试品溶液制备:精密量取本品0.1 ml,精密加入无水乙醇10 ml,精密加入Au元素储备溶液0.5 ml,用1 %硝酸溶液稀释并定容至50 ml聚四氟乙烯量瓶,摇匀。同法制备空白溶液。
2.4 方法学验证
2.4.1 线性关系 以分析元素的响应值与内标元素响应值的比值为纵坐标,其对应浓度为横坐标,绘制标准曲线,计算回归方程。结果表明在相应浓度范围内线性关系良好,线性相关系数r>0.999。结果见表3。
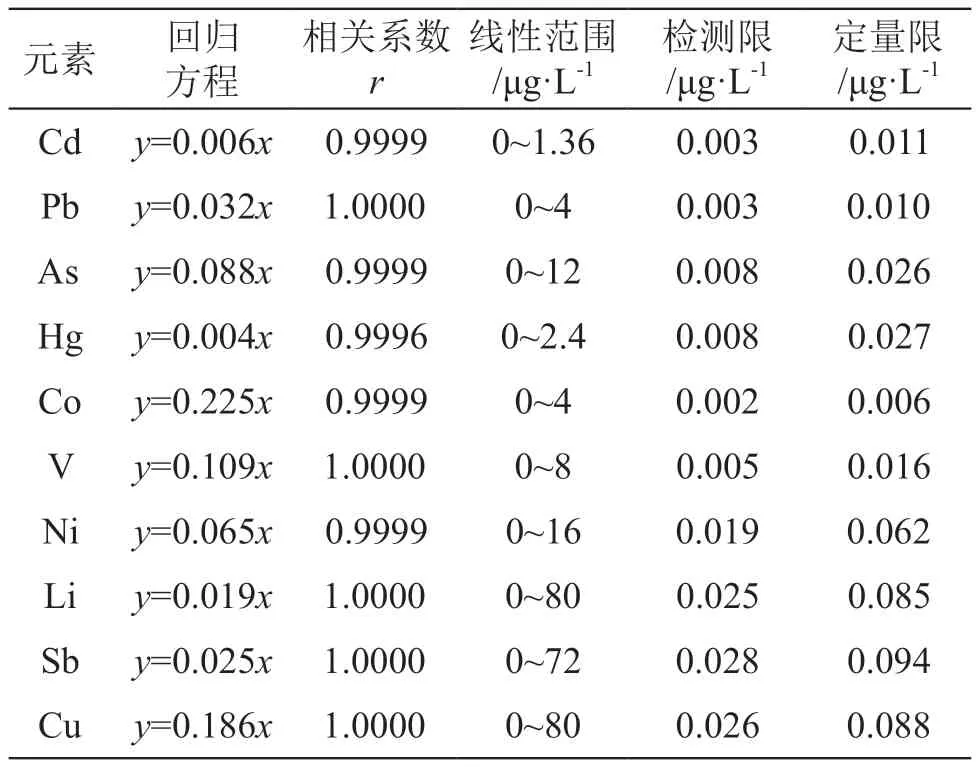
表3 线性试验结果及检测限、定量限
2.4.2 检测限、定量限 连续测定空白溶液11次,取3倍的标准偏差对应浓度值作为检出限;取10倍的标准偏差对应浓度值作为定量限。结果见表3。
2.4.3 精密度 取标准曲线S3溶液作为系统精密度溶液,连续测定6次,计算相对标准偏差(RSD)值。结果表明,RSD≤4.2 %,方法精密度良好。结果见表4。
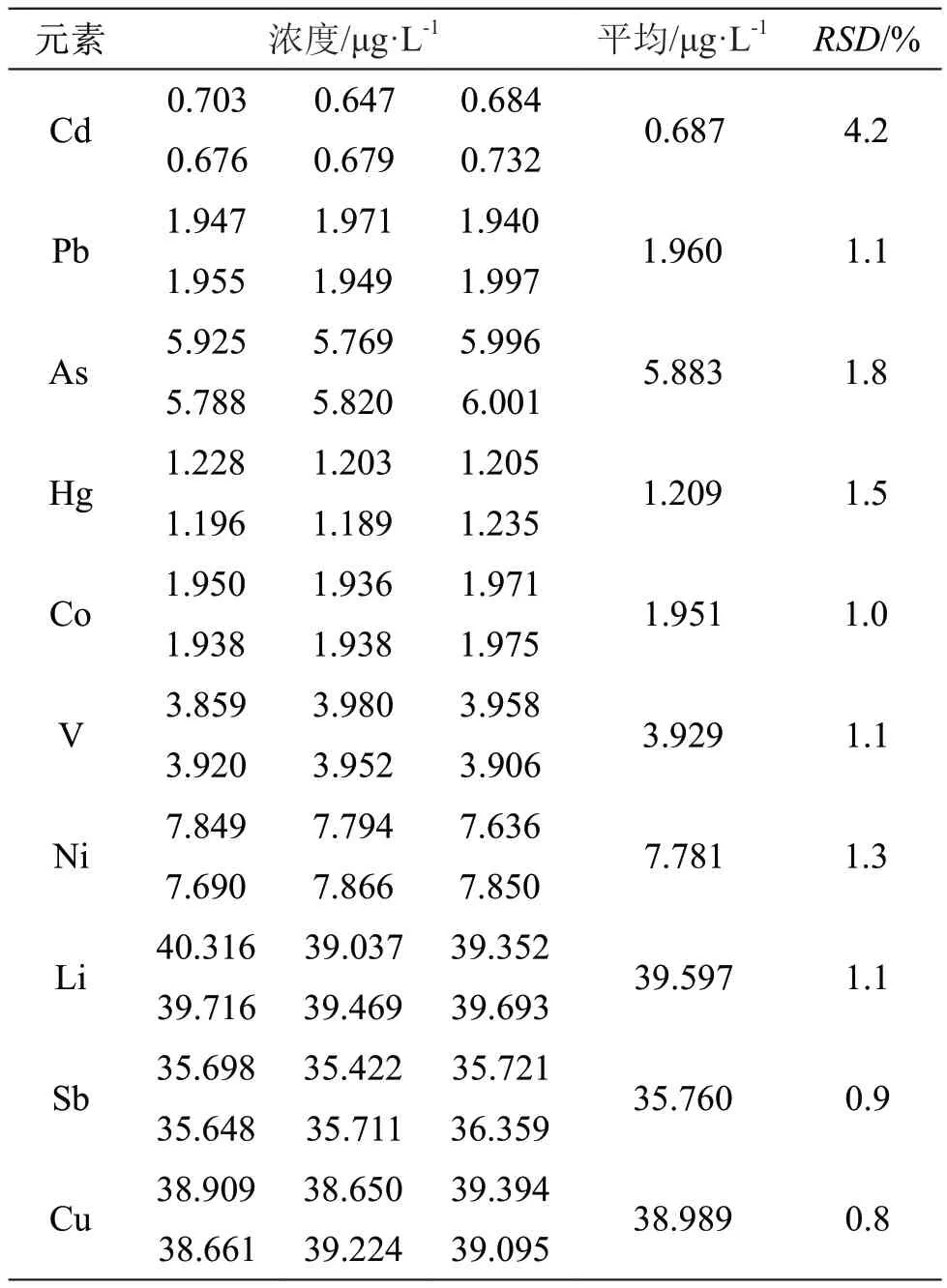
表4 精密度试验数据
2.4.4 重复性试验和准确度 精密量取本品0.1 ml,精密加入无水乙醇10 ml,精密加入Au元素储备溶液0.5 ml,混合对照储备溶液0.5 ml,用1 %硝酸溶液稀释并定容至50 ml聚四氟乙烯容量瓶中,摇匀;同法制备6份,计算回收率RSD值。各元素6份样品回收率RSD≤5.5 %,平均回收率范围在94.39 %~107.82 %,表明方法重复性和回收率结果良好。结果见表5。

表5 重复性试验和准确度试验结果
2.5 样品测定
取73批样品,按2.3项下制备供试品溶液,进样测定,计算供试品溶液中元素杂质含量。各待测元素的检测量若小于检出限,视为未检出。a企业和b企业样品中均未检出Cd、Hg、Li、Sb和Cu 5种元素,占总待测元素的50 %;检出Pb、As、Co、Ni和V 5种元素,Ni检出量较大,其次是As、Pb、V和Co。各元素杂质检测结果统计分析箱线图见图1。

图1 元素杂质检测结果统计分析箱线图
2.6 检出元素分析
2.6.1 1类元素检出分析 Pb、As两种元素检出,检出量分布图见图2。a企业有5批次样品检出Pb,检出量分布在两家企业的Pb检出量均值均为9.3 μg /L,但b企业离散度更低,批次间Pb检出量差异较小,而a企业批次间Pb检出量波动较大。a企业有23批次检出As,占a企业样品的56 %,检出量分布较为均匀,以18.5 μg /L为中心呈正态分布;b企业有31批次检出As,占b企业样品的97 %,仅有1批未检出。检出量分布较为集中,30批均在15 μg/L以内。由检出批次可见,b企业As检出量均值、25 %~75 %分位数、1.5IQR范围均明显低于a企业,表明b企业对样品中As的控制优于a企业。

图2 样品中1类元素Pb、As检出量分布图
2.6.2 2A类元素检出分析 Co、V、Ni均检出,检出量分布图见图3。a企业Co元素检出25批次,占a企业样品的61 %,检出量较低,多数分布在0.6~1.2 μg/L之内;b企业仅有5批次检出Co元素,检出量分布在0.5~3.5 μg/L之间。两家企业Co元素检出量的均值、25 %~75 %分位数相差不大,但a企业Co元素检出批次数远多于b企业。
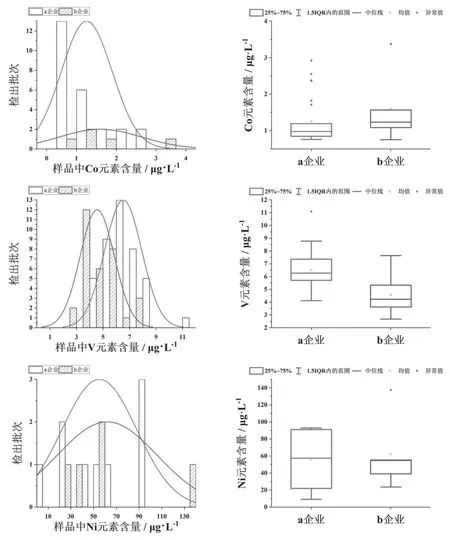
图3 样品中2A类元素Co、V、Ni检出量分布图
a企业所有批次样品中均有V元素检出,检出量分布较均匀,以6.5 μg/L为中心呈正态分布;b企业所有批次样品中均有V元素检出,检出量分布也比较均匀,以4.6 μg/L为中心呈正态分布。a企业V元素检出量的均值、中位数均明显高于b企业,表明b企业对V元素杂质的控制优于a企业。
a企业Ni元素检出9批次,占a企业样品的22 %,检出量差异很大,最小值为9.054 μg/L,最大值高达92.891 μg/L;b企业Ni元素检出5批次,占b企业样品的16 %,检出量分布波动很大,有4批次样品Ni检出量在20~60 μg/L范围内,但有一批异常值高达137.451 μg/L。两家企业对Ni元素的控制均不理想,既有大批量样品未检出,又有个别样品检出量高于100 μg/L,批次间波动巨大。
2.6.3 检出最大值与分析评价阈值(AET)比较 根据指导原则中注射途径每日允许暴露量(permitted daily exposure,PDE),计算得到各待测元素的分析评价阈值(analytical evaluation threshold,AET)。根据人每日允许最大暴露量或安全性阈值/限定阈值、用药剂量和制剂包装特点等,计算每个包装容器中特定的可提取物和/或浸出物含量。计算公式:AET=PDE/日用最大剂量,本品日用最大剂量为5 ml(即0.005 L)。
取各元素的检出量的最大值与AET值比较,结果见表6。两家企业各元素杂质检出量最大值均远低于AET阈值,表明a企业和b企业生产的氟比洛芬酯注射液中元素杂质的含量符合指导原则的要求。

表6 待测元素及其限度值及检出量最大值汇总表
3 讨论
3.1 待测元素选择
参考ICH Q3D(R2)元素杂质控制指南,确定需考虑的10种无机元素为Cd、Pb、As、Hg、Co、V、Ni、Li、Sb、Cu。其中,Cd、Pb、As、Hg属于1类元素杂质,为人体毒素,在药品生产中应禁用或限制使用;Co、V、Ni属于2A类元素杂质,是给药途径依赖型的人体毒素,出现在药品中的相对可能性较高;Sb、Li、Cu属于3类元素杂质,此类元素口服给药途径的毒性相对较低,但在吸入和注射给药途径中的风险评估中仍需考虑。
3.2 质谱条件优化
为消除或减少质谱干扰,使用调谐液对仪器进行调谐,优化仪器RF功率、气体流速,降低氧化物离子干扰和双电荷离子干扰。选择合适的同位素进行测定,以丰度大、灵敏度高、同量异位素和多原子分子离子干扰少为选择原则,试验中元素同位素选择分别为7Li、51V、59Co、60Ni、63Cu、74Ge、75As、111Cd、115In、121Sb、202Hg、208Pb、209Bi。
3.3 基体效应消除
本试验采用内标法消除基体效应。由于待测元素质量数范围较宽,因此选择了多个内标元素,按照内标同位质量数与待测元素质量数相近的原则,111Cd、121Sb以115In为内标元素,202Hg、208Pb以209Bi元素为内标元素,其他元素以74Ge为内标元素。用内标法定量,补偿了基体效应,并能有效地校正分析信号的漂移,保证测量的准确性。
4 结论
本文根据ICH指导原则Q3D(R2),研究确定了氟比洛芬酯注射液中需要进行控制的无机元素杂质种类。采用ICP-MS法,建立内标校正的标准曲线,并进行方法学验证,检测样品中无机元素杂质含量,用以评价国家药品抽检样品。对比两家企业中检出无机元素杂质含量,对企业在生产工艺、原辅料控制、包材选择中提供一定的参考意义。
本文对氟比洛芬酯注射液中无机元素含量进行了检测,但未对长期试验、加速试验、影响因素试验条件下制剂中元素含量情况进行测定,以考察中硼硅玻璃安瓿瓶中元素杂质的迁移情况,这在未来工作中做进一步研究。
