CircBACH1调节miR-140-5p/MDM2轴对多发性骨髓瘤细胞增殖、凋亡和化疗敏感性的影响
2023-11-07刘荟敏许旋旋王远丽熊涛唐元艳
刘荟敏,许旋旋,王远丽,熊涛,唐元艳
多发性骨髓瘤(MM)是一种血液系统恶性肿瘤,其特征是肿瘤性浆细胞的异常增殖和积累[1]。目前蛋白酶体抑制剂如硼替佐米已被广泛用于MM 治疗,虽显著提高了MM患者的生存率,但由于耐药性及初始治疗后复发率较高,该病仍无法治愈[2-3]。研究MM 的耐药机制和寻找新的治疗靶点对改善MM化疗敏感性具有重要意义。环状RNA BTB 域名和CNC同系物1(CircBACH1)可作为miR-656-3p的海绵,提高纤溶酶原激活物抑制剂1 RNA 结合蛋白1表达,加速肝癌进展[4],但其在MM 中的作用还未知。许多miRNA 的异常表达与MM 的发展有关,如miR-140-5p 在MM 中表达下调,上调miR-140-5p可通过靶向血管内皮生长因子A 抑制MM 细胞增殖,其也可以通过被Linc00515靶向上调抑制MM细胞的自噬和化学耐药性[5-6]。鼠双微体2(MDM2)是一种E3泛素连接酶,与白血病和淋巴瘤等血液系统恶性肿瘤的放化疗耐药相关,在MM中过表达,可增强MM 细胞的增殖和存活能力[7]。研究显示,miR-140-3p 可以通过调节KLF5/N-cadherin/MDM2/Slug轴促进多能间充质干细胞在椎间盘退变中的再生作用[8],但CircBACH1、miR-140-5p与MDM2三者间的靶向关系尚不明确。本研究旨在分析CircBACH1对MM 细胞增殖、凋亡和化疗敏感性的影响,以及对miR-140-5p/MDM2轴的靶向调节机制。
1 材料与方法
1.1 样本和细胞 选取2021年1月—2022年12月荆州市中心医院收治的未接受放化疗的18例MM患者(MM组)骨髓,其中男11 例,女7 例,年龄50~75 岁。同时抽取18 例骨髓移植健康供者骨髓作为正常对照组,其中男10例,女8例,年龄42~68岁。所有临床检验样本的采集均经受检者知情同意并获得医院伦理学委员会批准(批号:202001136)。人MM 细胞系U266细胞购自于武汉普赛诺生命科技有限公司。
1.2 试剂与仪器 EDTA.2K 抗凝剂(上海源叶生物科技有限公司);人全血单个核细胞分离液(Ficoll配制,上海吉至生化科技有限公司);FITC标记抗人CD138抗体(艾美捷科技有限公司);RNA 提取试剂、一步法实时荧光定量PCR(qRTPCR)试剂盒(南京诺唯赞生物科技股份有限公司);All-in-OneTMmiRNA First-Strand cDNA Synthesis Kit 和All-in-OneTMmiRNA qPCR Kit( 美国GeneCopoeia 公司);LipofectamineTM2000 转染试剂(北京百奥创新科技有限公司);CCK-8细胞增殖检测试剂盒(上海雅吉生物科技有限公司);Annexin V-FITC/PI细胞凋亡检测试剂盒(武汉伊莱瑞特生物科技股份有限公司);硼替佐米(正大天晴药业集团股份有限公司,国药准字H20204018);si1-CircBACH1、si2-CircBACH1及阴性对照(NC)、miR-140-5p mimic及NC、antimiR-140-5p 及NC、p-mirGLO-CircBACH1-WT、p-mirGLOMDM2-WT 及 p-mirGLO-CircBACH1-MUT、p-mirGLOMDM2-MUT 质粒构建(上海吉凯基因公司);qRT-PCR 引物合成(上海生工生物工程股份有限公司);B 细胞淋巴因子2(Bcl-2)、Bcl-2 相关X 蛋白(Bax)、裂解的胱天蛋白酶(cleaved caspase)-3 兔单克隆抗体(英国Abcam 公司);辣根过氧化物酶标记山羊抗兔IgG 二抗(沈阳万类生物科技有限公司);MiniMACSTM 磁珠细胞分选仪(德国Miltenyi 公司);SpectraMax iD5 多功能酶标仪(美谷分子仪器有限公司);CFX96 Touch 实时荧光定量PCR 仪(美国伯乐公司);CytoFLEX流式细胞仪(美国贝克曼库尔特公司)。
1.3 研究方法
1.3.1 免疫磁珠分离骨髓液中CD138+浆细胞 取加入EDTA-K2抗凝剂的骨髓液3 mL,使用Ficoll分离液分离骨髓单个核细胞,然后利用CD138 标记磁珠抗体进行孵育,并加入磁珠分选缓冲液,经过MACS磁珠分选器分离CD138+浆细胞,通过流式细胞术验证浆细胞。剩余细胞离心后,TRIzol法提取总RNA,并放置-20 ℃保存,用于后续实验。
1.3.2 细胞培养 将人MM 细胞系U266 细胞接种于含10%胎牛血清(FBS)和1%双抗的PMI-1640 培养基中,并置于37 ℃、5%CO2的培养箱中培养,待细胞汇合率生长至80%后进行传代。
1.3.3 qRT-PCR 检测细胞中CircBACH1、miR-140-5p、MDM2 mRNA的表达 分别收集MM组和正常对照组的浆细胞以及U266 细胞,用TRIzol 法提取总RNA。miRNA 逆转录试剂盒(All-in-One ™miRNA First-Strand cDNA Synthesis Kit)进行逆转录,生成miRNA 对应的cDNA 第一链,再以cDNA 为模板使用miRNA qPCR 定量试剂盒(All-in-One™miRNA qPCR Kit)对miR-140-5p 进行定量,随后以总RNA为模板,按照一步法qRT-PCR试剂盒对CircBACH1和MDM2进行定量。qRT-PCR 反应体系:2×One Step SYBR Green Mix 10 μL,Enzyme 1 μL,上下游引物各0.5 μL,RNA 1 μL,补ddH2O 至总体积20 μL。反应程序:95 ℃预变性30 s;二步法,95 ℃变性10 s,60 ℃退火30 s,40 个循环。CircBACH1、MDM2 以GAPDH 为内参,miR-140-5p 以U6 为内参,采用2-ΔΔCt法计算细胞中CircBACH1、miR-140-5p、MDM2 mRNA的相对表达量,引物序列见表1。所有实验均重复3次。

Tab.1 qRT-PCR primers表1 qRT-PCR引物
1.3.4 细胞转染和分组 先构建两个靶向CircBACH1 的siRNA 质粒,分别为siRNA1-CircBACH1 和siRNA2-CircBACH1,将两个不同敲低位点的质粒利用Lipofectamine 2000 转染试剂转染至U266 细胞中,记为si1-CircBACH1 组和si2-CircBACH1 组,同时以未转染(Control 组)和转染空载体(si-NC 组)作为阴性对照。然后通过qRT-PCR 检测各组CircBACH1 的表达来确定最优敲低位点,并在转染si-CircBACH1 的基础上进行回补实验,将细胞分为si-CircBACH1+anti-miR-NC 组(共转染si-CircBACH1 和antimiR-NC)和si-CircBACH1+anti-miR-140-5p 组(共转染si-CircBACH1 和anti-miR-140-5p),转染48 h 后收集各组细胞分别提取RNA 和蛋白,并按照1.3.3 的方法检测各转染组细胞中CircBACH1、miR-140-5p、MDM2 mRNA的表达。
1.3.5 CCK-8 法检测细胞增殖活性 将转染48 h 后的细胞以1×103个/孔接种至96 孔板中,加入100 μL PMI-1640 培养基并置于37 ℃、5%CO2培养箱中培养48 h,然后在每孔中加入10 μL 的CCK-8 溶液继续培养4 h,用酶标仪检测450 nm波长处的光密度(OD)值,并计算细胞存活率,细胞存活率(%)=(OD实验组-OD空白组)(/OD对照组-OD空白组)×100%。
1.3.6 流式细胞术检测细胞凋亡及化疗敏感性 凋亡检测:将转染48 h 后的各组细胞接种至6 孔板中(1×104个/孔),加入普通培养基培养48 h 后,重悬细胞,4 ℃,300×g离心5 min收集细胞。然后分别加入5 μL Annexin V-FITC和10 μL PI,室温避光孵育15 min。化疗敏感性检测:另取转染48 h后的各组细胞接种至6孔板,加入含有20 nmol/L硼替佐米的培养液培养24 h[11],然后收集细胞,其余步骤同上,用流式细胞仪分别检测加入硼替佐米前后的细胞凋亡情况。
1.3.7 Western blot 检测细胞中Bax、Bcl-2、cleaved caspase-3蛋白的表达 收集转染后神经元并用PBS 清洗,加入RIPA裂解液提取总蛋白,BCA法测定蛋白浓度。然后将蛋白样品经SDS-PAGE 凝胶电泳后转移到PVDF 膜中。将膜用5%脱脂奶粉室温孵育1 h,然后加入Bax、Bcl-2、cleaved caspase-3兔单克隆抗体稀释液(1∶2 000)在4 ℃下孵育过夜,再加入辣根过氧化物酶标记的山羊抗兔IgG 二抗稀释液(1∶500)在室温下孵育1 h,用ECL 发光试剂显色,用凝胶成像仪成像,以GAPDH为内参,用Image J软件分析并计算蛋白表达量。
1.3.8 双萤光素酶报告基因实验验证miR-140-5p 与CircBACH1、MDM2之间的靶向关系 先通过ENCORI(https://starbase.sysu.edu.cn)进行生物信息预测miR-140-5p 在CircBACH1、MDM2 的3'UTR 上的结合位点。然后利用pmirR-GLO 载体分别构建野生型质粒CircBACH1-WT、MDM2-WT 和突变型质粒CircBACH1-MUT、MDM2-MUT,再将野生型和突变型质粒分别与miR-140-5p mimic 或miR-140-5p mimic-NC 共转染细胞,48 h 后用双萤光素酶活性检测试剂盒检测萤光素酶活性。
1.4 统计学方法 采用Graphpad prism 8.0分析数据。计量资料以表示,多组间比较采用单因素方差分析,组间多重比较采用Tukey’s检验。P<0.05为差异有统计学意义。
2 结果
2.1 CircBACH1、miR-140-5p、MDM2 mRNA 在细胞中表达水平比较 与正常对照组相比,MM 组的骨髓浆细胞及U266 细胞中CircBACH1、MDM2 mRNA 表达升高,miR-140-5p 表达降低(P<0.05),见表2。
Tab.2 Comparison of mRNA expression levels of CircBACH1,miR-140-5p and MDM2 between three groups表2 各组CircBACH1、miR-140-5p、MDM2 mRNA表达水平比较(n=18,)

Tab.2 Comparison of mRNA expression levels of CircBACH1,miR-140-5p and MDM2 between three groups表2 各组CircBACH1、miR-140-5p、MDM2 mRNA表达水平比较(n=18,)
**P<0.01;a与正常对照组比较,P<0.05。
组别正常对照组MM组U266细胞F CircBACH1 1.02±0.07 1.97±0.15a 2.01±0.12a 405.689**miR-140-5p 0.98±0.06 0.37±0.03a 0.34±0.03a 1304.333**MDM2 0.96±0.05 1.61±0.11a 1.68±0.10a 346.024**
2.2 不同位点敲低细胞中CircBACH1 的表达水平比较 Control组、si-NC组、si1-CircBACH1组和si2-CircBACH1 组细胞CircBACH1 表达水平分别为0.99±0.04、0.98±0.05、0.43±0.02和0.56±0.03,组间比较差异有统计学意义(n=3,F=184.148,P<0.01);与Control 组和si-NC 组相比,si1-CircBACH1 组和si2-CircBACH1 组细胞中CircBACH1 的表达水平均降低,且si1-CircBACH1 组中CircBACH1 的表达水平低于si2-CircBACH1 组(P<0.05),选用效率更高的si1-CircBACH1进行后续实验。
2.3 各转染组细胞中CircBACH1、miR-140-5p、MDM2 mRNA 的表达 与Control 组和si-NC 组相比,si-CircBACH1 组CircBACH1、MDM2 mRNA 表达降低,miR-140-5p 表达升高(P<0.05);与si-CircBACH1+anti-miR-NC 组相比,si-CircBACH1+anti-miR-140-5p 组CircBACH1 表达差异无统计学意义,miR-140-5p 表达降低,MDM2 mRNA 表达升高(P<0.05),见表3。
Tab.3 Comparison of mRNA expression levels of CircBACH1,miR-140-5p and MDM2 between five groups of cells表3 各转染组细胞中CircBACH1、miR-140-5p、MDM2 mRNA表达水平比较(n=3,)

Tab.3 Comparison of mRNA expression levels of CircBACH1,miR-140-5p and MDM2 between five groups of cells表3 各转染组细胞中CircBACH1、miR-140-5p、MDM2 mRNA表达水平比较(n=3,)
**P<0.01;a 与Control 组比较,b 与si-NC 组比较,c 与si-CircBACH1+anti-miR-NC组比较,P<0.05;表4同。
CircBACH1 1.00±0.00 0.98±0.05 0.46±0.03ab 0.44±0.02 miR-140-5p 1.00±0.00 1.02±0.05 1.93±0.13ab 1.91±0.14组别Control组si-NC组si-CircBACH1组si-CircBACH1+antimiR-NC组si-CircBACH1+antimiR-140-5p组F MDM2 1.00±0.00 1.01±0.06 0.39±0.02ab 0.41±0.03 0.46±0.031.32±0.08c 0.77±0.05c 187.459**276.128**69.823**
2.4 细胞增殖活性比较 Control 组、si-NC 组、si-CircBACH1组、si-CircBACH1+anti-miR-NC 组和si-CircBACH1+anti-miR-140-5p 组细胞增殖活性(%)分别为82.65±6.57、80.19±6.24、31.18±4.24、32.67±4.47、63.48±5.12,组间比较差异有统计学意义(n=3,F=63.860,P<0.01);与Control 组和si-NC 组相比,si-CircBACH1 组细胞增殖活性降低(P<0.05);与si-CircBACH1 组和si-CircBACH1+anti-miR-NC 组相比,si-CircBACH1+anti-miR-140-5p 组细胞增殖活性升高(P<0.05)。
2.5 敲低CircBACH1 对细胞凋亡的影响 Control组、si-NC 组、si-CircBACH1 组、si-CircBACH1+antimiR-NC 组和si-CircBACH1+anti-miR-140-5p 组细胞凋亡率(%)分别为28.96±1.37、29.12±1.41、65.69±2.17、66.78±2.25 和43.82±1.87,组间比较差异有统计学意义(n=3,F=305.487,P<0.01);与Control组和si-NC 组相比,si-CircBACH1 组细胞凋亡率增加(P<0.05);与si-CircBACH1 组和si-CircBACH1+anti-miR-NC组相比,si-CircBACH1+anti-miR-140-5p组细胞凋亡率降低(P<0.05),见图1。

Fig.1 Apoptosis of cells in each group detected by flow cytometry图1 流式细胞术检测各组细胞的凋亡率
2.6 敲低CircBACH1 对细胞化疗敏感性的影响 见图2。加入硼替佐米后,Control组、si-NC组、si-CircBACH1 组、si-CircBACH1+anti-miR-NC 组和si-CircBACH1+anti-miR-140-5p 组细胞凋亡率(%)分别51.18±2.73、52.29±2.62、84.74±4.68、83.37±4.35和69.25±1.08,组间比较差异有统计学意义(n=3,F=69.638,P<0.01);与Control 组和si-NC 组相比,si-CircBACH1 组细胞凋亡率升高(P<0.05),敲低CircBACH1表达后细胞对硼替佐米的化疗敏感性升高;与si-CircBACH1 组和si-CircBACH1+anti-miRNC 组相比,si-CircBACH1+anti-miR-140-5p 组细胞凋亡率明显降低(P<0.05),敲低CircBACH1表达的同时抑制miR-140-5p表达,细胞对硼替佐米的化疗敏感性降低。

Fig.2 The apoptosis of cells in each group after adding bortezomib detected by flow cytometry图2 流式细胞术检测加入硼替佐米后各组细胞的凋亡率
2.7 敲低CircBACH1 对细胞凋亡相关蛋白的影响 与Control 组和si-NC 组相比,si-CircBACH1 组细胞中Bcl-2 蛋白表达降低,Bax、cleaved caspase-3蛋白表达升高(P<0.05);与si-CircBACH1+antimiR-NC 组相比,si-CircBACH1+anti-miR-140-5p组细胞中Bcl-2蛋白表达升高,Bax、cleaved caspase-3蛋白表达降低(P<0.05),见图3、表4。
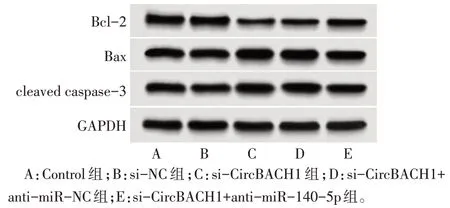
Fig.3 Bcl-2,Bax,cleaved caspase-3 protein expression in each group图3 各组细胞中Bcl-2、Bax、cleaved caspase-3蛋白表达情况
Tab.4 Comparison of expression levels of Bcl-2,Bax,and cleaved caspase-3 between five groups of cells表4 各组细胞中Bcl-2、Bax、cleaved caspase-3蛋白表达水平比较(n=3,)
Tab.4 Comparison of expression levels of Bcl-2,Bax,and cleaved caspase-3 between five groups of cells表4 各组细胞中Bcl-2、Bax、cleaved caspase-3蛋白表达水平比较(n=3,)
组别Control组si-NC组si-CircBACH1组si-CircBACH1+antimiR-NC组si-CircBACH1+antimiR-140-5p组F Bcl-2 1.02±0.05 1.01±0.05 0.41±0.02ab 0.42±0.02 Bax 0.97±0.04 0.95±0.04 1.52±0.06ab 1.51±0.06 cleaved caspase-3 0.92±0.04 0.93±0.05 1.44±0.06ab 1.45±0.07 0.72±0.04c 1.21±0.05c 1.17±0.05c 182.49389.79167.222
2.8 CircBACH1、miR-140-5p和MDM2之间的靶向关系 ENCORI 分析结果显示,miR-140-5p 与CircBACH1、MDM2 均存在靶向结合位点,见图4。双萤光素酶报告基因实验结果发现,转染CircBACH1-WT 或MDM2-WT 后,共转染miR-140-5p mimic 的细胞相对萤光素酶活性低于共转染miR-140-5p mimic-NC 的细胞(0.42±0.03vs. 1.02±0.07,t=13.650;0.43±0.02vs. 1.00±0.07,t=19.810;n=3,P<0.05),而转染CircBACH1-MUT 或MDM2-MUT后,共转染miR-140-5p mimic的细胞与共转染miR-140-5p mimic-NC的细胞相对萤光素酶活性差异无统计学意义(0.99±0.05vs. 0.97±0.05,t=0.490;1.02±0.06vs.1.01±0.07,t=0.188;n=3,P>0.05)。
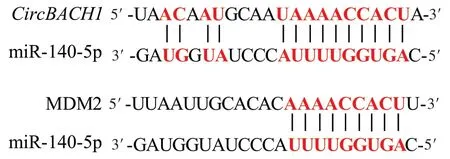
Fig.4 Targeted binding sites between miR-140-5p and CircBACH1 and MDM2图4 miR-140-5p与CircBACH1、MDM2之间的靶向结合位点
3 讨论
MM 是一种无法治愈的浆细胞恶性肿瘤,患者表现出非特异性症状,如疲劳、贫血和骨痛。在确诊MM 时,患者一般处于肿瘤晚期,其病因难以评估,对其发病机制的深入了解非常重要[9]。目前的治疗方法主要基于使用蛋白酶体抑制剂、双膦酸盐、皮质类固醇、免疫抑制剂和外周血干细胞移植,但目前的治疗方法对部分患者仍然无效,生存率较低[10]。CircRNA 是一类具有共价闭环结构的非编码RNA,已被揭示与多种肿瘤的进展有关,包括MM[11-12]。CircPSAP 通过充当miR-331-3p 海绵来调节组蛋白去乙酰化酶4(HDAC4)表达来调节人MM 细胞的增殖、凋亡和对硼替佐米的敏感性[13],CircBACH1可以通过靶向let-7a-5p 调节环磷腺苷效应元件结合蛋白5,增强结直肠癌细胞的增殖和转移[14]。本研究结果显示,CircBACH1 在MM 患者的浆细胞和U266细胞中的表达高于正常对照组,表明CircBACH1 可能参与MM 的发展过程。因此,本研究进行了CircBACH1敲低实验,结果显示,转染si-CircBACH1后细胞中CircBACH1 的表达和细胞的增殖活性降低,细胞凋亡率和对硼替佐米的敏感性升高,且细胞中凋亡相关蛋白cleaved caspase-3、Bax 表达升高,Bcl-2 表达降低,提示敲低CircBACH1 能够抑制MM细胞的增殖,促进细胞凋亡并提高对化疗的敏感性,从而提升MM的治疗效果,抑制其发展。
CircRNA可以通过充当miRNA海绵来调节基因转录和翻译,从而与某些miRNA 结合,影响细胞发育、凋亡、增殖和其他生物活性。circ_0058058 可以充当miR-338-3p 的海绵上调自噬相关蛋白14(ATG14)表达以促进MM 细胞生长和转移[15]。Wu等[16]研究发现了MM 发病机制中的miRNAs 网络:miR-145-3p 通过靶向HDAC4 mRNA 起作用,从而增强MM 细胞自噬、凋亡以及硼替佐米的抗MM 活性。MDM2 作为一种原癌基因,可直接与肿瘤抑制因子p53 结合,抑制其转录活性。研究显示,在MM过程中MDM2 过表达导致p53 失活和细胞凋亡减少,敲低MDM2 可以抑制MM 的恶性进展[17-18]。本研究结果显示,与si-NC组相比,si-CircBACH1组的MM 细胞中miR-140-5p 表达升高,而MDM2 表达降低;回补实验结果显示,转染anti-miR-140-5p后si-CircBACH1 对MM 细胞增殖、凋亡及化疗敏感性的作用被逆转,同时MDM2 mRNA水平升高,提示敲低CircBACH1对MM的抑制作用可能是通过上调miR-140-5p、下调MDM2 实现的。ENCORI 分析和萤光素酶报告基因结果显示,miR-140-5p mimic 显著降低了MM 细胞中CircBACH1-WT 和MDM2-WT 的萤光素酶活性,验证了CircBACH1、miR-140-5p、MDM2 三者之间存在靶向关系,提示敲低CircBACH1 可能通过海绵化miR-140-5p 靶向下调MDM2 来抑制MM 细胞的增殖,促进细胞凋亡及对化疗敏感性。
综上所述,敲低CircBACH1 可通过调控miR-140-5p/MDM2 轴来抑制MM 细胞的增殖,促进MM细胞凋亡,提高化疗敏感性,为提升MM 的治疗效果,降低其耐药性提供了新生物标志物和靶点。但目前CircBACH1 和miR-140-5p 在肿瘤发展中的研究较少,因此可进一步探索两者在其他肿瘤中作用及靶向调节关系。
