缓冲溶液在生产生活中的应用实例
2023-11-06畅炳蔚秦建芳杨佳鑫
畅炳蔚,秦建芳,杨佳鑫
(运城学院,山西运城,044000)
0 引言
缓冲溶液是指能够抵抗少量强酸、强碱和大量水的稀释而保持体系pH基本不变的溶液。缓冲溶液可由弱酸和弱酸盐、弱碱和弱碱盐或多元弱酸的酸式盐及其次级盐组成,其作用机制是通过互为酸碱缓冲对之间的质子转移来消耗外来的少量H+和OH-。但是,当缓冲溶液中加入大量的酸或碱时,缓冲对将被大量消耗,抗酸抗碱能力也会随之减弱甚至消失。缓冲对浓度越大,加入强酸或强碱时缓冲溶液pH值变化越小,缓冲容量越大。缓冲溶液的pH 值可根据亨德森-哈塞尔巴尔赫方程进行计算,见式1与式2。缓冲溶液都有最佳的缓冲范围,理论上最佳pH缓冲范围在pKaΘ±1区间,实际应用中因缓冲对不同略有变化[1]。因此,要选择合适的缓冲溶液,就需对不同的缓冲溶液有所了解。本文列举了缓冲溶液在生命科学、自然界、医药领域、工业生产中的应用,为广大学者和专业人士更好地认识和应用缓冲溶液提供参考。
弱酸-弱酸盐缓冲溶液
弱碱-弱碱盐缓冲溶液
1 缓冲溶液在生命活动中的作用——血浆缓冲体系
人体体液、内环境溶液具有不同pH值[2]。人体血浆pH值保持在7.35~7.45。当血浆pH < 7.35时人体会发生酸中毒,pH < 7.0时甚至会昏迷致死;血浆pH > 7.45时人体会发生碱中毒,pH > 7.8时会手足抽搐致死。然而当人体摄入酸性食物(如可乐pH值为2.5)或碱性食物(如鸡蛋清pH值为8),正常人血浆pH值不会产生很大变化,这是因为人体血浆中存在NaHCO3/H2CO3、蛋白质钠盐/蛋白质、Na2HPO4/NaH2PO4缓冲体系,其中起主导作用的是NaHCO3/H2CO3缓冲对。当摄入酸性食物时,HCO3-会结合H+生成H2CO3,体内过多的H2CO3分解出CO2从肺泡排出,以保持血浆中的H+浓度基本不变,血浆pH值不变。同理,当摄入碱性食物时,则会发生H2CO3与OH-反应生成HCO3-,从而维持血浆pH值基本恒定。当人剧烈运动后,肌肉会感觉酸痛,是因为产生了乳酸,此时人体血浆缓冲体系也可以消耗掉这部分乳酸,维持血浆pH值在7.35~7.45。此外,在血红蛋白和氧合血红蛋白(HHb-HHbO2)对血浆内碳酸含量的调节中,O2和CO2的运输也起到了至关重要的作用。在体外细胞培养实验中,通常需要模拟体液缓冲体系。
2 缓冲溶液在自然界的应用
2.1 土壤缓冲体系
土壤具有一定抵抗少量外来酸碱物质,缓和其酸碱反应变化的能力,称为土壤的缓冲性能。土壤的缓冲性能主要依靠土壤胶体的离子交换作用、土壤中缓冲对(强碱弱酸盐的解离平衡)等过程来实现。土壤胶体吸附了很多代换性阳离子,如Ca2+、 Mg2+、Na+等可对酸起缓冲作用,H+、 Al3+可对碱起缓冲作用。一方面,土壤胶体所吸附的交换酸H+和Al3+,通过与中性盐类(KCl、NaCl、BaCl2等)交换,调节土壤酸度,如图1所示[3]。另一方面,土壤中的强碱弱酸盐如NaAc,与土壤胶体吸附的H+交换生成弱酸HAc,通过强酸弱碱盐的解离平衡来实现对酸度的调节。如图2所示。土壤的酸碱性对土壤微生物、动植物活动,有机物的分解,元素的迁移有很大影响。

图1 土壤胶体的离子交换作用
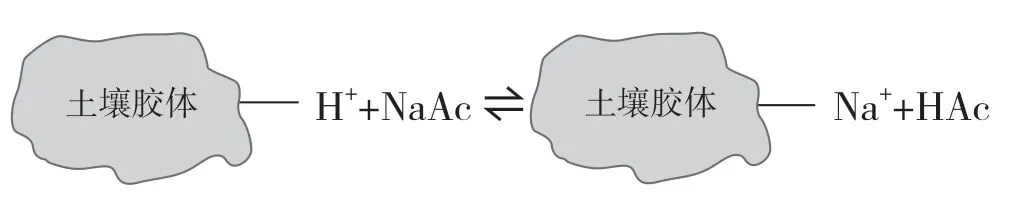
图2 土壤中强酸弱碱盐的解离平衡
2.2 海洋缓冲体系
海水pH值是衡量海水酸碱度的重要标志。海水pH值与海水深度、季节、海水缓冲离子对、盐度、海水生物生命活动、海水中叶绿素α含量等因素有关[4]。海水pH值变化不大,以渤海为例,其表层海水pH值通常在7.95~8.38,底层pH值在7.89~8.35。夏季表层海水pH值最高,是由于夏季海水温度高,海水吸收 CO2能力降低,海水中CO2含量减少[5]。此外,夏季浮游植物光合作用强,加剧了海水中的CO2的消耗,海水pH值升高[6,7]。
海水 pH值变化对海洋生态系统具有重要影响[8]。近 200 年西北太平洋和南大洋表层海水 pH值已经下降了 0.1,并伴有明显季节性和局部性特征[9-11]。翟惟东等[12]发现在渤海夏季西北部和北部底层累积溶解氧下降5.6 mg/L,pH值降幅高达0.29。海洋酸化易诱使海洋有毒藻类暴发,改变海洋食物链结构,导致海水CaCO3饱和度降低,不利于钙质生物生长,使得部分生物栖息地(如珊瑚礁)被破坏,还会导致海水缺氧层扩张,部分海洋生物死亡甚至物种灭绝的严重后果[13,14]。
海水pH值的正常变化差异范围在 0.01~0.1[4]。海水中存在多种缓冲离子对,包括碳酸盐缓冲对(Ca2+、Mg2+与HCO3-、CO32-、H2CO3),磷酸盐缓冲对(Ca2+、Mg2+与HPO42-、H2PO4-、PO43-),硼酸盐缓冲对(Ca2+、Mg2+与H3BO3、H2BO3-)和硅酸盐缓冲对(Ca2+、Mg2+与H3SiO4-、H4SiO4)[15]。海水缓冲容量取决于各种离子对的缔合平衡,其中HCO3--CO32--H2CO3缓冲体系组分浓度最高,是影响海水pH值的主要因素。
3 缓冲溶液在科学研究的应用
3.1 缓冲溶液在生命科学实验中的应用
三羟甲基氨基甲烷—盐酸(Tris- HCl)缓冲溶液是DNA、蛋白质研究中的重要缓冲液。Tris即三羟甲基氨基甲烷(C4H11NO3),是一种弱碱,结构式见图3,室温下pKa为8.1。Tris-HCl缓冲液的缓冲原理为:Tris 中的氨基(-NH2)与盐酸解离出的H+结合生成季铵基团Tris-H+,Tris-H+与Tris 形成缓冲对,其平衡关系见式3,缓冲范围一般为 7.0~9.0[16]。Tris 对生化过程干扰很小,不与Ca2+、Ma2+及重金属离子发生沉淀,因此广泛应用于生命科学实验中,常作为核酸、蛋白质的溶解液,也有研究者将其用于DNA 的捕获与释放[17]、染色体的特异性标记[18]、生物陶瓷体外浸泡液[19]等研究中。
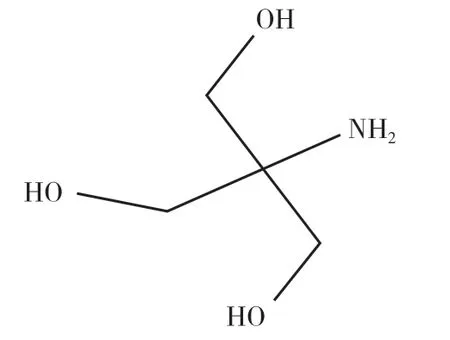
图3 三羟甲基氨基甲烷(Tris)的结构简式[16]
3.2 缓冲溶液在燃料电池研究中的应用
固态氧化物燃料电池(SOFC)是目前理论能量密度最高的一种燃料电池。Ni/YSZ金属陶瓷常作为SOFC的负极材料。研究表明,负极材料中Ni的含量越高,Ni分布得越均匀,Ni/YSZ负极的性能越好。机械混合法是制备Ni/YSZ负极的常用工艺,通过加入沉淀剂使Ni2+、Y3+、Zr4+以原子尺度混合,沉淀过程中溶液pH值变化较大,会影响粉料成分及粒度的均匀性和一致性。李莹[20]用缓冲溶液法(NH4HCO3和NH3▪H2O)制备了SOFC用Ni/YSZ负极材料,与机械混合法相比,缓冲溶液法沉淀过程中pH值更稳定,能使Ni在YSZ基质中分布得更均匀,有利于Ni颗粒之间形成连通的、完善的网络结构。
3.3 缓冲溶液在水质检测中的应用
水总硬度指水中Ca2+、Mg2+的总量。硬度高的水饮用时会使人感到苦涩,长期饮用高硬度水会消耗大量胃酸,甚至影响胃肠功能。高硬度水用于工业会导致锅炉水垢过多造成管道堵塞,影响产品质量。水总硬度是评价水质的一个重要指标。EDTA络合滴定法是测定水总硬度的常规经典方法,其操作简单,不需专用仪器,也是国家标准中推荐使用的水质钙和镁(总硬度)测定方法[21]。测定原理是在pH=10的条件下,用EDTA络合滴定Ca2+和Mg2+,络合后溶液变为紫色或紫红色,铬黑T作指示剂,当溶液由紫色变为天蓝色时为滴定终点。络合反应中若体系pH<10,形成的络合物不稳定,不能准确滴定。此外,EDTA反应过程中不断释放H+,使溶液pH值降低,因此反应需要在pH=10的NH3·H2O-NH4Cl缓冲溶液中进行。
3.4 缓冲溶液在食品检测中的应用
面包、油条、油饼等面制食品中,为了改善口感,食品加工企业往往会在制作过程中加入含铝食品添加剂,如明矾。食用过量铝会影响肠道对磷、钙等元素的吸收,导致骨质疏松,且对中枢神经系统、消化系统、造血系统、免疫功能等均有不良影响。《食品安全国家标准—食品添加剂使用标准》(GB 2760—2014)[22,23]中规定焙烤食品、油炸食品中铝的限量标准为≤100mg/kg。我国国家标准《面制食品中铝的测定》(GB/T 5009.182—2017)采用铬天青S分光光度法[24-26]。样品用硝酸-高氯酸消解后,在乙二胺-盐酸缓冲溶液(pH值为6.7~7.0)中,聚乙二醇辛基苯醚和溴代十六烷基吡啶的存在下,Al3+与铬天青S反应生成蓝绿色的四元胶束,于620 nm波长处测定吸光度值并与标准系列比较定量。样品消解后pH较低会影响显色反应,不能生成蓝色三元络合物,导致检测结果不准确[27],因此反应需要在乙二胺-盐酸缓冲溶液(pH值为6.7~7.0)中进行。
4 缓冲溶液在工业生产的应用
4.1 缓冲溶液在硅半导体器件中的应用
在生产硅半导体器件时,需用氢氟酸腐蚀以去除硅片表面的氧化膜SiO2,反应过程见式(4)。若直接用HF溶液作腐蚀液,反应初始时体系H+浓度过大,随着反应的进行,H+浓度将不断下降,pH值不断上升,会造成腐蚀不均匀。在HF溶液中加入NH4F,反应过程中NH4F水解产生HF,见式(5),使得HF浓度维持稳定。而体系中H+主要来源于HF的解离,见式(6),HF浓度稳定,因此反应过程中H+浓度稳定,反应pH稳定,硅片腐蚀均匀。
4.2 缓冲溶液在气体净化中的应用
煤炭是我国第一大能源,2021年煤炭消费量占我国能源消费总量的56.0%。但是煤炭燃烧时会产生大量硫氧化物、硫化氢等有害气体。在我国煤化工气体净化领域中,栲胶脱硫工艺[28]是使用效果最好的脱硫方法之一,其采用碳酸盐对H2S气体进行吸收。脱硫液中Na2CO3含量越高,对H2S的吸收量越大。但脱硫液初始Na2CO3含量过高时,脱硫液pH值过高。当缓冲液pH>9.5时,不利于HS-向单质硫的转化,不易回收固态硫,脱硫液中的HS-会对水体造成污染。而脱硫液中Na2CO3含量较低时,pH过低,H2S去除率较低,因此脱硫液的pH值是影响栲胶脱硫工艺最重要的因素。采用Na2CO3-NaHCO3缓冲体系对H2S进行吸收,可维持脱硫液pH值在9.00~9.20之间。缓冲溶液中Na2CO3最佳初始含量为4 ~ 6 g/L。
4.3 缓冲溶液在染料生产中的应用
织物染色工艺中,需要将织物置于含有染料的染缸中,俗称染浴。大多数染料对染浴的pH值较敏感,若染浴pH值不稳定,产品便会出现色差、色浅、色花等瑕疵。将缓冲溶液应用于印染行业中,可有效控制染浴的pH值,提高产品质量。
硫化黑是消费最大的硫化染料,常用于牛仔、棉织物的染色。硫化黑在染色过程中,很容易发生氧化,产生染斑。在染浴中加入Na2CO3-NaHCO3的混合碱来控制pH值,可减慢氧化速度,有效减轻染斑。
涂料印花中实验的黏合剂或交联剂通常是弱酸性溶液,带有弱正电荷,常使乳液分散稳定性降低,而不利于印花。若在印花色浆中加入某些缓冲剂,如NH3▪H2O-(NH4)2SO4,可使色浆pH值稳定在7~8,此时色浆的黏度和流变性最为理想,亦可防止交联反应过早发生,提高色浆稳定性,保证印花过程顺利进行,提高产品质量。
一种橙红色的染料——安替比林,是由苯酚在碱性介质中与铁氰化钾、4-氨基安替比林反应合成的。反应过程中为了防止芳香胺类的干扰,在体系中加入NH3·H2O-NH4Cl缓冲溶液以控制反应体系pH值为10.0 ± 0.2。
5 缓冲溶液在医药领域的应用
5.1 缓冲溶液在滴眼液中的应用
一些眼部疾病需要使用滴眼液治疗缓解,人体泪液pH值在7.3~7.5,当滴眼液过酸或过碱时,对人眼刺激性较大,甚至会损伤眼睛及眼黏膜。研究表明,当滴眼液pH值在6~8时,对眼部刺激较小[29]。因此,在制备滴眼液过程中,需要在药物中加入缓冲溶液,使滴眼液pH值在药物最稳定pH值和泪液生理pH值之间,以保证药物药效的稳定性,并尽量减少对眼部的刺激[30]。氯霉素是一种常见的抗生素,用于滴眼液可以治疗由大肠杆菌、流感嗜血杆菌、克雷伯菌属、金黄色葡萄球菌、溶血性链球菌等导致的眼部感染,如沙眼、结膜炎、角膜炎、眼睑缘炎等。氯霉素在弱酸溶液中能稳定存在,在中性或碱性溶液中易分解。使用硼酸缓冲溶液(H3BO3-B(OH)4-)配制氯霉素滴眼液,可将滴眼液pH值控制在5.8~6.4,这既能使氯霉素长期稳定有效,又对人眼刺激较小。此外,硼酸本身具有防腐作用,也可延长氯霉素滴眼液的有效期。
5.2 缓冲溶液在止血剂中的应用
凝血酶是一种具有止血功能的蛋白质,是临床上一种常见的止血剂。当用于消化道出血时,胃液pH值在0.9~1.8,蛋白质在强酸条件下变性,凝血酶活性大大降低,无法止血。迟斌元[31]将柠檬酸-柠檬酸钠缓冲剂作为辅料与凝血酶配伍,服用时药物遇水形成缓冲溶液,使凝血酶局部环境pH值在6~8,有效抵御了体液pH对凝血酶的不利影响,防止凝血酶变性并使其在最佳pH范围内发挥最佳药效。
5.3 缓冲溶液在药物保存方面的应用
药物的稳定性不仅受其自身性质影响,而且与周围环境如光线强度、温度、湿度、环境酸碱性、氧气、二氧化碳、微生物等息息相关[30]。黄芩苷是从黄芩根中提取出来的一种黄酮类化合物,具有抑菌抗炎、抗氧化、抗变态及解痉作用,广泛添加于中药药品中。黄芩苷在溶液中的稳定性和溶解度受pH影响较大。pH值较低时,黄芩苷中葡糖醛酸羧基易成盐而游离析出。黄芩苷在液体药剂中易氧化水解,也会使得pH值降低,有效成分流失。pH值较高时,黄芩苷分子中γ-吡酮环发生裂解。目前黄芩苷药剂的配置,均是用碱液将pH值调节至6.8左右,此时黄芩苷具有较高的稳定性和较大的溶解度[32]。而磷酸盐缓冲溶液(H2PO4-- HPO42-)的pH值为6.2~8.2,可为黄芩苷提供稳定的酸碱环境。
6 结语
缓冲溶液在生命科学、自然界、科学研究、工业生产、医药领域中都存在着广泛应用。对广大学者和专业人员而言,掌握各种缓冲溶液的性质、缓冲范围及用途可以帮助其选择合适的缓冲溶液。在选择和配制缓冲溶液时,不仅要考虑缓冲溶液的缓冲范围,还要考虑其稳定性,以及是否与体系中原有物质发生反应、对主体物质的干扰性等。随着科学技术的不断发展,越来越多的缓冲溶液会被开发应用在医学、生命科学、工业、农业、环保、食品等领域中。
