赖氨酰内切酶在大肠杆菌中的重组表达、复性及纯化
2023-11-06徐名强任燕娜蔡孟浩
朱 奕, 徐名强, 任燕娜, 蔡孟浩
(华东理工大学生物反应器工程国家重点实验室 上海 200237)
赖氨酰内切酶 (Lysyl endopeptidase, Lys-C,EC 3.4.21.50) 是一种胰凝乳蛋白酶型丝氨酸蛋白酶,能特异性切割赖氨酸羧基侧的肽键,最早于无色杆菌属 (Achromobacter) 中分离获得[1],后续研究发现溶杆菌属 (Lysobacter)和铜绿假单胞菌属 (Pseudomonas)也能生产该酶[2-3]。Lys-C 与胰蛋白酶、羧肽酶B 等常规蛋白酶相比,具有更高的特异性和酶切效率,已广泛应用于胰岛素药物生产、蛋白质组学研究和多肽序列分析等领域[4-6]。产酶溶杆菌(Lysobacter enzymogenes) 来源的Lys-C 的理化性质和酶切活性与无色杆菌几乎相同,但产量高许多,因此产酶溶杆菌成为国外企业生产Lys-C 的主要菌株[7]。
来源于产酶溶杆菌的Lys-C 包括671 个氨基酸(Amino acids,aa),由信号肽 (20 aa)、前导肽 (184 aa)、成熟肽 (269 aa) 和延伸肽 (198 aa) 4 个结构域组成[8]。晶体结构研究显示Lys-C 的多处Lys 残基暴露在溶剂中,容易被自身识别并切割,产生自降解现象,而利用甲苯磺酰-L-赖氨酸-氯甲烷盐酸盐(TLCK)、苯甲基磺酰氟(PMSF)、磷酸盐缓冲液(PBS)等可以抑制Lys-C 的自降解[9-11]。Lys-C 具有3 对二硫键(Cys6-Cys216,Cys12-Cys80,Cys36-Cys58),其中二硫键Cys6-Cys216被认为与碱性pH 具有稳定性相关[7,12],其最适反应温度为45 ℃,pH 适应范围较宽,在pH 为8~10 时均具有高活性[7,13]。
Lys-C 的底物结合位点称为S1 口袋 (S1 pocket),其底物结合特异性由S1 口袋的特殊结构和Asp225位点共同决定[14-15]。狭窄细长的S1 口袋只能容纳线性侧链,只有Lys 残基和精氨酸(Arg)残基的侧链长度能抵达S1 口袋底部。而Arg 侧链的胍基与Asp225 存在空间位阻效应,限制了Arg 与S1 口袋的结合,因此Lys-C 只对Lys 侧链进行高特异性酶切。Lys-C 具有高特异性和高酶切效率的优势,简化了多酶酶切流程,已成为生产研究中不可或缺的一类酶。
目前,Lys-C 的获取主要依靠进口,日本的Wako公司、美国的Sigma-Aldrich 公司等的商用Lys-C 产品普遍采用从天然菌株Lysobacter enzymogenes中提取的低效工艺。天然菌株表达Lys-C 的最高产量仅5.6 mg/L[16],较低的产量和繁琐的提取工艺导致大规模工业生产面临诸多挑战。随着基因工程和基因编辑技术的快速发展,优异底盘宿主的开发为蛋白表达提供了更多调控模式和表达平台。其中,大肠杆菌Escherichia coli(E.coli) 表达系统具有易于高密度发酵、遗传操作体系成熟、商业化表达载体选择多样等诸多优势,为制备Lys-C 提供了可行的候选路径,有望解决天然菌株生产Lys-C 的诸多难点。此外,蛋白的正确折叠是限制蛋白生产的关键因素,而已有研究证实前导肽在成熟肽的复性过程中扮演分子伴侣的角色,能够降低蛋白折叠过程的活化能,并提高从中间状态到天然状态的转化速率,辅助成熟肽折叠为具有活性构象的蛋白[17-19]。
本文以大肠杆菌为宿主细胞表达了来源于Lysobacter enzymogenes的Lys-C 成熟肽序列,并在其N 端和C 端分别融合一段人工前肽MGSK 和6×His 标签。其中,人工前肽能降低Lys-C 对宿主细胞的毒性,起到稳定表达的作用,而6×His 标签便于后续纯化。同时,本研究也进行了前导肽 (N-terminal pre-pro peptide,pre-N-pro) 的重组表达及其复性辅助作用分析。另外,本研究进行了3 L 反应器的发酵工艺优化,并开发了针对Lys-C 和pre-N-pro 包涵体(Inclusion bodies,IBs) 的新型复性和蛋白纯化工艺,获得了高产量、高纯度的重组Lys-C,一定程度上推动了Lys-C 的工业化生产进程,为异源重组表达Lys-C 奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 大肠杆菌JM109(DE3)感受态和Top 10 感受态购自唯地生物公司。质粒pET-28a购自Invitrogen 公司。所用引物通过软件Snapgene设计 (表1),引物合成和DNA 测序由擎科生物公司和华大基因公司完成。
1.1.2 试剂和培养基 植物蛋白胨和酵母粉购自Oxoid 公司。NaCl、甘油、氨水(均为分析纯)等发酵试剂购自国药集团化学试剂有限公司。DNA 限制性内切酶、质粒小提试剂盒、无缝克隆试剂盒等分子学试剂购自Takara 公司和天根生化科技公司。Tris、EDTA、尿素等试剂购自生工生物工程公司。SDSPAGE、Weatern-blot、蛋白浓度检测等相关试剂分别购自碧云天生物技术公司、翊圣生物技术公司和Sigma-Aldrich公司。IPTG(异丙基硫代半乳糖苷)购自Amresco 公司。 Ni Bestarose Fast Flow 填料、Bestdex G25 填料和Bestcryl S-100 填料均购自博格隆生物技术公司。三肽底物Bz-Lys-pNA 购自南京肽业公司。门冬胰岛素前体发酵液由华润昂德生物药业公司提供。
种子培养基:2×YT 培养基 (植物蛋白胨16 g/L、酵母粉10 g/L、NaCl 5 g/L);反应器发酵培养基:低碳源YT-M9 培养基 (植物蛋白胨16 g/L、酵母粉10 g/L、甘油5 g/L、NaCl 1 g/L、(NH4)2SO46 g/L、MgSO4·7H2O 2 g/L、KH2PO43 g/L、Na2HPO4·12H2O 8.2 g/L、0.03%Antifoam 204、φ=0.1%微量元素);反应器补料培养基(植物蛋白胨20 g/L、酵母粉12 g/L、甘油500 g/L、MgSO4·7H2O 5 g/L)。
1.1.3 缓冲液的配制 缓冲液 1:50 mmol/L Tris-HCl、50 mmol/L NaCl、5 mmol/L EDTA、5%(体积分数,下同)甘油,pH 8;裂解缓冲液:缓冲液 1、0.5%(体积分数,下同)Triton X-100,pH 8;洗涤缓冲液1:缓冲液 1、1.5 mol/L 尿素、0.5% Triton X-100,pH 8;洗涤缓冲液2:缓冲液 1、2 mol/L 尿素、0.5% Triton X-100,pH 8;洗涤缓冲液3:PBS,pH 7.5;变性缓冲液:50 mmol/L Tris-HCl、 300 mmol/L NaCl、 5 mmol/L EDTA、8 mol/L 尿素、20 mmol/L DTT(二硫苏糖醇),pH 8;复性缓冲液:50 mmol/L Tris-HCl、5 mmol/L GSH(谷胱甘肽)、0.5 mmol/L GSSG(氧化谷胱甘肽)、1.5 mol/L 尿素、1 mmol/L EDTA、5%甘油,pH 8.5;透析缓冲液:50 mmol/L Tris-HCl、5 mmol/L GSH、0.5 mmol/L GSSG、4 mol/L(或2、1 mol/L)尿素、1 mmol/L EDTA、5%甘油,pH 8.5;G25 平衡液:50 mmol/L Tris-HCl、 300 mmol/L NaCl、 5 mmol/L EDTA、8 mol/L 尿素,pH 3.5;镍柱亲和平衡液:50 mmol/L NaH2PO4、500 mmol/L NaCl、30 mmol/L咪唑、5%甘油,pH 8;镍柱亲和洗脱液:50 mmol/L NaH2PO4、500 mmol/L NaCl、300 mmol/L 咪唑、5%甘油,pH 8;超滤脱盐缓冲液和S-100 平衡液:50 mmol/L Tris-HCl,pH 8。
1.2 方法
1.2.1 重组菌株的构建 本研究中Lys-C (UniProt ID: Q7M135) 和pre-N-pro (GenBank ID:D23664) 来源于菌株L.enzymogenesATCC 27796,并由金唯智生物科技公司合成大肠杆菌密码子优化的基因序列,提供质粒pUC57-LysC 和pUC57-pNp。以质粒pET-28a 为模板,T7lacO-F/T7lacO-R 为上下游引物,经PCR扩增得到载体片段;分别以质粒pUC57-LysC和pUC57-pNp 为模板,T7lacOLysC-F/T7lacOLysC-R 和28aarmpNp-F/pNp28ahisarm-R 为上下游引物,经 PCR扩增得到带有同源臂的目的基因。根据试剂盒说明书将目的基因片段和线性化载体相连,并转化至大肠杆菌Top 10 感受态。以菌液为模板,V28aUPF/VT7DO-R 和V28aUP-F/V28aDO-R 为上下游引物进行PCR 验证,得到质粒pET28a-LysC 和pET28apreNpro,将质粒分别转化至大肠杆菌JM109(DE3)感受态。
1.2.2 生物反应器发酵 从冻存管中取50 μL 菌液,接种于3 mL 含卡那霉素的LB(Luria-Bertani)培养基,置于37 ℃摇床过夜培养。然后,以体积分数1%接种量接至80 mL 2×YT 培养基进行种子培养,置于37 ℃摇床培养至OD600约为1.5~2。然后,以体积分数4%接种量接入反应器中。反应器的工作体积为2 L,接种前加入50 mL MgSO4溶液 (单独灭菌)和2 mL 微量元素,发酵培养温度和pH 分别为37 ℃和7。分批阶段通过DO-搅拌联动将溶解氧 (DO) 浓度维持在30%~40%,最大搅拌速度为1 000 r/min。发酵培养约5 h 后,DO 和pH 急速上升,以25 mL/h 的补料速率流加补料培养基。当OD600约为15~20 时,将发酵温度降为30 ℃,转速降为650 r/min,补料速度降为20 mL/h,并添加终浓度为0.5 mmol/L 的IPTG 诱导蛋白表达。诱导8 h 后结束高密度发酵培养,离心 (7 000g、4 ℃、15 min) 后收集菌体,保存于-20 ℃备用。
1.2.3 菌体的裂解和包涵体处理 每1 g 菌体添加到10 mL 裂解液中重悬,并使用高压匀浆机在80 MPa的高压下连续裂解菌体3~5 次。离心 (10 000g、4 ℃、20 min),并收集Lys-C 粗包涵体。然后分别以20 mL/g 的洗涤缓冲液1、洗涤缓冲液2 和洗涤缓冲液3 重悬包涵体3 次,室温搅拌1 h,离心 (10 000g、4 ℃、20 min),并回收Lys-C 包涵体。然后使用30 mL/g的变性缓冲液溶解Lys-C 包涵体,室温轻柔摇动4 h。然后,通过超速离心 (25 000g、4 ℃、30 min) 去除沉淀,并使用0.22 μm 滤膜过滤上清液得到Lys-C 变性液。将pre-N-pro 经过相同处理后得到pre-Npro 变性液。
1.2.4 Lys-C 的复性和纯化 将Lys-C 变性液上样至预平衡的Sephadex G25 层析柱 (BXK 26/40,柱高30 cm),流速设置为5 mL/min。用G25 平衡液在1 倍柱体积 (CV) 内进行洗脱,随后用不含DTT 的变性缓冲液将洗脱液的蛋白质量浓度稀释至1 mg/mL 以下,以脉冲 (加30 min,停30 min)的方式搅拌加入复性缓冲液(变性液与复性缓冲液体积比为1∶15)中,4~8℃复性36 h。
将pre-N-pro 变性液加入透析袋,并在透析缓冲液中搅拌复性,分别以4、2、1 mol/L 的梯度依次降低尿素浓度,每隔10 h 换一次透析缓冲液。复性完成后将pre-N-pro 复性液加入Lys-C 复性液中,辅助Lys-C 正确折叠。
将复性完成的Lys-C 复性液使用切向流过滤(Tangential flow filtration,TFF) 系统进行浓缩。首先,将膜包 (10 kDa 孔径,PES(聚醚砜)膜) 安装在夹具上,用大量纯水冲洗膜包组件和硅胶管,直至透过液的pH 为7.0。以20~25 mL/min 的过滤速度对Lys-C 复性液进行浓缩。将得到的Lys-C 复性浓缩液上样至预平衡的Ni NTA-Sepharose 层析柱 (BXK 16/20,柱高10 cm),流速设置为1 mL/min。随后用镍柱亲和平衡液洗涤10 CV(柱体积),并用5 CV 镍柱亲和洗脱液进行一步洗脱,根据紫外吸收峰收集Lys-C 纯化样品。将Lys-C 纯化样品加入超滤管 (10 kDa,15 mL)中,离心 (4 000g、4℃、30 min) 浓缩至1 mL 后,继续添加超滤脱盐缓冲液至15 mL,重复操作2~3 次。将Lys-C 浓缩液直接上样至预平衡的Sephacryl S-100 层析柱 (BXK 16/40,柱高33 cm),流速设置为2 mL/min。随后用S-100 平衡液洗脱,连续收集每个洗脱组分 (2 mL),洗脱完成后层析柱可继续上样。最后对不同组分进行SDS-PAGE 电泳,将高纯度Lys-C 的组分进行合并,最终获得重组Lys-C 样品。
1.2.5 蛋白浓度和纯度的测定 使用Bradford 法测定蛋白浓度,检测595 nm 处的吸光度值,并根据标准曲线 (y=0.86x+1.35,R2=0.99) 计算样品的总蛋白浓度。SDS-PAGE 电泳结束后,将蛋白电泳胶进行考马斯亮蓝染色、脱色和扫描拍照,利用软件Gel-Pro analyzer 分析不同泳道的目标条带灰度值,测定目标蛋白的相对含量或纯度。蛋白回收率为纯化后目标蛋白量和纯化前目标蛋白量的比值。
1.2.6 Lys-C 的酶活检测方法
(1) 酶切三肽底物活性检测。配制酶切反应体系,包括0.2 mol/L AMP(2-氨基-2-甲基-1-丙醇)缓冲液(A)、2.5 mmol/L 底物 (Bz-Lys-pNA) 溶液 (B)、0.1 mol/L Tris-HCl (C)、Lys-C 样品溶液 (D)和φ=45%乙酸终止液 (E),具体步骤如下:1) 向多个微量离心管中加入200 μL 试剂A 和20 μL 试剂B;2) 将微量离心管放入30 ℃水浴锅中预热5 min;3) 向对照组中加入10 μL 试剂C,向样品组中加入10 μL 试剂D,迅速吹打混匀;4) 放入30 ℃水浴锅中反应30 min;5) 分别向样品组和对照组中加入70 μL 试剂E 终止反应。将酶切反应液加到微孔板中,以空白对照作为零点,检测405 nm 处的吸光度值。根据以下公式计算酶活(E),其中a为样品的吸光度值,b为空白对照的吸光度值,c为样品稀释倍数。
(2) 酶切胰岛素前体活性检测。在胰岛素前体发酵液中加Tris 至终浓度为20 mmol/L,并调节pH至9~10。然后按Lys-C 与胰岛素前体质量比为1∶200 加Lys-C 样品,混匀后30 ℃下酶切18~22 h,并加入φ=45%乙酸终止反应,经过超纯水稀释后使用HPLC 检测产物。HPLC检测方法:使用C18色谱柱 (250 mm×4.6 mm×5 μm),柱温为40 ℃,波长为214 nm,流速为1 mL/min,进样量为10 μL。流动相A:3%(质量分数)硫酸钠缓冲液+10%(体积分数)乙腈,流动相B:50%(体积分数)乙腈,洗脱程序液相组成及时间见表2(40 min 时停止)。酶切转化率(X)如下:
式中:SA、SB、SC分别为产物峰、未酶切前体峰、中间产物峰的峰面积。
2 实验结果
2.1 Lys-C 与pre-N-pro 表达菌株的构建
在质粒构建时,Lys-C 和pre-N-pro 的开放阅读框分别包含280 aa 和211 aa,经大肠杆菌密码子优化后,在Lys-C 序列的N 端和C 端分别插入一段人工前肽MGSK 和6×His 标签,以及在pre-N-pro 序列的C 端插入6×His 标签 (图1)。通过PCR 扩增分别得到长度为5 217 bp 的载体片段,以及长度为872 bp的Lys-C 片段和长度为651 bp 的pre-N-pro 片段,然后分别与载体片段连接后得到质粒pET28a-LysC 和pET28a-preNpro (图2(a)和2(b))。通过菌落PCR 验证,阳性转化子扩增出长度分别为1 296 bp 和1 381 bp的DNA 片段,与理论相符 (图2(c)和2(d))。将阳性转化子进行测序比对得到正确的质粒,并转化至大肠杆菌 JM109(DE3)感受态, 获得重组菌株JM109DE3_PT7-LysC 和JM109DE3_PT7-preNpro。
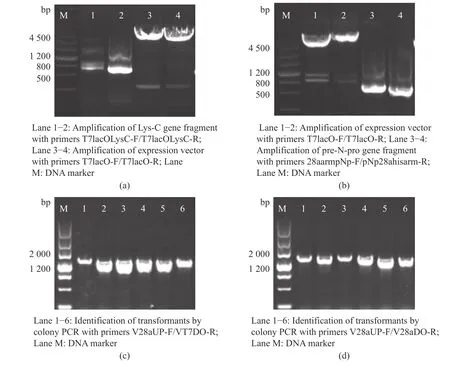
图2 质粒pET28a-LysC 和pET28a-preNpro 的构建与验证Fig.2 Construction and verification of the plasmids pET28a-LysC and pET28a-preNpro
2.2 生产Lys-C 与pre-N-pro 的大肠杆菌高密度发酵
重组菌株JM109DE3_PT7-LysC 和JM109DE3_PT7-preNpro 经过15 h 的高密度发酵,在菌体的OD600值分别为53 和65 时结束培养,可收集获得湿重为65 g/L 和73 g/L的菌体 (图3(a))。Lys-C 和pre-N-pro均以包涵体形式表达,经高压匀浆裂解后,收集得到约12 g/L 粗包涵体。用含低浓度尿素和Triton X-100 的洗涤缓冲液多次洗涤后,去除杂蛋白和细胞碎片,回收得到约4~6 g/L 包涵体。由结果可知,随着诱导时间增加,蛋白表达量逐渐增加。而诱导培养8 h后,蛋白表达量最高,重组菌株JM109DE3_PT7-LysC和JM109DE3_PT7-preNpro 的目标蛋白表达量分别可达菌体总蛋白量的60%和19% (图3(b))。最终,Lys-C 和pre-N-pro表达量分别为2.4 g/L 和0.9 g/L。
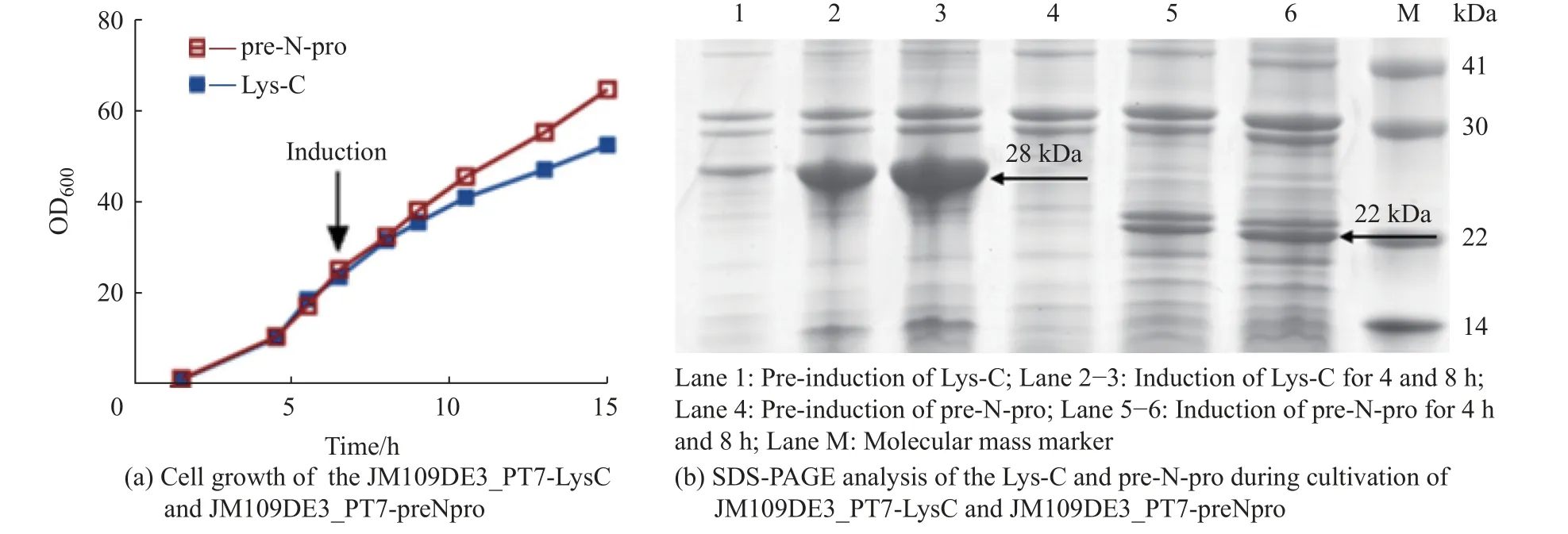
图3 Lys-C 和pre-N-pro 的诱导表达Fig.3 Inducible expression of the Lys-C and pre-N-pro
2.3 Lys-C 包涵体的复性和纯化分析
在包涵体裂解过程中,DTT 常用做二硫键的还原剂,在变性缓冲液中添加DTT 可提高包涵体蛋白的溶解效果。但是DTT 的存在直接影响Lys-C 的复性率:一方面会抑制Cys 残基重新形成二硫键,使得部分Lys-C 仍以变性状态存在;另一方面,会造成Lys-C 中二硫键的错配。本研究通过在复性缓冲液中添加GSH 和GSSG,能一定程度上降低二硫键的错配率,比色法测得Lys-C 复性后的酶活从0.4 U/L提升至0.6 U/L,但复性率仍较低。因此,有必要去除Lys-C 变性液中的DTT,再进行复性操作。本研究采用凝胶过滤层析 (Gel filtration chromatography,GFC) 的方法脱除变性液中的DTT,Lys-C 变性液流经Sephadex G25 层析柱后,蛋白样品先从虚线标记的峰1 流出,DTT 等小分子杂质从峰2 后流出,得到了较好的分离效果 (图4(a))。经凝胶过滤层析后,Lys-C 变性液稀释了近1 倍,DTT 吸收峰处 (Lane 3)无Lys-C 流出 (图4(b)),蛋白回收率可达85.9%。经Sephadex G25 层析柱脱除DTT 后,Lys-C 复性后的酶活提升至3.0 U/L。为进一步提高Lys-C 的酶活,复性缓冲液中除了含有低浓度尿素和甘油这种常规化学添加剂外,还加入了发挥分子伴侣和蛋白聚集抑制剂功能的前导肽pre-N-pro。当复性缓冲液中添加10 mg/L pre-N-pro 时,Lys-C 酶活提升至4.8 U/L。当进一步添加80 mg/L pre-N-pro 时,Lys-C 酶活达到13.8 U/L (图4(c)),是未添加Pre-N-Pro 时酶活的4.8 倍。结果表明,在Lys-C 复性时添加前导肽能显著提升其酶活,但是继续增加pre-N-pro 的添加量,Lys-C 复性液中出现了蛋白沉淀,高浓度的pre-Npro 降低了Lys-C 的复性率,从而导致Lys-C 酶活呈下降趋势。因此,复性缓冲液中pre-N-pro 的最佳添加量为40~80 mg/L。
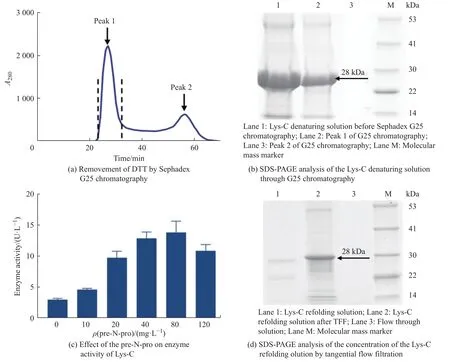
图4 Lys-C 的复性Fig.4 Refolding of Lys-C
经过上述复性操作后,得到的复性液体系被稀释15 倍。而大体积、低浓度的蛋白溶液纯化时间过长,容易导致目标蛋白降解和流穿,影响纯化效果。因此,本研究采用TFF 系统对Lys-C 复性液进行了浓缩,流穿样 (Lane 3) 中几乎检测不到Lys-C,蛋白回收率可达78.2% (图4(d))。
本文通过Ni NTA-Sepharose 亲和层析 (Nickel column affinity chromatography, NCAC) 对浓缩后的Lys-C 复性液进行纯化,纯化结果见表3 和图5。如图5(a)所示,与复性浓缩样 (Lane 1) 相比,洗脱样(Lane 2) 中除了分子量为28 kDa的Lys-C 条带,还存在几条低分子量的杂条带,而对亲和层析后的样品进行超滤浓缩 (Ultrafiltration, UF) 后,得到的超滤样(Lane 3) 中杂条带更为明显,可能是Lys-C 纯化过程中存在自降解现象。为去除超滤样品中小分子量的降解蛋白,本研究选择Sephacryl S-100 层析进行蛋白的进一步纯化。如图5(b)所示,虚线标记的蛋白主峰为Lys-C 的吸收峰,蛋白回收率可达84.8%。最终,经多步纯化后可获得95%纯度的重组Lys-C 样品 (Lane 4),其终产量为48 mg/L。
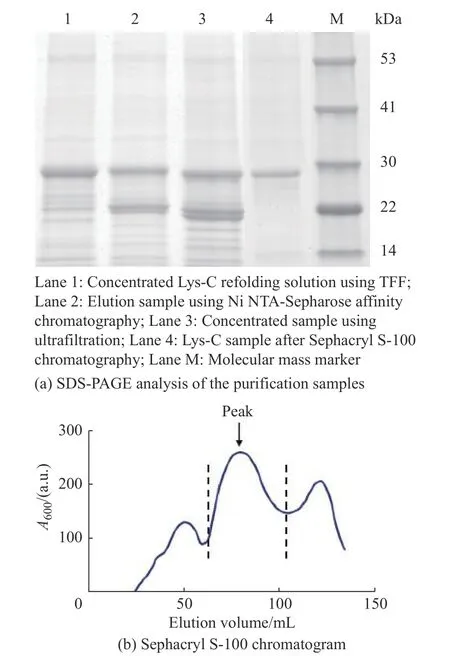
图5 Lys-C 的纯化Fig.5 Purification of Lys-C
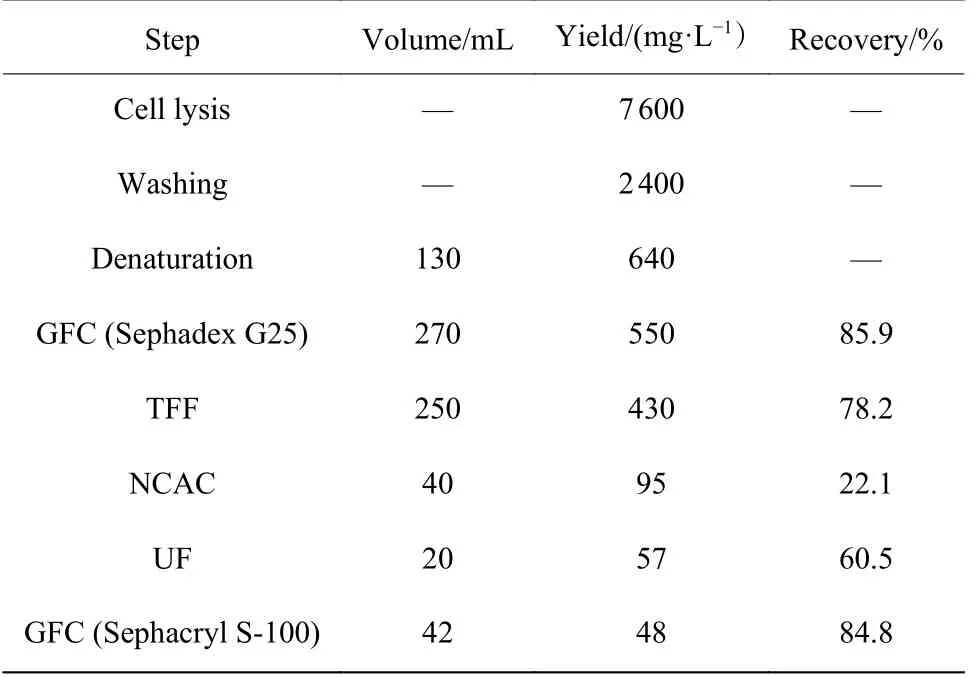
表3 Lys-C 各步纯化结果Table 3 Lys-C purification results of each step
2.4 重组Lys-C 的活性分析
本研究通过酶切三肽和胰岛素前体两种底物对重组Lys-C 的活性进行分析。首先取1 mL 重组Lys-C 样品 (约1 mg),稀释20 倍后,使用比色法测得酶切三肽底物的比酶活为10.2 U/mg,与商用标品具有相近的酶切活性,纯化倍数可达118 倍。另一方面,为进一步验证重组Lys-C 样品的酶切活性,取1 mL重组Lys-C 样品对30 mL 胰岛素前体 (7 mg/mL) 进行酶切,分别在反应0、0.5、4、8 h 和18 h 时取样。随着酶切时间的延长,依次出现了中间产物1、中间产物2 和目标产物,存在明显的酶切先后顺序(图6)。当酶切4 h 时,胰岛素前体绝大部分已转化为中间产物,但未酶切出目标产物,结果表明第1 个酶切位点容易被Lys-C 切开,而第2 个和第3 个酶切位点则较难被切开,酶切速率相对变慢。经18 h 酶切后,重组Lys-C 样品几乎能将所有的胰岛素前体转化为目标产物,酶切转化率可达93.5%。
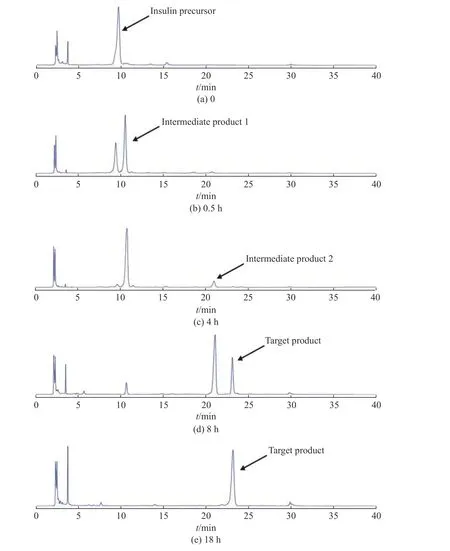
图6 Lys-C 酶切胰岛素前体的HPLC 图谱Fig.6 HPLC chromatograms of the insulin precursor digested by recombinant Lys-C
3 讨 论
本研究探索出了可行的Lys-C 包涵体复性和纯化工艺流程,步骤分别为:(1) 高压匀浆裂解菌体;(2) 多次洗涤包涵体;(3) 8 mol/L 尿素溶解包涵体;(4) Sephadex G25 层析;(5) 添加40~80 mg/L pre-Npro,4~8 ℃复性36 h;(6) TFF 浓缩;(7) NTA-Sepharose层析;(8) 超滤;(9) Sephacryl S-100 层析。最终,纯化获得的重组Lys-C 样品具有较高的酶切活性,且产量高于目前文献报道水平 (表4)。
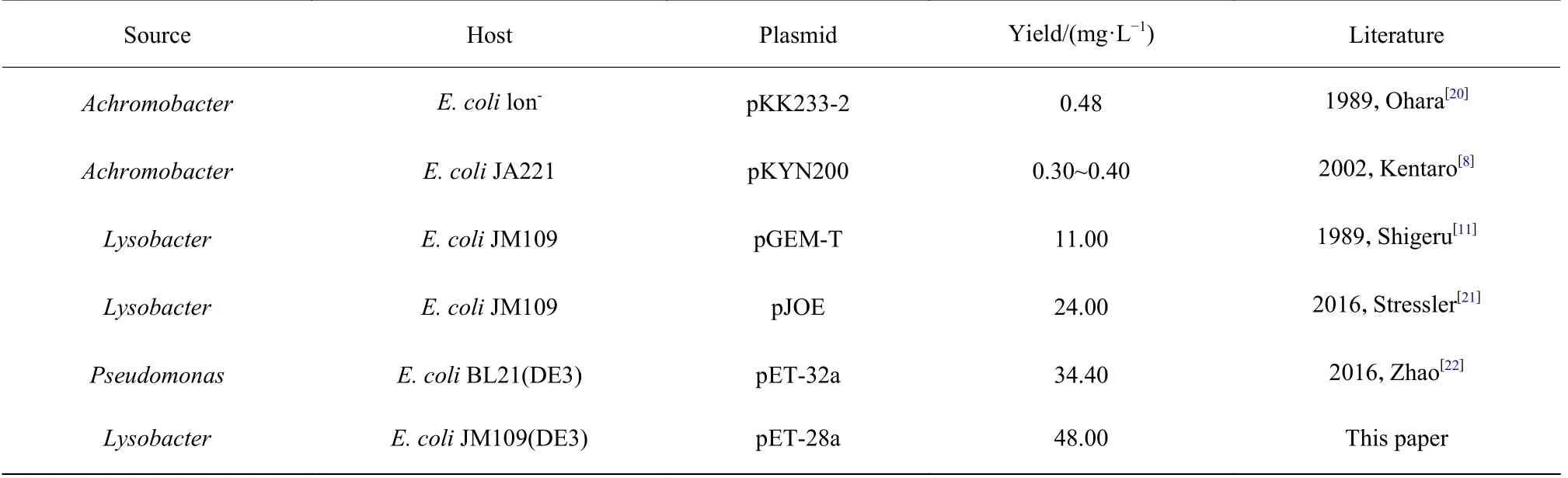
表4 大肠杆菌重组表达Lys-C 的产量结果Table 4 Yield analysis of recombinant expression of Lys-C in E.coli
对于枯草杆菌蛋白酶、α-裂解蛋白酶等蛋白酶,前导肽可作为分子伴侣在体内或体外的蛋白折叠中具有重要功能[19,23]。这种与分子伴侣有相似性质的前导肽称为分子内分子伴侣 (Intramolecular chaperone,IMC),而位于成熟肽N 端的IMC 主要促进三级结构的形成,在体外以游离肽的形式辅助成熟肽重折叠。受此启发,本研究在复性液体系中除加入氧化还原对和化学添加剂外,尝试添加前导肽pre-Npro。pre-N-pro 的添加在缩短复性时间的同时显著提高了Lys-C 的复性率。相较不添加pre-N-pro,Lys-C 酶活提高到4.8 倍。这证明了pre-N-pro对于Lys-C 的正确重折叠确实具有辅助作用,为解决其他蛋白复性率低的问题提供了重要思路。此外,复性后的Lys-C 对pre-N-pro 具有切割活性,大部分的pre-Npro 会发生降解,无需额外的纯化步骤,这简化了Lys-C 蛋白的后续纯化工艺。
本研究发现高活性的Lys-C 容易发生自降解现象,文献报道Lys-C 容易在以下几个位点发生剪切:Lys48/Lys49 (5 kDa 或22 kDa)、Lys203 (6 kDa)、Lys30-Lys155 (13 kDa) 和Lys30-Lys203 (18 kDa)[24]。为了抑制Lys-C 的自降解现象,本研究尝试在复性和纯化过程中添加EDTA 和磷酸盐缓冲液,然而未能达到较好的抑制效果。因此,为了提高Lys-C 的活性收率,后续研究中,我们将对Lys-C 的纯化条件进一步优化,尝试在低温、高盐或酸性溶剂环境下进行柱层析[22]。另外,研究表明对Lys 残基进行化学修饰或定点诱变,或有助于从根源上解决Lys-C 自降解问题[25]。
综上,本研究最终获得了具有较高产量和活性的重组Lys-C,并能有效完成三肽底物及胰岛素前体的准确酶切,取得了Lys-C 工业化生产的阶段性成果,整体策略也为其他包涵体蛋白的复性和纯化提供了重要思路。在未来的研究中,可探索Lys-C 应用于酶切具有技术功能特性的定制化蛋白水解物,或开发更先进的Lys-C 多酶组合酶切方法,进一步扩大其应用价值。
