Sirtuins 基因家族及其剪接体在雌雄小鼠骨骼肌的时空表达谱研究
2023-11-06林晓骏谢社风刘远斌陈冰彤黄宇健
林晓骏,孙 瑜,谢社风,刘远斌,陈冰彤,黄宇健,康 恺,吴 江
( 广东海洋大学滨海农业学院,广东 湛江 524088 )
可变剪接是指个体发育或细胞分化时有选择地越过某些外显子或某个剪接点进行变位剪接,进而形成不同mRNA 异构体的过程。生物体通过可变剪接可以由单个基因产生多个不同的蛋白质异构体,从而导致大量蛋白质变异[1]。因此,可变剪接在动物生长发育和生理代谢等过程中发挥重要的调控作用。可变剪接是调节基因表达和产生蛋白质组多样性的重要机制,是导致真核生物基因和蛋白质数量较大差异的重要原因[2]。可变剪接与牛、羊等动物的重要经济形状的表达相关[3],但其在生物体内的作用机制和在生物进化中发挥的作用还有待进一步探究。
Sirtuins基因家族因其与细胞命运密切相关受到广泛关注[4-6],但目前相关研究在畜牧兽医方面较少。现有研究表明,Sirt1基因的不同剪接体对细胞衰老具有一定影响[7]。有研究结果显示,Sirt1-FL 抑制H2O2诱导的氧化损伤,而Sirt1-ΔExon8 则可促进氧化应激损伤。Sirtuins基因家族对骨骼肌方面的研究主要集中于其在Sirt1/PGC-1α 和AMPK/SIRT/PGC1α 相关能量代谢通路中[8-9]及其在氧化应激中发挥的作用[10]。以往对骨骼肌的相关研究显示,Sirt1 和Sirt2 分别起到诱导对氧化应激的抵抗和动员脂质储存的作用[11-12];Sirt5 能够有效去除赖氨酸羧基修饰,包括丙二酰赖氨酸、琥珀酰赖氨酸和戊二酰赖氨酸,从而对骨骼肌细胞代谢产生影响[13];Sirt6蛋白水平会因其他系统的氧化应激而升高,促进DNA 双链断裂修复以减轻骨骼肌中由于ROS患病率增加而导致的基因组损伤[14-15];Sirt7是一种组蛋白脱琥珀酸酶,在功能上与染色质致密化和基因组稳定性相关[16]。
本研究通过半定量反转录、PCR扩增和琼脂糖凝胶电泳方法检测Sirtuins基因家族候选剪接体在不同周龄小鼠骨骼肌中的表达,发现Sirtuins基因家族候选剪接体的表达与所处周龄、所在部位具有密切的关系,研究结果为深入探究Sirtuins蛋白家族在哺乳动物体内的作用机制和Sirtuins基因家族候选剪接体在不同周龄小鼠骨骼肌中的表达机制提供参考。
1 材料与方法
1.1 试验动物
昆白小鼠由广东海洋大学滨海农业学院动物遗传育种与繁殖实验室提供,饲养于广东海洋大学滨海农业学院清洁级动物房,自主饮食和饮水,温度(22±4) ℃,湿度55%±5%,室内光照明暗周期12 h/12 h。所有试验操作严格遵守动物伦理和动物福利的要求,按照广东海洋大学实验动物管理委员会的相关规定进行试验,伦理委员会审批号:SYXK-2018-0147。选取2、4、6、8 周龄体重均匀健康的小鼠10只,公母各半,共40只小鼠进行试验。小鼠实施安死术后,分离大腿部骨骼肌,放入液氮冻存。
1.2 试剂与仪器
RNA 反转录试剂盒(PrimeSeriptTM feagent Kit with gDNA Eraser-PergectReal Time)购自宝日医生物技术(北京)有限公司;TRIzol 试剂购自天根生化科技(北京)有限公司;100~2 000 bp DNA Marker购自生工生物工程(上海)股份有限公司;2×Easy Taq PCR Super Mix(+dye)购自北京全式金生物技术有限公司;琼脂糖购自BIOWEST公司;核酸染色剂GoldViewTM Nuclic Acid Stain 购自北京鼎国昌盛生物技术有限责任公司。
1.3 样品采集
使用颈椎脱臼法处死雌雄小鼠共40只,快速识别并获取黄豆大小雌雄鼠腿肌各12份,其中用于不同周龄剪接体验证的各3份。分别放入加有200 μL Trizol液的EP管中,-80 ℃保存。运用Trizol法提取小鼠RNA。
1.4 引物设计(见表1、图1)
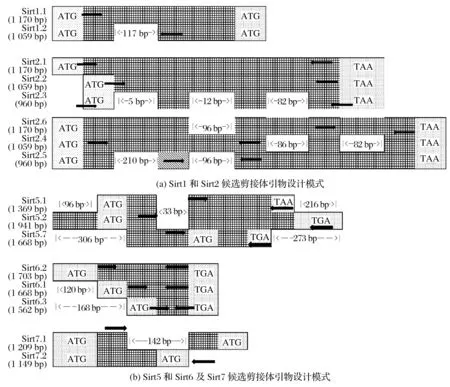
图1 引物设计模式Fig.1 Schematic diagram of primer

表1 qRT-PCR引物信息Tab.1 qRT-PCR primer information
参考NCBI的GeneBank数据库中小鼠的Sirt1~Sirt7基因序列,可知Sirt1基因有2个已证实的剪接体,Sirt2有3个已证实的剪接体和3个预测变体,分别针对不同基因利用Primer Premier 5.0软件设计引物。使用基因所对应引物的名称代替对应Sirt2候选剪接体进行叙述,将NM_019812、NM_001159589 分别用Sirt1.1、Sirt1.2 指代。Sirt5 基因具有6种候选剪接体,Sirt5基因及其候选剪接体序列高度相似。其中候选剪接体1、2、3、4、5 等5 个序列相似度最高,在进行引物设计时,将候选剪接体1、2、3、4、5合并为一个序列进行设计,在碱基序列一致的片段进行引物设计。Sirt6 基因有2 个已证实的剪接体和1 个预测变体,Sirt7 有2 个已证实的剪接体,分别针对不同基因利用Primer Premier 5.0软件设计引物。使用基因所对应引物的名称代替对应Sirt6、Sirt7候选剪接体进行叙述。
1.5 目的基因扩增及表达量鉴定
Trizol 法提取RNA,RNA 反转录试剂盒反转录合成cDNA,PCR 扩增目的条带。PCR 体系:PCR Mix 10 μL、ddH2O 8.2 μL、反转录产物小鼠cDNA 1 μL、内参0.8 μL。Sirt1 及其候选剪接体在94 ℃、3 min 36 s 条件下预变性;94 ℃变性30 s,56.6 ℃退火,72 ℃延伸1 min,35 个循环;72 ℃延伸9 min。Sirt2 及其候选剪接体在95 ℃预变性3 min;95 ℃变性30 s,51 ℃退火30 s,72℃延伸1 min,28个循环;72℃延伸5 min。Sirt5及其候选剪接体在95 ℃预变性3 min;95 ℃条件下变性30 s,Sirt5.1、Sirt5-1.1、Sirt5-1.2 分别在51、60、52 ℃退火30 s,72 ℃延伸1 min,34次循环;72 ℃延伸5 min。Sirt6及其候选剪接体在95 ℃条件下预变性3 min;95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,34 个循环;72 ℃延伸5 min。Sirt7 及其候选剪接体在95 ℃条件下预变性5min;95 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s,34 个循环;72 ℃延伸10 min。β-actin 在95 ℃预变性3 min,95 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s,34个循环;72 ℃延伸10 min。
1.6 数据统计与分析
以不同周龄的小鼠样品与内参基因作对比,每个样品重复3 次。扩增反应结束后采用ImageJ 软件进行条带分析,记录IntDen值。利用Excel软件计算基因相对表达量,SPSS 17.0 软件进行单因素方差分析。结果以“平均值±标准差”表示,P<0.05表示差异显著。
2 结果与分析
2.1 Sirtuins基因家族候选剪接体在雌性小鼠骨骼肌中的表达
2.1.1Sirt1 候选剪接体在雌性小鼠骨骼肌中的表达(见图2)

图2 Sirt1候选剪接体在雌性小鼠骨骼肌中的表达Fig.2 Expression of Sirt1 candidate spliceosome in skeletal muscle of female mice
由图2 可知,2 周龄雌鼠骨骼肌中Sirt1.2 表达量显著高于4、6、8周龄(P<0.05)。
2.1.2Sirt2 候选剪接体在雌性小鼠骨骼肌中的表达(见图3)
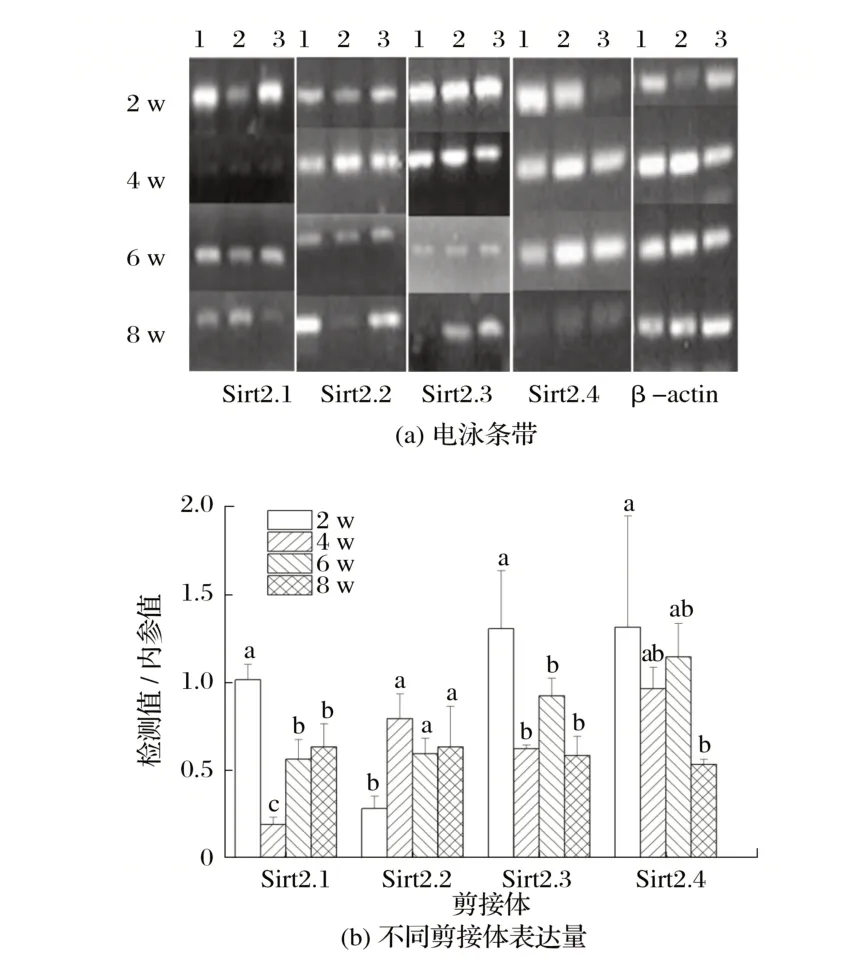
图3 Sirt2候选剪接体在雌性小鼠骨骼肌中的表达Fig.3 Expression of Sirt2 candidate spliceosome in skeletal muscle of female mice
由图3 可知,2 周龄雄鼠骨骼肌Sirt2.1 基因表达量极显著高于4周龄(P<0.01),6和8周龄雄鼠骨骼肌Sirt2.1基因表达量显著高于4 周龄(P<0.05)。4、6 和8 周龄雄鼠骨骼肌Sirt2.2 基因表达量均显著高于2 周龄雄鼠(P<0.05)。2 周龄雄鼠骨骼肌Sirt2.3 基因表达量极显著高于4、6 和8 周龄(P<0.01)。2 周龄雄鼠骨骼肌Sirt2.4 基因表达量极显著高于8周龄(P<0.01)。
不同样品Sirt2.5 和Sirt2.6 基因进行相关电泳结果显示,Sirt2.5 基因PCR 产物长度在250~500 bp,与预期产物大小135 bp 不相符;Sirt2.6 基因PCR 产物长度在500~750 bp,与预期产物大小393 bp不相符,因此可判断预测变体Sirt2.5和Sirt2.6未检出,后文不予讨论。
2.1.3Sirt5 和Sirt7 候选剪接体在雌性小鼠骨骼肌中的表达(见图4)

图4 Sirt5和Sirt7候选剪接体在雌性小鼠骨骼肌中的表达Fig.4 Expression of Sirt5 and Sirt7 candidate spliceosomes in skeletal muscle of female mice
由图4 可知,4 周龄雌性小鼠骨骼肌中Sirt5 表达量显著高于6 周龄(P<0.05);6、8 周龄雌性小鼠骨骼肌中Sirt7的表达量显著低于2、4周龄(P<0.05)。Sirt5的候选剪接体XM_006516951.1、XM_006516952.3、XM_006516953.1、XM_011244413.2、XM_011244412.1、XM_006516954.1 以及Sirt7 的候选剪接体NM_001363439.1 均不表达,后文不再展开讨论。
2.1.4Sirt6 候选剪接体在雌性小鼠骨骼肌中的表达(见图5)
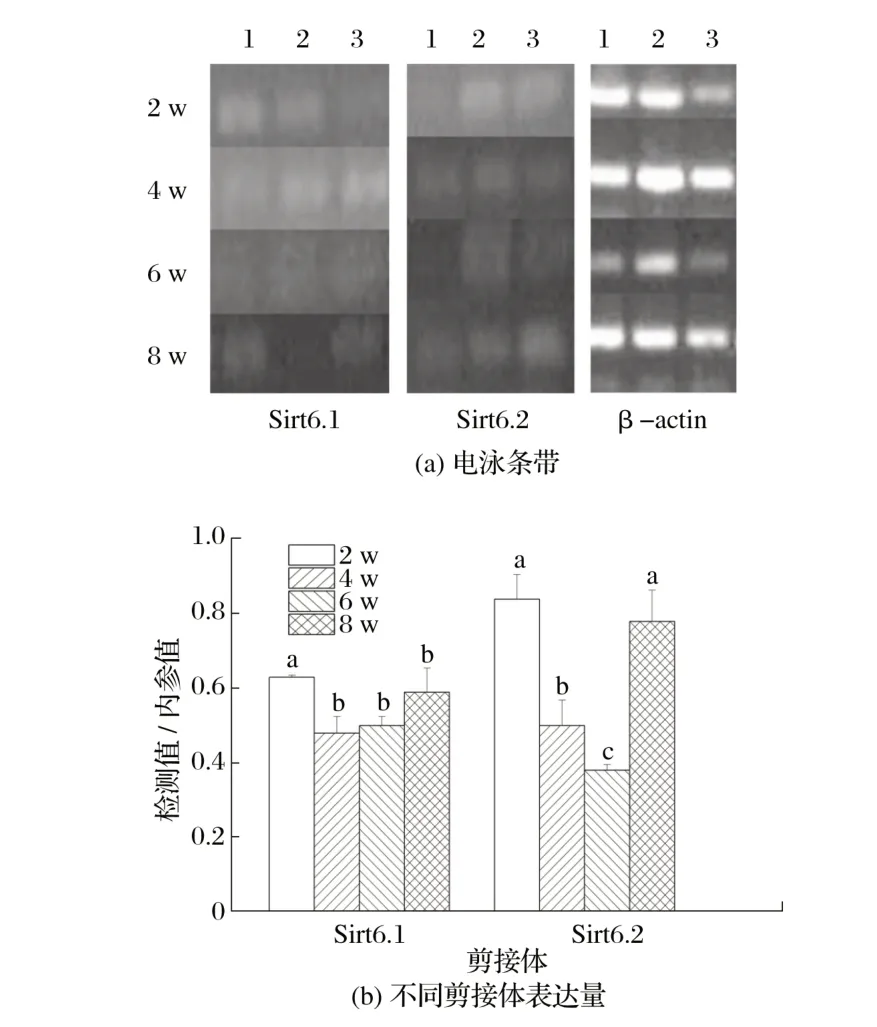
图5 Sirt6候选剪接体在雌性小鼠骨骼肌中的表达Fig.5 Expression of Sirt6 candidate spliceosome in skeletal muscle of female mice
由图5 可知,2 周龄雄性小鼠骨骼肌中Sirt6.1 的表达量显著高于其他周龄(P<0.05)。4周龄雌性小鼠骨骼肌中Sirt6.2的表达量显著低于2、8周龄(P<0.05),6周龄的表达量极显著低于2、8周龄(P<0.01)。
2.2 Sirtuins基因家族候选剪接体在雄性小鼠骨骼肌中的表达
2.2.1 Sirt1 候选剪接体在雄性小鼠骨骼肌中的表达(见图6)
图6 Sirt1候选剪接体在雄性小鼠骨骼肌中的表达Fig.6 Expression of Sirt1 candidate spliceosome in skeletal muscle of male mice
由图6可知,各周龄雄鼠骨骼肌中Sirt1.1、Sirt1.2表达量差异均不显著(P>0.05)。
2.2.2 Sirt2 候选剪接体在雄性小鼠骨骼肌中的表达(见图7)

图7 Sirt2候选剪接体在雄性小鼠骨骼肌中的表达Fig.7 Expression of Sirt2 candidate spliceosome in skeletal muscle of male mice
由图7 可知,6 周龄雄鼠骨骼肌Sirt2.1 基因表达量极显著高于4 周龄(P<0.01),显著高于2、8 周龄(P<0.05);2 和8 周龄雄鼠骨骼肌Sirt2.1 基因表达量显著高于4 周龄(P<0.05)。6 和8 周龄雄鼠骨骼肌Sirt2.2 基因表达量极显著高于2 周龄雄鼠(P<0.01),显著高于4 周龄(P<0.05);4周龄雄鼠骨骼肌Sirt2.2基因表达量显著高于2周龄雄鼠(P<0.05)。6周龄雄鼠骨骼肌Sirt2.3基因表达量极显著高于4和8周龄雄鼠(P<0.01);2周龄雄鼠骨骼肌Sirt2.3基因表达量显著高于4 和8 周龄雄鼠(P<0.05)。6 周龄雄鼠骨骼肌Sirt2.4基因表达量极显著高于2 和8 周龄(P<0.01),显著高于4周龄(P<0.05);4周龄雄鼠骨骼肌Sirt2.4基因表达量显著高于2和8周龄雄鼠(P<0.05)。
2.2.3Sirt5 和Sirt7 候选剪接体在雄性小鼠骨骼肌中的表达(见图8)
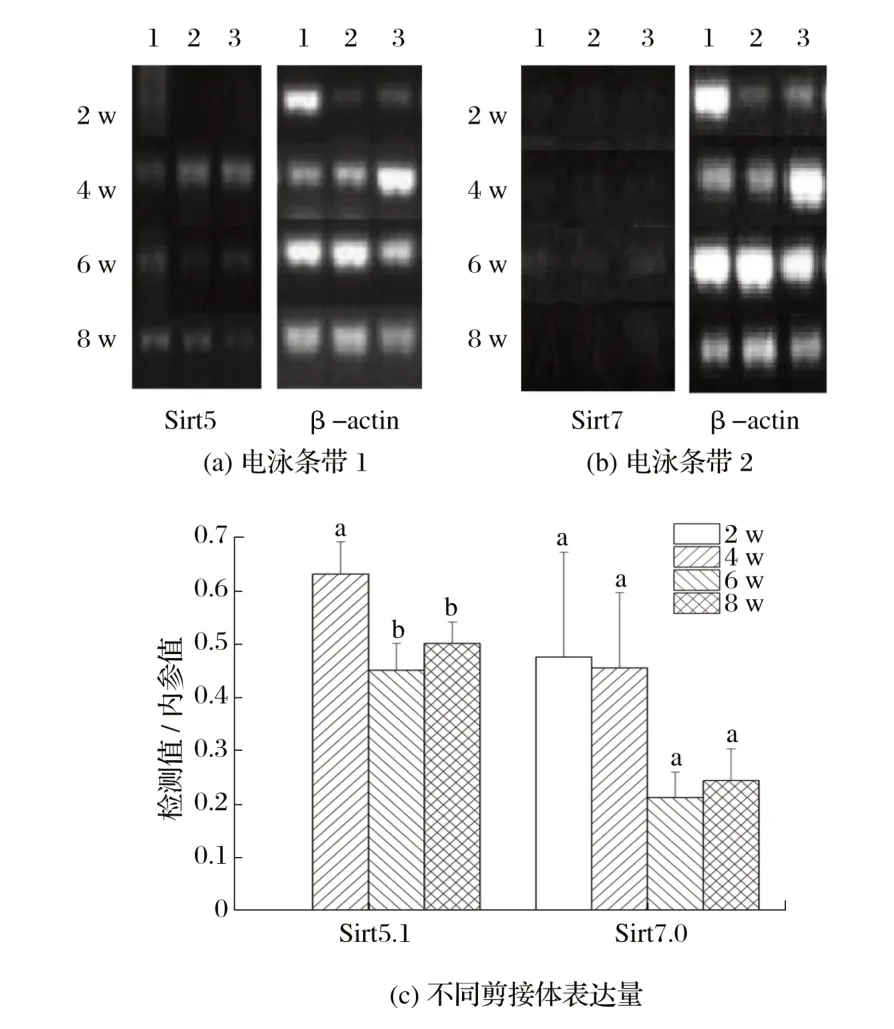
图8 Sirt5和Sirt7候选剪接体在雄性小鼠骨骼肌中的表达Fig.8 Expression of Sirt5 and Sirt7 candidate spliceosomes in skeletal muscle of male mice
由图8可知,Sirt5在2周龄雄性小鼠骨骼肌内不表达,4 周龄时表达量显著高于6、8 周龄(P<0.05);Sirt7 基因在2、4周龄雄性小鼠骨骼肌内表达高于6、8周龄(P>0.05)。
2.2.4Sirt6 候选剪接体在雄性小鼠骨骼肌中的表达(见图9)
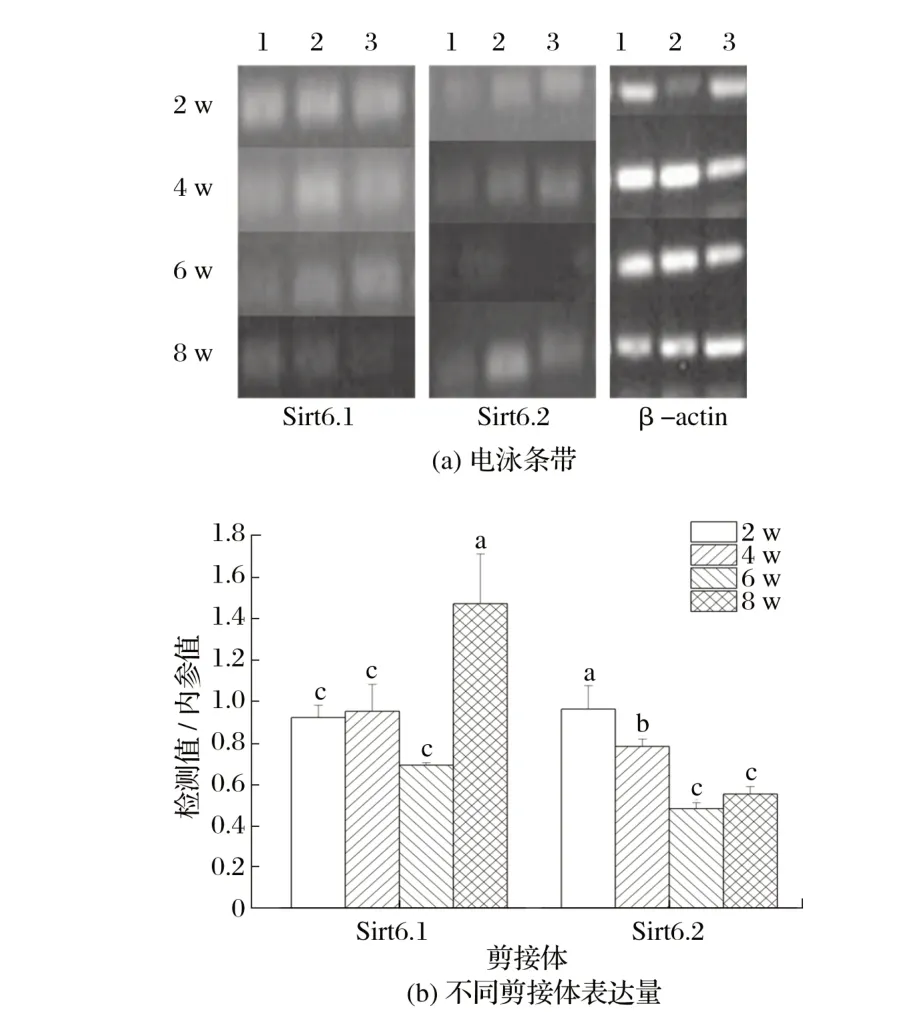
图9 Sirt6候选剪接体在雄性小鼠骨骼肌中的表达Fig.9 Expression of Sirt6 candidate spliceosome in skeletal muscle of male mice
由图9 可知,2、4、6 周龄雄性小鼠骨骼肌中Sirt6.1 表达量差异不显著(P>0.05),均极显著低于8周龄(P<0.01);2 周龄雄性小鼠骨骼肌中Sirt6.2 表达量显著高于4 周龄(P<0.05),极显著高于6、8 周龄(P<0.01);4 周龄雄性小鼠骨骼肌中Sirt6.2表达量显著高于6、8周龄(P<0.05)。
3 讨论
Sirt1是体内重要的能量代谢感受器,可感知机体的能量代谢状态,通过改变下游分子的基因表达或活性调节机体能量代谢过程[17]。Chriett 等[18]研究表明,Sirt1 在猪骨骼肌中的表达水平从胚胎阶段到出生呈逐渐下降的趋势。在本研究中,对于骨骼肌这种耗能较多的组织,Sirt1 候选剪接体在不同周龄的雌、雄小鼠体内均保持较高的表达量,且Sirt1.2 在幼龄阶段表达相对较高,但总体呈随发育成熟表达量逐渐下降的趋势。目前研究表明,随着个体年龄增长的衰老阶段,细胞中NAD 的含量表现出关联下降(可以是由于细胞中NAMPT 水平下降导致),并可能启动细胞内的补偿机制从而导致Sirt1的表达量增加[19-20],因此推测个体发育成熟细胞内NAD水平的增长会抑制Sirt1相关剪接体的表达。
本研究中,Sirt2.1、Sirt2.3、Sirt2.4表达量出现幼龄阶段表达量较高且总体表达量具有随年龄增长降低的趋势,Sirt2.2 在幼龄阶段表达较少,4 周龄后表达量趋于稳定。根据小鼠的生长周期可知,出生至2周龄期间属于哺乳期,满2周龄时开始采食和饮水;出生后4~8周属于生长期,其中雌性性成熟期为35~50 日龄,雄性为45~60 日龄。已有研究表明,Sirt2 负调节C2C12 骨骼肌细胞中的胰岛素抵抗,且抑制Sirt2 也会增强细胞中的葡萄糖摄取[21],这可能是Sirt2.1、Sirt2.3、Sirt2.4 随发育成熟表达量逐渐下降的原因。本研究中,Sirt2的不同剪接体在骨骼肌组织中呈现不同的表达规律,推测Sirt2不同候选剪接体在骨骼肌发育过程中可能发挥着不同的作用,具体原因还有待进一步探究。
Sirt5 与能量代谢密切相关[22]。本试验中,Sirt5 在4 周龄雄性小鼠骨骼肌中表达量显著高于6、8 周龄;在2、4、8周龄及2、6、8周龄组间雌性小鼠骨骼肌中的表达量差异均不显著,4 周龄雌性小鼠骨骼肌中的表达量显著高于6周龄。王利红等[23]研究发现,母猪Sirt5蛋白表达量总体低于公猪。本试验结果也呈现雄性表达量略高于雌性的现象。Ryu等[24]研究表明,Sirt7与乳酸积累、运动表现密切相关。Chriett等[18]研究表明,Sirt7在猪骨骼肌中的表达水平与年龄增长呈现负相关关系。本试验中,Sirt7在不同性别的小鼠骨骼肌中的表达均呈现随年龄增长下降的趋势,且在6周龄时出现明显下降,总体上表达量保持稳定。
现有研究表明,Sirt6 作为一种赖氨酸-脱乙酰酶和单-ADP-核糖基转移酶,具有多效性作用[25],但Sirt6 在代谢中的作用存在争议。如Sirt6 基因敲除小鼠表现出脂肪组织质量减少和低血糖[26]。Sirt6 缺乏还导致Sirt6 依赖性转录沉默减弱,导致参与糖酵解和葡萄糖转运的基因表达增加[27]。此外,Sirt6能够提高骨骼肌的胰岛敏感性从而降低血糖和治疗肥胖[28]。
本研究对雄鼠骨骼肌的检测结果表明,2周龄时,雄鼠骨骼肌中Sirt6.1表达量开始下滑,到第6周龄结束,第8周时表达量突然上升达到最大值;Sirt6.2 的表达量则是在2周龄时达到最大,之后随着年龄增长而下滑,到8周龄时出现上升迹象。在对雌鼠骨骼肌的检测表明,各周龄组Sirt6.1的表达量均保持在较高水平,2周龄时表达量最大,随着年龄增长表达量稍微下滑,到第8周龄时有所回升;在雌性骨骼肌中Sirt6.2 表达量在2 周龄时最大,随着年龄增长有大幅度下滑的迹象,但在8 周龄时有回升,这可能与Sirt6随着年龄增长所需要能量的高低有关。
4 结论
本研究结果显示,Sirt1.1 和Sirt1.2 的表达量随周龄增长呈下降趋势,6周龄时最低;Sirt2在2~8周龄小鼠骨骼肌中广泛表达,其中Sirt2.4在小鼠各组织中PCR产物长度与预期产物大小相符,有表达且表达量较高;4周龄组雌性骨骼肌中Sirt5的表达量显著高于6周龄组;Sirt6的两个已知变体Sirt6.1、Sirt6.2在小鼠骨骼肌中较高表达,表达量随着周龄增长而波动,表达量在第2周达到最高,随年龄增长而下降,到第8周龄时出现回升的迹象;2、4周龄小鼠的骨骼肌中Sirt7基因表达量较高,6、8周龄小鼠的骨骼肌中Sirt7基因表达量较低,提示随着小鼠年龄增加,Sirt7 基因表达水平逐渐降低。
本研究成功从雌雄小鼠骨骼肌中克隆得到Sirtuins家族成员的10种剪接体,并结合时空表达谱进行分析,为后期研究Sirtuins家族不同剪接体发挥的作用奠定了基础。
