关于助听器监管现状的几点思考
2023-11-05赖锦坝姜祁翎吴林蔚陈虹蓁广东省药品监督管理局审评认证中心广东广州510080
赖锦坝 姜祁翎 吴林蔚 陈虹蓁 广东省药品监督管理局审评认证中心 (广东 广州 510080)
内容提要: 对助听器与消费产品的界定、助听器的审批、非处方助听器、助听器电磁兼容标准、助听器家用标准执行、助听器软件性能等现状进行思考,对比我国助听器与美国食品药品监督管理局法规、IEC标准的监管差异,分析当前我国在助听器监管中存在的主要问题,提出对我国助听器监管的建议和意见。
根据世界卫生组织于2021年发布的《世界听力报告》[1],听力损失影响全球超过15亿人,其中约有4.3亿人为中等程度以上听力损失。到2050年,预估至少7亿人听力损失需要康复服务。助听器是解决听力损失的有效辅助手段。但在全球只有约6800万人真正使用助听器,有需求但未配戴助听器覆盖缺口为83%(约3.3亿人)。即便在高收入国家也有近四分之三为有需求但未配戴助听器者[2]。较低的助听器覆盖率说明了助听器面临的挑战,包括:对听力损失缺乏正确的认识以及存在歧视,助听器专业服务人员缺口较大,助听器高昂的成本负担等。其中暴露出助听器监管体系存在的问题,值得深思。
1.助听器与消费产品的界定
美国于2022 年8 月发布了《助听器和个人扩音产品的监管要求》[3]。助听器和个人扩音产品(Personal Sound Amplification Products,PSAPs)都为用户放大声音,但这两种产品有不同的预期用途。助听器是用来弥补听力受损的;PSAPs是为听力正常的人在特定环境中(例如在进行观鸟或狩猎等娱乐活动时)放大声音而设计的,PSAPs被定位为电子设备而不是医疗器械。表1中列举了我国与美国在听力产品方面的对比情况。从表1中可以看出,美国明确了医疗用途与非医疗用途的听力产品的监管要求;我国对具有明确医疗用途(用于听力损失患者的听力补偿)的助听器的监管是比较明确的,但个人扩音产品(比如,辅听耳机)缺少明确的定义及监管要求。为此,我国有必要进一步细化对辅听耳机的要求,对辅听耳机的使用人群、输出参数限制、标签要求、效果宣传等作出明确的规定。如辅听耳机明确宣称产品用于轻度或者中度听力障碍人群,建议生产企业向药监局提交医疗器械分类界定,明确产品的类别。对于未有获得医疗器械注册证,但在广告或宣传中宣称医疗用途的辅听耳机产品,监管部门亟需加大查处力度,保证消费者的听力健康。对于助听器验配软件,当前未有公开的分类文件,建议相关企业对其进行分类界定,监管部门经评估后确定产品类别并对外公开。
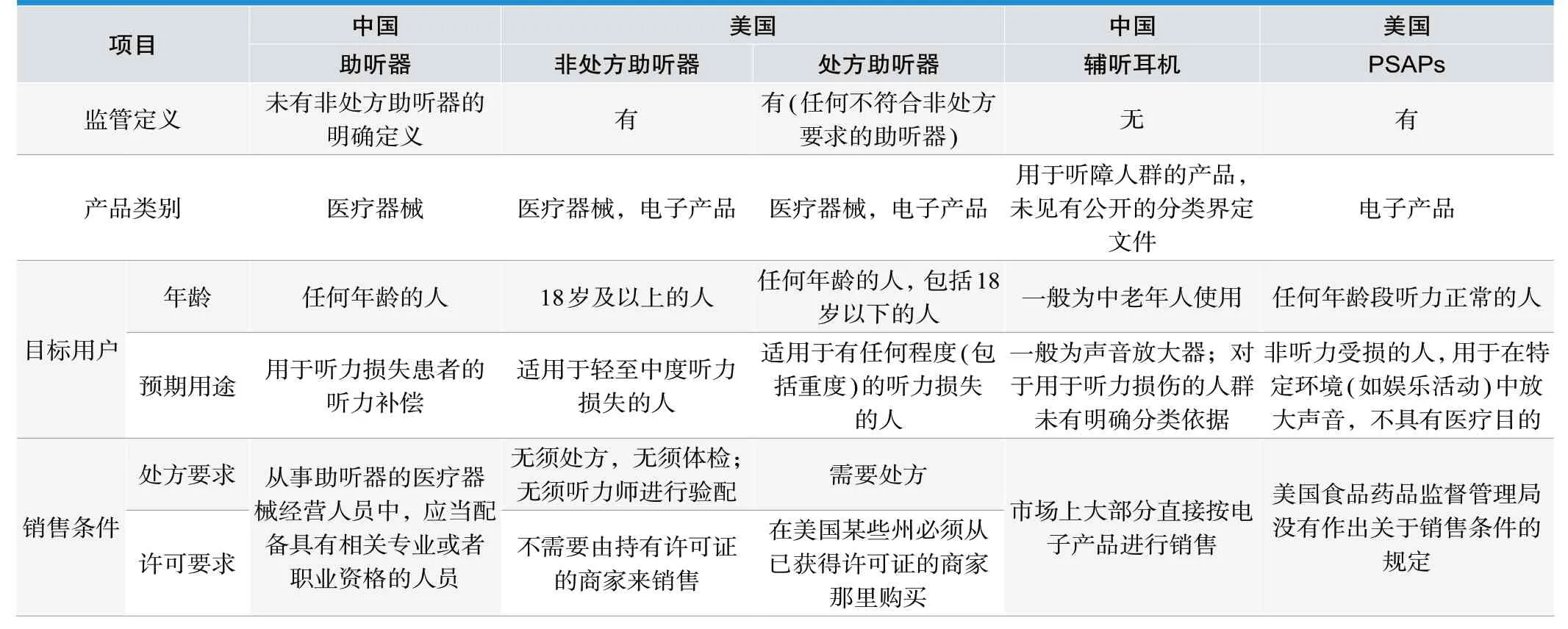
表1.中国与美国的听力产品的对比
2.助听器的审批
作为医疗器械管理的助听器,在审批要求上,我国与美国也有差异,见表2。美国细化了各种情形的分类,包括气导与骨导,植入与非植入,处方与非处方,无线与非无线,自验配与非自验配,监管类别比较明确。而我国的医疗器械分类编码以是否植入作为主要分类因素,植入式骨导助听器是Ⅲ类产品,分类编码12-03-01。非植入的助听器,属于Ⅱ类医疗器械,分类编码19-01-07。
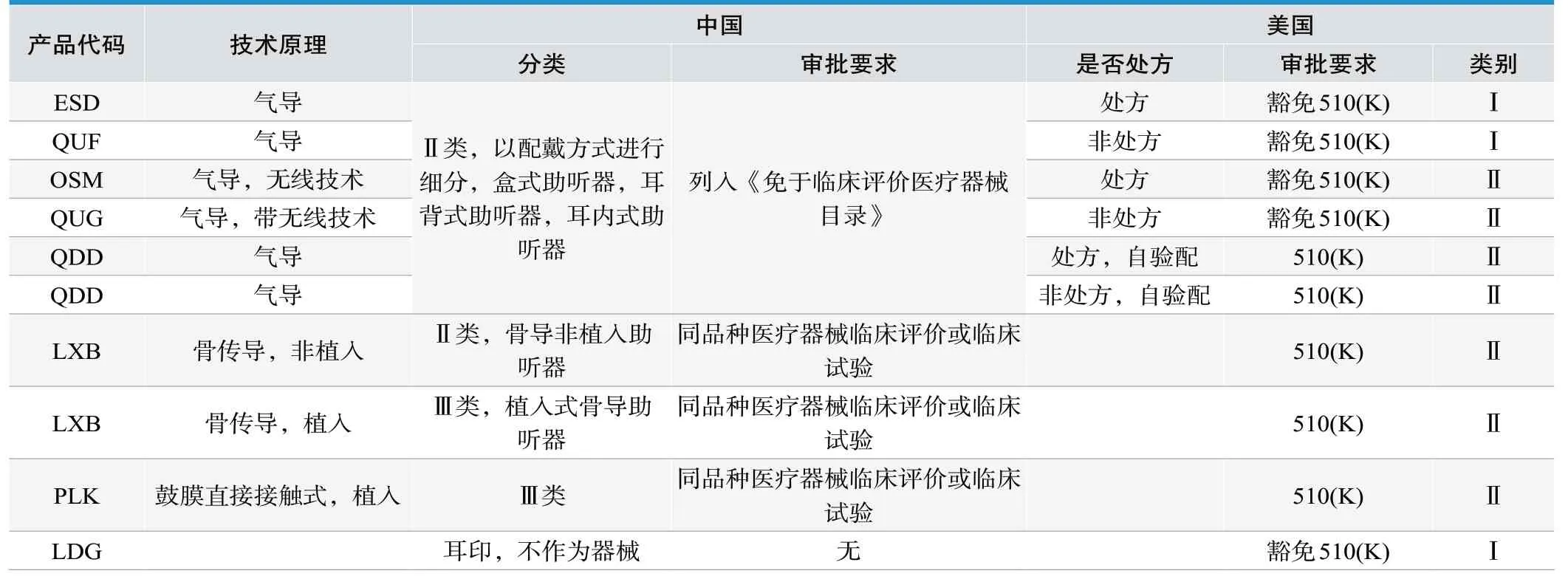
表2.中国与美国的助听器审批情况
在审批要求上,美国总体也是按照风险等级,比如植入类的助听器需要进行510(K),而技术相对成熟的且非自验配的气导助听器是豁免510(K)。在我国,气导产品属于《免于临床评价医疗器械目录》的产品,骨导助听器需要进行临床评价或临床试验。我国主要从技术原理上将气导产品纳入免临床目录;美国更关注助听器自验配情形,对自验配的产品进行相对严格的审批要求。为此,我国在助听器产品审批监管中,可以强化对临床效果的要求,注重用户听力效果的提升。对于自验配的情况,我国有必要出台自验配技术相关的术语及技术参数,提供统一的听力测试方法和测试平台,明确自验配的操作规范,提升自验配使用者的听力专业知识,并持续关注自验配产品对听力效果的影响。
3.非处方助听器
美国非处方助听器草案出台之前,助听器由听力师出具处方并由专业人士进行验配的,这种被普遍认为更有利于听力效果的保证。但是,这个过程需要专业的技术人员及较复杂的验配流程,使得助听器的成本偏高,助听器的普及率极低。为此,美国于2021年发布了非处方助听器的草案,并于2022年8月正式发布非处方助听器的最终法案。非处方助听器不需要专业建议、验配、调整或维护技术,消费者可以在普通商店(或者网上)购买更低成本的助听器,美国食品药品监督管理局预计每年节约6300万美元的助听器购买成本[4]。非处方助听器的主要特点见表3。
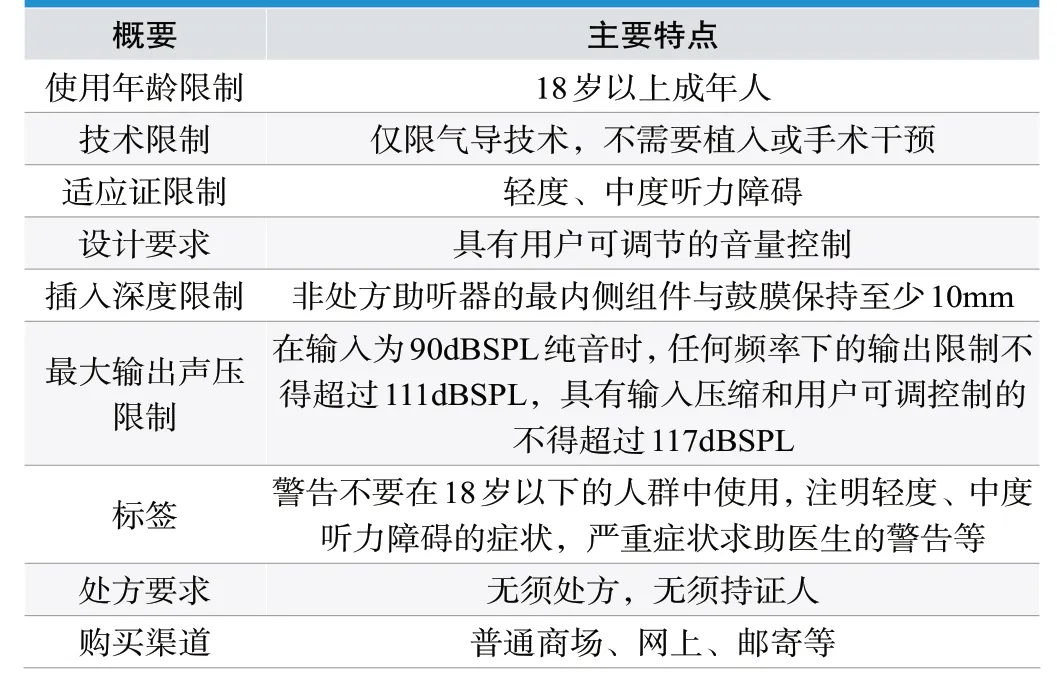
表3.非处方助听器的主要特点
美国非处方助听器最终法案的发布和执行,为我国助听器监管提供很好的思考。一方面,我国可以对严重听力障碍人群使用助听器进行明确的规定,包括必须由听力师进行听力测试,并由具有助听器验配师资格证的专业人员进行验配。另一方面,对国内网上直接销售的助听器(实际上相当于非处方助听器)进一步明确监管要求,对网上销售的助听器明确技术原理、技术参数、使用人群、适应证的监管要求,强化患者使用助听器的安全性和有效性。当然,对于非处方助听器能否达到助听的效果,还需要持续的跟踪,并及时调整政策要求。郗昕等[5]完成了14例自主验配(使用者操控)与常规验配助听器(听力师优化验配)的短期效果评估,两类助听器的听力补偿和言语识别助益均高于未助听时,两类助听器之间无显著差别。这虽然是短期效果、较少例数的验证,但也在一定程度上说明非处方助听器还是有助听的效果。生产企业以及临床研究者可以持续关注非处方助听器的效果研究。我国的验配师数量明显满足不了国内助听器的市场需求。综上,我国有必要参考美国FDA的方式建立非处方助听器的监管模式,为更多的群体提供买得起、听得清的助听器。
4.助听器电磁兼容标准
GB/T 25102.13-2010是我国助听器电磁兼容的专用标准,该标准等同于IEC 60118-13:2004,也就是第一版国际标准。目前,最新标准IEC 60118-13:2019已是第5版,该版本相对于第4版IEC 60118-13:2016,修改了标准名称(由电磁兼容性改为对移动数字无线设备的电磁抗扰度要求),删除了发射辐射的要求,修改了对抗扰度试验的符合性准则,对助听器的测试位置进行较大改动[6]。助听器的辐射骚扰对无线及其他设备的影响风险较小,在我国《助听器注册技术审查指导原则(2016年修订版)》中,推荐执行电磁兼容专用标准GB/T 25102.13-2010。GB/T 9706.266正在制订,其修改采用的IEC 60601-2-66:2019[7]要求执行电磁兼容通用标准YY 9706.102以及专用标准GB/T 25102.13。
由此可见,GB/T 25102.13-2010已经远远落后于最新国际标准,并且在是否执行通用标准YY 9706.102上有争议,我国监管部门亟需在助听器电磁兼容执行标准中统一尺度。建议:①尽快发布实施最新版的GB/T 9706.266和GB/T 14199。②GB/T 9706.266和GB/T 14199在电磁兼容采纳标准上保持一致。③根据产品风险,在执行电磁兼容标准过程中,对于无线技术的助听器或可充电的助听器,建议执行通用标准YY9706.102以及专业标准GB/T 25102.13;对于其他类型助听器,重点执行对无线设备电磁抗扰度要求的专用标准GB/T 25102.13。④明确骨导助听器的电磁兼容执行要求。
5.家用标准
助听器用于患者各种环境场所的听力补偿,包括家庭、学校、室外等环境,符合YY 9706.111-2021(修改采用IEC 60601-1-11:2015)中关于家庭护理环境的规定,需要执行YY 9706.111的相关要求。然而,IEC 60601-2-66:2019在审查了IEC 60601-1-11后,认为该标准在制订的时候未将助听器考虑在内,导致很多条款不适用于助听器。很多助听器企业认为,助听器应该放弃执行YY 9706.111,而直接执行IEC 60601-2-66(或者国内转换标准)。这种方式值得商榷,助听器是属于YY 9706.111定义的范围的,该标准并未将助听器纳入不适用的范围。因此,助听器建议执行YY 9706.111,由检测机构对该标准进行完整的检测,判定不适用项;部分条款如不适用,可根据专用标准IEC 60601-2-66的相关条款进行解释说明。考虑到IEC 60601-2-66正在转换国内标准,且执行期相对于并列标准YY 9706.111要延后一年或者更多时间,因此建议,对于引用IEC 60601-2-66进行解释YY 9706.111的不适用项的,需提供第三方检测或提供经验证的证明性资料。
6.助听器软件性能
随着非处方助听器法案的执行,以及无线蓝牙技术的应用,更多的电子厂家进入助听器行业,带来助听器算法的提升,也带来监管的挑战。一是生产企业未列明助听器所包含的全部软件功能,如自动降噪功能、动态声反馈抑制、频率压缩、言语增强、回声处理、多通道处理、无线双耳传输等。二是当前国内没有统一的软件性能的定义和检测方法。为此,生产企业作为主体责任人,需在产品技术要求列明所有功能中并进行检测。对软件性能的检测,可以参照IEC标准进行制定,如IEC 60118-15:2012《电声学.助听器.第15部分:用类语音信号测试表征助听器信号处理特性的方法》[8]。对于未有明确检验方法的软件功能,企业需自定义检验方法,并说明合理性,建议由第三方检测机构进行评价。监管部门也有必要加快IEC 60118系列标准的立项效率,提高助听器软件等性能的整体水平。
7.小结
总体而言,我国当前助听器的监管体系还是相对合理的,也未有重大不良事件报告。但是,助听器在监管类别上还是不够细致,在标准制定上与国际标准还有差距。为此,我国应该细化对助听器的监管要求,重视患者的助听器验配效果,统一助听器标准的执行尺度,加快助听器相关国际标准的转化速度,及时修订并发布最新版的助听器注册技术审查指导原则。
