希瓦氏菌协同铁氧化物/蒙脱石复合体对铀酰离子的去除研究
2023-11-03谢龙悦郑志勤翟帆帆胡璇杜小波马瑛边亮
谢龙悦 郑志勤 翟帆帆 胡璇 杜小波 马瑛 边亮

摘要:为了降低U(VI) 在水中的溶解性,缩小铀污染的可迁移范围,将蒙脱石改造为铁氧化物/蒙脱石并与希瓦氏菌MR-1(Shewanella oneidensis MR-1)构成联合体系,以实现在厌氧条件下对U(VI)的生物还原。制备了铁氧化物/蒙脱石复合体并对其形貌结构进行了表征;分析了矿物-微生物联合还原体系中U(VI),Fe(II)含量的变化和矿物-微生物-腐殖酸联合体系中U(VI),Fe(II)含量的变化;讨论了矿物-微生物联合体系对U(VI)的生物还原过程及还原途径。结果表明:蒙脱石在合成为铁氧化物/蒙脫石后,其层状结构变化不大,但引入了含量不等的Fe,其中纤铁矿中引入的Fe原子含量最高(67.71%);在矿物-微生物联合体系中,纤铁矿/蒙脱石联合希瓦氏菌MR-1体系对 U(VI)的还原能力最高,在铀浓度50 mg·L-1处理组中的还原率为85.8%,Fe(II)的含量与U(VI)浓度呈反比关系,在反应的0~3 h时迅速上升;在矿物-微生物-腐殖酸复合体系中,腐殖酸浓度对还原U(VI) 的影响表现为“完全促进”“低促高抑”和“高促低抑” 3种现象,对联合体系中的Fe(II)的影响主要分为抑制和促进两种类型。铁氧化物/蒙脱石与希瓦氏菌MR-1构成的联合体系在厌氧条件下能够实现对U(VI)的生物还原。
关键词:希瓦氏菌MR-1 铁氧化物/蒙脱石U(VI) 生物还原 腐殖酸
中图分类号:Q939.11;X591文献标志码:A文章编号:1671-8755(2023)03-0048-10
Removal of Uranyl Ions by Iron Oxide/Montmorillonite Complex
in Cooperation with Shewanella Oneidensis MR-1
XIE Longyue1, ZHENG Zhiqin2,3, ZHAI Fanfan1, HU Xuan1, DU Xiaobo2,
MA Ying2, BIAN Liang4,5
(1.School of Life Science and Engineering, Southwest University of Science and Technology, Mianyang
621010, Sichuan, China; 2. Key Laboratory of Medical Transformation of Nuclear Technology, NHC,
Mianyang Central Hospital, Mianyang 621000, Sichuan, China; 3. Fundamental Science on Nuclear Wastes
and Environmental Safety Laboratory, Mianyang 621010, Sichuan, China; 4. School of Environment and
Resource, Southwest University of Science and Technology, Mianyang 621010, Sichuan, China; 5. State
Key Laboratory of Environmentfriendly Energy Materials, Mianyang 621010, Sichuan, China)
Abstract: In order to reduce the solubility of U(VI) in water and the migratory range of uranium pollution, montmorillonite was transformed into iron oxide/montmorillonite and formed a consortium with Shewanella oneidensis MR-1 to achieve bioreduction of U(VI) under anaerobic conditions. The iron oxide/montmorillonite composite was prepared and its morphology and structure were characterized. The changes in U(VI) and Fe(II) contents in the mineral-microbe consortium and mineral-microbe-humic acid consortium were analyzed. The bioreduction process and pathway of U(VI) in the mineral-microbe consortium were discussed. The results show that after synthesizing montmorillonite into iron oxide/montmorillonite composite, the layer structure of montmorillonite has little change, but different amounts of Fe are introduced. And the highest content of Fe atoms is introduced by lepidocrocite (67.71%). In the mineral-microbe consortium, the lepidocrocite/montmorillonite consortium with Shewanella oneidensis MR-1 has the highest U(VI) reduction ability, and the reduction rate is 85.8% at a uranium concentration of 50 mg·L-1. The content of Fe(II) is inversely proportional to the concentration of U(VI), and it rises rapidly from 0 to 3 hours of reaction. In the mineral-microbe-humic acid composite system, the effect of humic acid concentration on the reduction of U(VI) exhibits three phenomena: “complete promotion” “low promotion and high inhibition” and “high promotion and low inhibition”. The impact on Fe(II) in the composite system is mainly divided into two types: inhibition and promotion. The consortium of iron oxide/montmorillonite and Shewanella oneidensis MR-1 can achieve the bioreduction of U(VI) under anaerobic conditions.
Keywords: Shewanella oneidensis MR-1; Iron oxide/montmorillonite; U(VI); Bioreduction; Humic acid
在环境问题中土壤污染问题尤为突出[1-2]。随着核能源的开发与使用、核武器的研发与试验,生成了大量的放射性核废物(铀)[3],少部分未有效净化的污染物排放到环境中,使得土壤污染问题更加复杂。铀污染土壤的特征有高毒性、累积性、隐蔽性、滞后性和难降解等特点[4],铀经食物链在生物(植物、动物)体内积累,最后到达人体,威胁人类生命安全[5]。铀存在多种价态(III,IV,V和VI),其中U(III)和 U(V)非常活泼,不能稳定存在于环境中,在地质环境中仅有U(IV)和U(VI)稳定存在。U(VI)主要以铀酰离子(UO22+)形式存在,因为其离子半径大(3.20×10-8 cm)易溶于水而易迁移,离子半径相对较小的 U(IV) (1.05×10-8 cm)则难溶于水[6]。因此,在铀污染地区需要一种绿色、高效的方法将U(VI)还原为U(IV),用于防止铀污染范围进一步扩大[7]。
用于铀污染环境的修复方法主要包括物化法和生物法[8]。其中生物法环境干扰小,不产生二次污染,被认为是最环保有效的修复技术。研究发现各种异化金属还原菌能利用氧化金属(Fe(Ⅲ),Mn(Ⅵ) 和U(Ⅵ)等)作為电子受体,以有机酸等作为电子供体获得能量,最终实现金属价态和状态的改变[9-11]。细菌还可以通过细胞外电子转移[12]、细胞膜结合蛋白[13]、还原酶[14]等对高价态重金属进行固定还原。
微生物在土壤中常常附着在含铁黏土矿物上,微生物和铁矿物相互作用共同促进环境中的铁循环并减少环境污染物。一方面黏土矿物(蒙脱石)含有可交换的阳离子和表面上可吸附的阴离子,可作为有害离子处理的吸附剂,含铁黏土矿物(铁氧化物)表面含有丰富的铁羟基基团,对土壤中的污染离子具有较强的固定能力[15];另一方面含铁黏土矿物中的结构铁Fe(III)可被异化金属还原菌还原,而结构亚铁Fe(II)可减少环境中的污染物(如重金属、有机物、核素),改变其毒性和迁移率。
腐殖质由含有多种官能团(羟基、氨基、羧基等)的芳香环构成,具有较大的比表面积和可变电荷[16-17],能与土壤中的重金属离子通过离子键、共价键及螯合键的方式结合,进而吸附、络合和还原重金属离子,达到去除污染离子的作用。研究表明腐殖酸在金属还原微生物的代谢过程中有助于提升金属还原微生物对高价金属离子的还原效率[18]。
本研究以蒙脱石为材料,合成了3种铁氧化物/蒙脱石(纤铁矿/蒙脱石、赤铁矿/蒙脱石、针铁矿/蒙脱石),并分别与希瓦氏菌MR-1(Shewanella oneidensis MR-1)构建了矿物-微生物联合体系,使其对U(VI)进行生物还原。为了增强矿物-微生物联合体系对U(VI)的还原能力,设计了矿物-微生物-腐殖酸联合还原体系。最后,根据研究结果讨论了矿物-微生物联合体系对U(VI)的生物还原途径。
1材料与方法
1.1铁氧化物/蒙脱石的制备
合成了针铁矿/蒙脱石、纤铁矿/蒙脱石、赤铁矿/蒙脱石。
蒙脱石的处理:称取50 g蒙脱石(上海阿拉丁生化科技股份有限公司),分别用95%乙醇、去离子水清洗数次。根据颗粒的沉降速度,用虹吸法吸取小于2 μm的颗粒,使用真空冷冻干燥。最后用玛瑙研钵研磨,保存于带干燥硅胶的干燥器中,待用。
针铁矿/蒙脱石的制备:称取0.05 mol洗脱干燥后的蒙脱石和FeCl3·6H2O,分别溶于50 mL去离子水中,随后将二者混匀,使用0.45 mol·L-1的NaOH溶液定容至1 L,于70 ℃ 孵育60 h。自然冷却至室温,并用去离子水反复洗涤数次,离心(8 000 r/min,5 min),真空冷冻干燥24 h[19]。
纤铁矿/蒙脱石的制备:称取0.05 mol洗脱干燥后的蒙脱石和FeCl3·6H2O,分别溶于50 mL去离子水中,随后将二者混匀,将其稀释到500 mL,转移到密闭容器中,在70 ℃ 环境中保持48 h,期间pH值从1.7降至1.2,产生黄色沉淀,用去离子水洗涤数次,离心(8 000 r/min,5 min),真空冷冻干燥24 h[19]。
赤铁矿/蒙脱石的制备:称取0.05 mol洗脱干燥后的蒙脱石和FeCl3·6H2O,分别溶于50 mL去离子水,随后将二者混匀,滴加150 mL已加热到90 ℃ 的1 mol·L-1 NaOH,再加入25 mL 1 mol·L-1已加热到90 ℃ 的NaHCO3,用90 ℃ 去离子水将其稀释到500 mL,并放入加盖的聚丙烯容器中密封,在90 ℃ 下老化48 h。用去离子水洗涤数次红色沉积物并离心(8 000 r/min ,5 min),真空冷冻干燥24 h[19]。最后将干燥得到的固体用玛瑙研钵磨细,保存于干燥器中。
1.2铁氧化物/蒙脱石的结构表征
采用场发射扫描电子显微镜(Scanning electron microscope,SEM)进行样品形貌分析:取少量样品粉末于导电胶表面,在真空下进行镀金,通过SEM(Uitra55,德国蔡司)进行观察,其中加速电压为10~20 kV,激发电子束为30~40 μA。
利用能量色散-X射线光谱仪(Pure,荷兰Phenom)对铁氧化物/蒙脱石中的主要元素进行分析。
采用X 射线衍射仪(XRD,XPert PRO,荷兰帕纳科)进行物相分析:粉末压片法(将烘干保存的样品用玛瑙研钵磨细至200 目以下,样品量约1 g),功率1 400 W(管压40 kV,管流40 mA),扫描范围10°~80°(2θ),步长0.02°,扫描速度0.02°/s。
利用傅里叶红外光谱分析仪(FT-IR,IRSpirit-T,日本)对矿物结构进行分析:取适量样品粉末与无水KBr(质量比1∶100)于玛瑙研钵中研磨混合均匀,取约0.003 g混合后样品压片进行测试。扫描范围400~4 000 cm-1,最高分辨率 0.4 cm-1,波速精度0.01 cm-1,扫描速度:0.158 1~3.164 7 cm·s-1,扫描次数50次。
1.3U(VI)还原体系的搭建
将希瓦氏菌MR-1于LB培养基中培养后离心分离(6 000 r/min ,10 min),用无菌碳酸氢钠缓冲液(浓度为30 mmol·L-1 NaHCO3,pH=7.3)将菌体洗涤两次,并悬浮细胞至1×109 个·mL-1(OD600=0.8)。并加入到无机盐培养基(10 mmol/mL乳酸钠,2 g·L-1 NaHCO3,0.1 g·L-1 KCl,pH 7.0,含5.0 g·L-1铁氧化物/蒙脱石)中。于30 ℃ 厌氧培养12 h后向反应体系中加入适量的U(VI)(UO2(NO3)2·6H2O, AR, 北京华威瑞科),使U(VI) 的终浓度分别为50,100,150,200 mg·L-1,且反应体系的体积为40 mL,并放置于厌氧培养箱中,以此作为矿物-微生物对U(VI)的联合还原体系。于第3,6,9,12,24 h时采集样本,作为待测液。
在矿物-微生物-腐殖酸聯合体系中,U(VI)浓度为100 mg·L-1,且腐殖酸(C14H12O8,罗恩试剂)的浓度分别0,50,100,150,200 mg·L-1,其他条件与矿物-微生物联合体系一致。
1.4反应体系中U(VI)和Fe(II)浓度的测定
由于NaHCO3可萃取U(VI)[20],故取1 mL待测液,使用等体积的30 mmol·L-1 NaHCO3与之混匀,取1 mL混合液于比色管中,并加入质量分数 0.1%的偶氮胂III溶液、3% HNO3溶液和0.05 mol·L-1 EDTA-2Na 各1 mL,用去离子水补充至10 mL,用漩涡震荡仪摇匀,于652 nm波长处测吸光度。经测定U(VI)浓度(mg·L-1)与652 nm处吸光度的标准曲线方程为:y=0.0169x-0.0939(R2=0.9992)。
Fe(II)浓度测试采用邻菲罗啉-HF/H2SO4提取法,具体步骤如下:测定样品中总Fe(II)浓度时,将0.5 mL样品与1.2 mL质量分数10% H2SO4,0.1 mL质量分数4% HF和0.16 mL质量分数10% 邻菲罗啉显色剂(用95% 乙醇溶液配制,避光保存)混合摇匀,于沸水浴中加热30 min。冷却后,向待测样品中加入0.8 mL 0.1 mol/L H3BO3,摇匀,用于中和多余的HF。移取0.5 mL加入1 mL质量分数10% 柠檬酸三钠,待显色充分后于510 nm处测吸光度。经测定Fe(II)浓度(mmol·L-1)与510 nm处吸光度的标准曲线方程为:y=0.691x-0.0905(R2=0.9991)。
1.5数据处理
本研究中的ANOVA方差分析均由R语言完成,数据可视化由Origin2020和Graph Pad8共同完成。
2结果与分析
2.1铁氧化物/蒙脱石复合物的结构表征
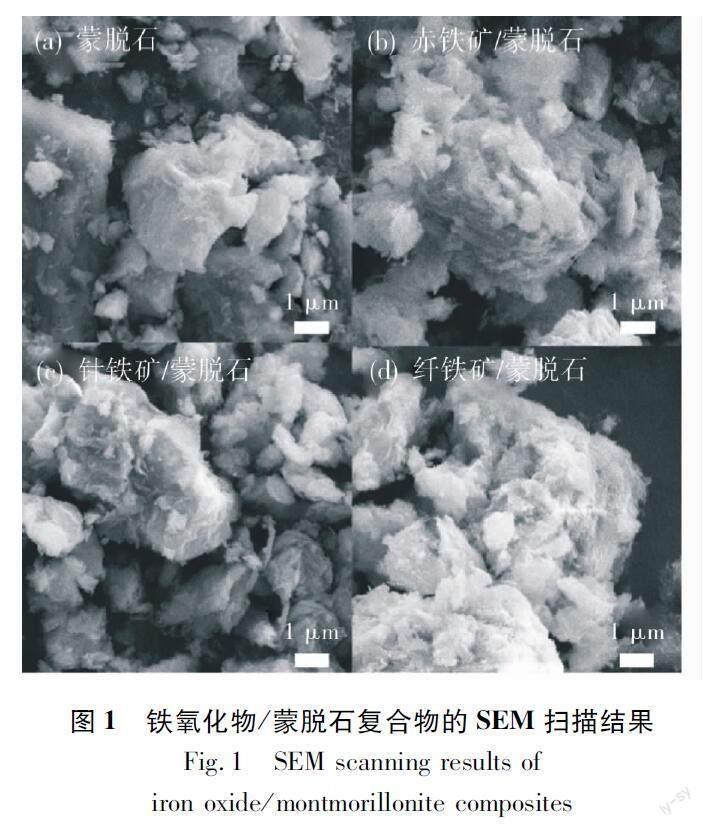
通过扫描电子显微镜并结合能量色散-X射线光谱仪对铁氧化物/蒙脱石复合物进行了分析,结果如图1、表1所示。经过处理后的铁氧化物/蒙脱石呈现出不规则的晶体和非晶体结构,有异于蒙脱石的光滑层状结构,使得处理后的铁氧化物/蒙脱石可能吸附到更多的U(VI)。蒙脱石中O,Si,C原子为其中的主要元素,其中O原子和Si原子的相对原子含量较高,质量分数分别为44.82% 和27.32%。相比于矿物结构的变化,合成后的铁氧化物/蒙脱石在原子组成上同样发生了较大的变化,主要体现在O,Si原子相对含量大幅降低,同时还引入了含量不等的Fe原子,但C原子在合成之后相对含量的变化不大。具体表现为:赤铁矿、针铁矿的O原子质量分数较蒙脱石的O原子质量分数降低了7.30%~18.53%,而纤铁矿O原子的质量分数则降低了32.56%。合成的纤铁矿中引入的Fe原子也远高于其他矿,纤铁矿的Fe原子相对含量为67.71%。
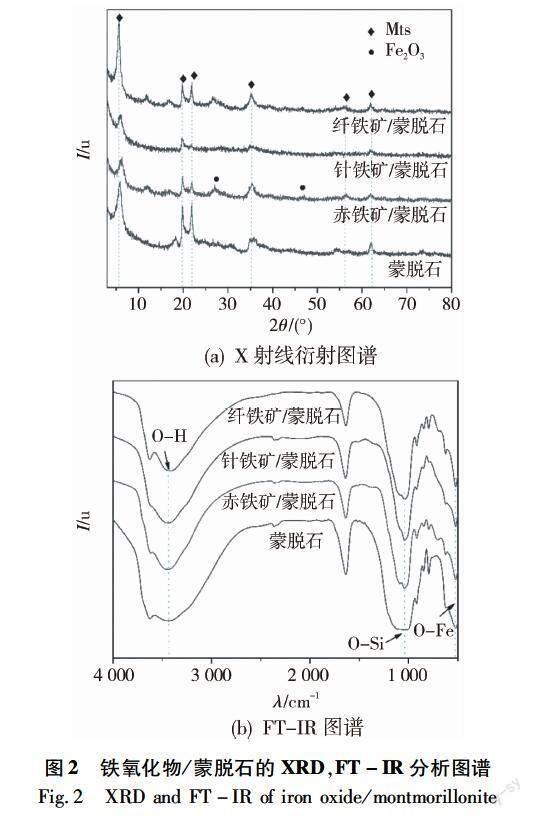
XRD分析结果如图2(a)所示。蒙脱石内部的几何空间是层间结构,其中有可用于离子交换的阳离子。与蒙脱石的衍射数据比较,铁氧化物/蒙脱石复合物中蒙脱石的衍射峰减弱,这可能是由于蒙脱石表面覆盖了铁氧化物颗粒。另外,蒙脱石的晶层间距发生改变,铁氧化物/蒙脱石复合物在形成过程中羟基铁离子进入蒙脱石晶层间取代了部分钠离子。由布拉格公式计算得出蒙脱石层间距为2.81 nm。通过比对PDF标准卡片(Powder diffraction file,PDF)发现,3种铁氧化物/蒙脱石均具有较强的SiO2特征峰(SiO2 JCPDS No:46-1405,101晶面),未发现Fe2O3或FeO的特征峰,表明合成的铁氧化物-硅酸盐矿物复合物在形成过程中导致Fe2O3或FeO的非晶化。
FT-IR结果如图2(b)所示。蒙脱石及铁氧化物/蒙脱石的FT-IR图谱的差异不大,均在3 608,3 455,1 640,1 033,465 cm-1处具有较强的吸收峰,表明它们的内部基团的种类与排布基本一致。其中在4 000~1 300 cm-1范围内为红外光谱的官能区,3 600 cm-1左右为HO键的特征峰,这很可能是在蒙脱石中存在一定的结合水。而1 630 cm-1附近则为层间水伸缩振动和弯曲振动谱带[21],对比蒙脱石的数据曲线,铁氧化物/蒙脱石复合物中≡AlOH伸缩振动带、OSiO伸缩振动带、AlOSi弯曲振动带发生了移动和变化,且出现了≡FeOH面内弯曲振动带、≡FeOH面外弯曲振动带和FeO伸缩振动带。
2.2矿物-微生物联合还原体系中U(VI),Fe(II)浓度的变化
铁氧化物/蒙脱石与希瓦氏菌MR-1联合作用时,均可在一定程度上降低体系中U(VI) 的含量(图3),同时反应十分迅速,即在0~3 h内反应速率最高,并且在3~12 h内反应速率逐步变缓,直至12 h时反应达到平衡。ANOVA分析结果表明,纤铁矿/蒙脱石联合希瓦氏菌MR-1体系对U(VI) 的还原能力显著高于其他2个复合物(P<0.05),例如在50 mg·L-1的铀处理组中,纤铁矿/蒙脱石在平衡时使U(VI) 的浓度降低至7.082 mg·L-1(还原率85.8%)。另外,针铁矿/蒙脱石在4个处理组中还原U(VI)的能力均为最低,显著低于其他矿物的U(VI)还原能力(P<0.05)。综上所述,矿物-微生物体系在还原U(VI) 时反应速率较快,同时铁氧化物/蒙脱石中Fe(III) 的含量与U(VI) 的还原率成正相关。
矿物-微生物联合还原体系中Fe(II)浓度的变化如图4所示。所有处理组的Fe(II) 浓度在整个反应过程中均介于0~0.7 mmol·L-1,由于在矿物合成过程中使用FeCl3作为原料,故而在反应初始阶段(0 h)体系中的Fe(II)浓度几乎为0,在反应的 0~3 h内Fe(II) 浓度迅速上升,该阶段也对应于U(VI) 含量迅速降低的时间范围,表明该时期内MR-1 在Fe(III)和U(VI)的还原过程中可能扮演着重要角色。体系反应至3~12 h时,Fe(II)浓度上升速率逐渐降低,直至12 h时达到平衡,但纤铁矿/蒙脱石反应体系中的Fe(II) 浓度仍在持续上升。在50 mg·L-1的铀处理组中,不同反应体系中平衡后Fe(II) 的浓度存在很大差异(P<0.05),其中针铁矿/蒙脱石体系中Fe(II) 的浓度最低(0.371 mmol·L-1),这可能是因为低浓度铀处理促进了Fe(II) 的还原过程,但对不同类型的铁氧化物/蒙脱石的促进效果存在差异。
2.3矿物-微生物-腐殖酸联合体系中U(VI),Fe(II)浓度的变化
矿物-微生物-腐殖酸联合还原体系中U(VI) 的含量变化结果如图5所示。结果表明,腐殖酸对联合体系还原U(VI) 影响显著(P< 0.05),但不同的铁氧化物/蒙脱石对腐殖酸的响应存在差异,表现为“完全促进”“低促高抑”和“高促低抑” 3种情况。腐殖酸对赤铁矿/蒙脱石体系的U(VI) 还原能力均表现为“完全促进”作用,且与腐殖酸的处理浓度呈显著正相关(P<0.05),在200 mg·L-1的腐殖酸处理组中,U(VI) 在反应平衡后的浓度为28.8 mg·L-1,去除率达到了71.2%,相较于未添加腐殖酸(26.4%)得到了显著提升(P<0.01)。腐殖酸对针铁矿/蒙脱石的U(VI) 还原能力整体表现为“低促高抑”,50~100 mg·L-1的腐殖酸添加显著促进了体系中的U(VI) 还原过程(P<0.05),而150,200 mg·L-1的腐殖酸添加组中U(VI) 的浓度则显著低于对照组(P<0.05)。纤铁矿/蒙脱石则表现为“高促低抑”的现象,即150,200 mg·L-1的腐殖酸处理组中U(VI) 的浓度分别为28.4,27.7 mg·L-1,显著低于对照组的33.0 mg·L-1(P<0.05),而50~100 mg·L-1处理组中的U(VI) 则分别为42.6,38.4 mg·L-1。因此,腐殖质提升了铁氧化物/蒙脱石-希瓦氏菌MR-1对U(VI) 的还原能力,但腐殖酸的具体添加量针对不同矿物有所差异,导致这种差异的原因尚不明确,需进一步研究。
图6为矿物-微生物-腐殖酸联合体系中Fe(II)浓度的变化情况。Fe(II)浓度在联合体系中的变化与U(VI)浓度的变化具有十分紧密的联系,但Fe(II)浓度的变化幅度没有U(VI)浓度变化剧烈。腐殖酸对联合体系中的Fe(II) 的影响主要分为抑制和促进两种类型,腐殖酸对纤铁矿/蒙脱石、赤铁矿/蒙脱石表现出显著的促进作用(P<0.05),但这二者之间又存在细微差别。腐殖酸显著促进了纤铁矿/蒙脱石联合体系中Fe(II) 浓度的增加,不同剂量的腐殖酸处理组之间并未出现显著性差异(P>0.05)。而赤铁矿/蒙脱石联合体系中Fe(II) 浓度不仅因腐殖酸的处理而增加,并且出现了随腐殖酸处理浓度的上升促进效果不断增强的现象。在200 mg·L-1的腐殖酸处理中,赤铁矿/蒙脱石联合体系中的Fe(II) 浓度为0.773 mmol·L-1,显著高于对照组的0.562 mmol·L-1(P<0.05)。腐殖酸对针铁矿/蒙脱石则表现为抑制其对应联合体系中的Fe(II) 生成,但并未表现出明显的浓度效应。这有可能是因为针铁矿/蒙脱石中Fe含量较高,促进了U(VI) 的还原反应,并抑制了Fe(II) 的生成。
3讨论
3.1Fe对矿物-微生物联合体系生物还原过程的影响
在铁氧化物/硅酸盐矿物复合体合成过程中人为地添加了一定的Fe(III)并且以结构 Fe(III) 的形式存在于其中,结构Fe(III) 在矿物-微生物联合体系发生生物还原作用时具有重要作用。本研究结果表明,矿物-微生物联合体系的U(VI) 还原能力与矿物中Fe(III) 含量具有紧密关系,Fe含量最高的纤铁矿/蒙脱石,其对应的矿物-微生物联合体系的U(VI) 还原能力也最强。某些具有金属还原性的异养微生物在厌氧环境且生长体系缺乏电子受体的情况下,虽然能够完成有机物的氧化分解,但需要将代谢过程中产生的电子转移至矿物中Fe(III) 等电子受体上才能完成整个代谢过程[22]。在该过程中,Fe(III) 得到电子后被还原为Fe(II),生成的Fe(II) 又具有较高的还原性,可对体系中存在的高价态金属离子(如Cr6+)进行还原[23]。Zhang等[24]通过构建含Fe(III) 矿物与腐败希瓦氏菌CN32(Shewanella putrefaciens CN32)聯合体系,考察了U(VI) 的还原情况,结果表明该体系能有效进行U(VI) 的生物还原过程,同时当体系中存在柠檬酸或EDTA等有机配体时,U(VI) 的生物还原速率显著提升。这是因为有机配体可以通过影响铀的形态、吸附、生物利用度、U(VI)/U(IV)氧化还原电位,进而影响U(VI) 的还原动力学[25]。Zhao等[26]发现黏土矿物中的结构Fe(III)是控制Fe(III) 还原菌、As(V) 还原菌和 Fe(III)-As(V) 还原菌还原As(V) 并释放As(III) 的关键因素。因此,Fe(III) 可有效提升微生物-矿物联合体系的还原能力,降低U(VI) 的生物毒性。
3.2有机质增强矿物-微生物联合体系生物还原过程
有机物是异养微生物生长代谢的物质基础,为细胞的基础生命活动提供了能量来源。在微生物实现其功能时,有机物的添加是必不可少的。另外,腐殖酸中存在醌和芳香族等具有氧化还原功能的官能团,腐殖酸在矿物-微生物联合体系中,尤其针对于金属还原微生物的代谢过程中,可充当电子穿梭体的作用,并且在厌氧环境中该电子穿梭体是可再生的,显著增加了微生物的生长代谢速率。本研究为了增强铁氧化物/蒙脱石与希瓦氏菌MR-1联合体系的U(VI) 生物还原能力,向该体系添加了不同浓度的水溶性腐殖酸。促进了铁氧化物/蒙脱石-希瓦氏菌MR-1联合体系对U(VI) 的还原,但腐殖酸的具体添加量针对不同矿物有所差异。对Fe元素相对含量较高的体系,仅需少量腐殖酸便可促进对U(VI) 的还原。然而高浓度的腐殖酸处理可能会使体系中大量的Fe(II) 或Fe(III) 与腐殖酸发生络合,进而抑制体系的还原能力[27];矿物可能覆盖细胞表面并中断电子转移[28],故需要更多的腐殖酸充当电子穿梭体的作用。Dong等[29]将天然黏土矿物和腐殖酸加入到受污染土壤中,并通过土壤中的微生物群落共同作用,实现了钒污染土壤的有效修复,经修复后的土壤对营养物质的固定能力以及微生物群落多样性显著提升。Zuo等[30]通过向矿物-腐败希瓦氏菌CN32联合体系中添加适当的腐殖酸,成功地增强了黏土-Fe(III) 的生物还原过程,同时证实了腐殖酸在联合体系下还能转化为氨基酸和其他化合物,进而为微生物的生长代谢提供一定的物质基础。Wang等[31]直接将由腐殖酸改性的蒙脱石应用于Cd和Hg污染土壤中,仅添加5% 的改性蒙脱石便使Cd,Hg质量分数分别降低94.1%,93.0%。这些研究均证明了腐殖酸可促进矿物-微生物联合体系的生物还原过程。
3.3矿物-微生物联合体系对U(VI) 的生物还原途径
微生物、土壤矿物和有机物是土壤活跃成分,它们相互作用,共同影响土壤性质和土壤物质循环,同时对其中的污染离子进行固定和转化。在土壤多组分对铀进行污染治理时存在着铁元素循环和铀元素循环,且在U(VI) 的去除过程中存在着多种作用途径。在厌氧条件下,希瓦氏菌MR-1通过厌氧呼吸产生电子,这些电子可以直接被U(VI)、矿物中Fe(III)、腐殖酸利用。得到电子的腐殖酸可将电子传递给U(VI) 和矿物中Fe(III),腐殖酸在其中充当电子穿梭体。得到电子的矿物中的Fe(III) 变为Fe(II),后将电子传递给U(VI),结构中的Fe(II) 又变回Fe(III)。通过以上3条途径(微生物直接还原U(VI),腐殖酸介导,Fe(III) 的电子传递)将U(VI) 转化为U(IV),降低了六价铀的生物毒性,从而达到污染治理的目的。
4结论
本研究通过将蒙脱石合成铁氧化物/蒙脱石,并与希瓦氏菌MR-1(Shewanella oneidensis MR-1)构成联合体系,在厌氧条件下对U(VI) 进行生物还原。结果发现:(1)蒙脱石在合成为铁氧化物/蒙脱石后,其层状结构出现了较大变化,同时引入了含量不等的Fe,其中纖铁矿中引入的Fe原子含量最高(67.71%);(2)在矿物-微生物联合体系中,纤铁矿/蒙脱石联合希瓦氏菌MR-1体系对U(VI ) 的还原能力最强,在铀处理浓度为50 mg·L-1时的还原率为85.8%,Fe(II) 的含量与U(VI) 呈反比关系,在反应的0~3 h时迅速上升;(3)腐殖酸对联合体系还原U(VI) 的影响表现为“完全促进”“低促高抑”和“高促低抑”3种现象,对联合体系中的Fe(II) 的影响主要分为抑制和促进两种类型。因此,铁氧化物/蒙脱石与希瓦氏菌MR-1构成的联合体系在厌氧条件下能够实现对U(VI) 的生物还原。在后续研究中,可借助代谢组学等技术考察联合体系中小分子物质的变化情况,进一步了解矿物-微生物联合体系还原U(VI) 过程中微生物的作用以及参与方式。
参考文献
[1]CHEN H Y, TENG Y G, LU S J, et al. Contamination features and health risk of soil heavy metals in China[J]. Science of the Total Environment, 2015, 512/513: 143-153.
[2]SU C, JIANG L Q, ZHANG W J. A review on heavy metal contamination in the soil worldwide: Situation, impact and remediation techniques[J]. Environmental Skeptics and Critics, 2014, 3(2): 24-38.
[3]TODOROV P T, ILIEVA E N. Contamination with uranium from natural and antropological sources[J]. Romanian Journal of Physics, 2006, 51(1/2): 27-34.
[4]DONG W Q Y, CUI Y, LIU X. Instances of soil and crop heavy metal contamination in China[J]. Soil and Sediment Contamination: an International Journal, 2001, 10(5): 497-510.
[5]WALL D H, NIELSEN U N, SIX J. Soil biodiversity and human health[J]. Nature, 2015, 528(7580): 69-76.
[6]唐垂云, 钟娟, 吕莹, 等. 土壤中铀污染修复技术研究进展[J]. 化工进展, 2021, 40(8): 4587-4599.
[7]CHEN L, LIU J R, ZHANG W X, et al. Uranium (U) source, speciation, uptake, toxicity and bioremediation strategies in soil-plant system: a review[J]. Journal of Hazardous Materials, 2021, 413: 125319.
[8]YAO Z T, LI J H, XIE H H, et al. Review on remediation technologies of soil contaminated by heavy metals[J]. Procedia Environmental Sciences, 2012, 16: 722-729.
[9]LI Y H, GONG X F. Effects of dissolved organic matter on the bioavailability of heavy metals during microbial dissimilatory iron reduction: a review[J]. Reviews of Environmental Contamination and Toxicology, 2021, 257: 69-92.
[10]JIANG Z, SHI M M, SHI L. Degradation of organic contaminants and steel corrosion by the dissimilatory metalreducing microorganisms Shewanella and Geobacter spp[J]. International Biodeterioration & Biodegradation, 2020, 147: 104842.
[11]MOLINAS M C A. Insights into the microbial reduction of pentavalent and hexavalent uranium species by Shewanella oneidensis MR-1 [D]. Lausanne, Swiss Confederation, EPFL, 2021.
[12]陈文达, 倪微琪, 胡宝兰, 等. 细菌胞际电子转移及其生态生理学意义研究进展[J]. 应用生态学报, 2019, 30(2): 694-702.
[13]徐柳, 宋琴, 茆灿泉. 金属结合蛋白(肽)与环境重金属生物修复[J]. 中国生物工程杂志, 2004, 24(4): 39-43.
[14]徐天生, 欧杰, 馬晨晨. 微生物还原Cr(Ⅵ) 的机理研究进展[J]. 环境工程, 2015, 33(1): 32-36.
[15]ZHAO M H, XU Y, ZHANG C S, et al. New trends in removing heavy metals from wastewater[J]. Applied Microbiology and Biotechnology, 2016, 100(15): 6509-6518.
[16]卢静, 朱琨, 赵艳锋, 等. 腐殖酸在去除水体和土壤中有机污染物的作用[J]. 环境科学与管理, 2006, 31(8): 151-154.
[17]GU B H, CHEN J. Enhanced microbial reduction of Cr(VI) and U(VI) by different natural organic matter fractions[J]. Geochimica et Cosmochimica Acta, 2003, 67(19): 3575-3582.
[18]LIU G F, YU H L, WANG N, et al. Microbial reduction of Ferrihydrite in the presence of reduced Graphene oxide materials: Alteration of Fe(III) reduction rate, biomineralization product and settling behavior[J]. Chemical Geology, 2018, 476: 272-279.
[19]SCHWERTMANN U, CORNELL R M. Iron oxides in the laboratory: preparation and characterization[M]. Weinheim: VCH, 1991.
[20]SATPATHY A, CATALANO J G, GIAMMAR D E. Reduction of U(VI) on chemically reduced montmorillonite and surface complexation modeling of adsorbed U(IV)[J]. Environmental Science & Technology, 2022, 56(7): 4111-4120.
[21]王丽娟, 廖立兵. 干燥方法对钛柱撑蒙脱石结构的影响[J]. 硅酸盐学报, 2005, 33(2): 215-219, 224.
[22]SHI L, DONG H L, REGUERA G, et al. Extracellular electron transfer mechanisms between microorganisms and minerals[J]. Nature Reviews Microbiology, 2016, 14(10): 651-662.
[23]馬晓旭, 孟颖, 张鉴达, 等. 含铁黏土矿物与电子传递体强化生物还原固定地下水中Cr(Ⅵ)的过程和机理分析[J]. 环境工程学报, 2020, 14(9): 2527-2536.
[24]ZHANG L M, CHEN Y, XIA Q Y, et al. Combined effects of Fe(III)bearing clay minerals and organic ligands on U(VI) bioreduction and U(IV) speciation[J]. Environmental Science & Technology, 2021, 55(9): 5929-5938.
[25]BELLI K M, TAILLEFERT M. Biogeochemical processes regulating the mobility of uranium in sediments [J]. Trace Elements in Waterlogged Soils and Sediments, 2016(1):185-223.
[26]ZHAO Z W, MENG Y, YUAN Q K, et al. Microbial mobilization of arsenic from ironbearing clay mineral through iron, arsenate, and simultaneous ironarsenate reduction pathways[J]. Science of the Total Environment, 2021, 763: 144613.
[27]AMSTAETTER K, BORCH T, KAPPLER A. Influence of humic acid imposed changes of ferrihydrite aggregation on microbial Fe(III) reduction[J]. Geochimica et Cosmochimica Acta, 2012, 85: 326-341.
[28]MOHAMED A, YU L, FANG Y, et al. Iron mineral-humic acid complex enhanced Cr(VI) reduction by Shewanella oneidensis MR-1[J]. Chemosphere, 2020, 247: 125902.
[29]DONG Y B, LIN H, ZHAO Y M, et al. Remediation of vanadiumcontaminated soils by the combination of natural clay mineral and humic acid[J]. Journal of Cleaner Production, 2021, 279: 123874.
[30]ZUO H Y, KUKKADAPU R, ZHU Z H, et al. Role of clayassociated humic substances in catalyzing bioreduction of structural Fe(III) in nontronite by Shewanella putrefaciens CN32[J]. Science of the Total Environment, 2020, 741: 140213.
[31]WANG L W, LI X R, TSANG D C W, et al. Green remediation of Cd and Hg contaminated soil using humic acid modified montmorillonite: Immobilization performance under accelerated ageing conditions[J]. Journal of Hazardous Materials, 2020, 387: 122005.
