妊娠期糖尿病患者血清葡萄糖依赖性促胰岛素释放肽、成纤维细胞生长因子-23水平与产后糖代谢异常的关系
2023-11-03黄倩倩孙继青李景然
黄倩倩, 孙继青, 刘 军, 李景然
(1. 合肥京东方医院 妇产科, 安徽 合肥, 230013; 2. 安徽省妇幼保健院 检验科, 安徽 合肥, 230001)
妊娠期糖尿病(GDM)是妊娠中期或晚期发病或首次诊断的葡萄糖耐受不良,是产后发生2型糖尿病(T2DM)的危险因素,与无GDM 病史的产妇相比, GDM患者产后患T2DM的风险增高7倍[1]。为降低产后T2DM的患病风险,建议GDM产妇产后进行终身的糖代谢评估,但产后T2DM筛查存在各种影响因素,患者对T2DM筛查建议的依从性不足,若能有效筛查出产后糖代谢异常的高危人群,可提高GDM患者产后糖代谢评估依从性,降低T2DM风险[2]。葡萄糖依赖性促胰岛素释放肽(GIP)是一种肠促胰岛素激素,通过肠道内分泌细胞对营养物质消耗的反应而分泌,参与餐后代谢,可增加胰岛素分泌并维持正常的葡萄糖耐量[3]。成纤维细胞生长因子-23(FGF23)是一种由骨细胞产生和分泌的糖蛋白,属于内分泌成纤维细胞生长因子的一个亚家族,参与维生素D代谢和血磷水平的调节,与胰岛素抵抗也存在密切关系[4]。本研究检测GDM患者血清GIP、FGF23水平,分析其与GDM患者产后糖代谢异常的关联性,现报告如下。
1 资料与方法
1.1 一般资料
选取2017年6月—2022年8月收治的82例GDM患者为研究对象。纳入标准: ① 妊娠24~28周接受葡萄糖耐量筛查者,筛查前晚餐后禁食至少8 h; ② 经葡萄糖耐量试验证实为GDM者,符合《妊娠合并糖尿病诊治指南(2014)》[5]相关诊断标准; ③ 书面知情同意本研究者。排除标准: ① 试管婴儿或人工授精受孕者; ② 多胎妊娠者; ③ 孕前糖尿病或合并妊娠期高血压疾病、妊娠期肝内胆汁淤积等合并症者; ④ 合并甲亢、甲减、肾上腺皮质疾病等其他内分泌疾病者; ⑤ 产后服用糖皮质激素、利尿剂、解热镇痛药等影响糖代谢分泌的药物者; ⑥ 产后12周内再次受孕者。所有患者产后12周门诊复查,采用75 g葡萄糖耐量试验(OGTT)评估糖代谢状态,糖代谢状态包括糖代谢正常(空腹血糖<6.1 mmol/L, 糖负荷后2 h血糖<7.8 mmol/L)、空腹血糖受损(空腹血糖≥6.1~<7.0 mmol/L, 糖负荷后2 h血糖<7.8 mmol/L)、糖耐量受损(空腹血糖<7.0 mmol/L, 糖负荷后2 h血糖≥7.8~<11.1 mmol/L)、T2DM(空腹血糖≥7.0 mmol/L, 糖负荷后2 h血糖≥11.1 mmol/L)[6]。将糖代谢正常者纳入糖代谢正常组(n=66), 空腹血糖受损、糖耐量受损和T2DM者纳入糖代谢异常组(n=16)。本研究已经获得医院伦理委员会批准。
1.2 方法
1.2.1 临床资料收集: 收集患者年龄、孕前和产后体质量指数(BMI)、收缩压、舒张压、糖尿病家族史、孕次、产次、是否使用胰岛素、新生儿体质量、产后喂养方式。另收集诊断GDM时检测的空腹血糖、糖负荷后1 h血糖、糖负荷后2 h血糖、空腹胰岛素、总胆固醇、甘油三酯、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇。血糖采用葡萄糖氧化酶法测定,血脂采用AU5800全自动生化分析仪(美国贝克曼库尔特公司)测定,空腹胰岛素采用化学发光免疫法测定。
1.2.2 血清GIP、FGF23水平检测: 诊断GDM时采集清晨空腹静脉血3 mL, 注入干燥试管,室温静置后取上层液离心(3 000转/min离心5 min, 离心半径15 cm), 提取上层血清保存于-80 ℃环境中备检。采用酶联免疫吸附试验检测血清GIP、FGF23水平, GIP试剂盒购自上海酶联生物科技有限公司(货号ml027994), FGF23试剂盒购自上海科艾博生物科技有限公司(货号CB14924-Hu), GIP、FGF23试剂盒组内变异系数分别为2.47、4.04,组间变异系数分别为3.08、5.46。仪器为Elx800酶标仪(美国 Biotek 公司),测定450 nm波长下的吸光度,通过标准曲线计算样品中GIP、FGF23的水平。
1.3 统计学分析

2 结 果
2.1 糖代谢正常组与糖代谢异常组基线资料比较
糖代谢异常组的孕前BMI、空腹血糖、糖负荷后2 h血糖高于糖代谢正常组,母乳喂养比率低于糖代谢正常组,差异有统计学意义(P<0.01); 2组年龄、产后BMI、收缩压、舒张压、糖尿病家族史、孕次、产次、是否使用胰岛素、新生儿体质量比较,差异无统计学意义(P>0.05), 见表1。

表1 糖代谢正常组与糖代谢异常组基线资料比较
2.2 糖代谢正常组与糖代谢异常组血清GIP、FGF23水平比较
糖代谢异常组血清GIP水平低于糖代谢正常组, FGF23水平高于糖代谢正常组,差异有统计学意义(P<0.01), 见表2。

表2 糖代谢正常组与糖代谢异常组血清GIP、FGF23水平比较
2.3 GDM患者产后糖代谢异常的危险因素
以孕前BMI、空腹血糖、糖负荷后2 h血糖、GIP、FGF23、喂养方式(赋值: 0=母乳喂养, 1=人工喂养)为自变量,以GDM患者产后糖代谢异常为因变量(赋值: 0=否, 1=是),向后逐步法排除无关变量,孕前高BMI、高FGF23是GDM 患者产后糖代谢异常的危险因素(P<0.05), 高GIP是保护因素(P<0.05), 见表3。
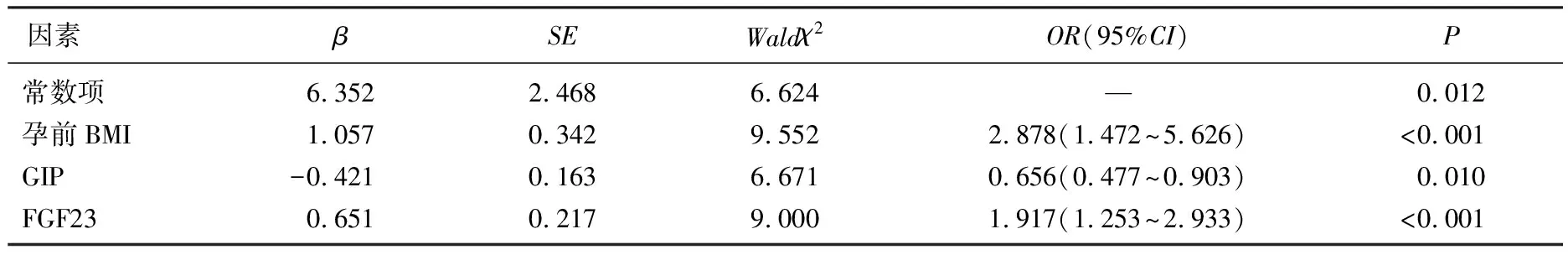
表3 GDM患者产后糖代谢异常的危险因素
2.4 GIP、FGF23预测GDM患者产后糖代谢异常的价值
GIP、FGF23、孕前BMI预测GDM患者产后糖代谢异常的曲线下面积(AUC)分别为0.717、0.625、0.699, GIP、FGF23、孕前BMI联合预测GDM患者产后糖代谢异常的AUC为0.890, 高于GIP、FGF23、孕前BMI单独预测的价值(Z=2.701、2.845、2.579,P<0.05), 见表4、图1。
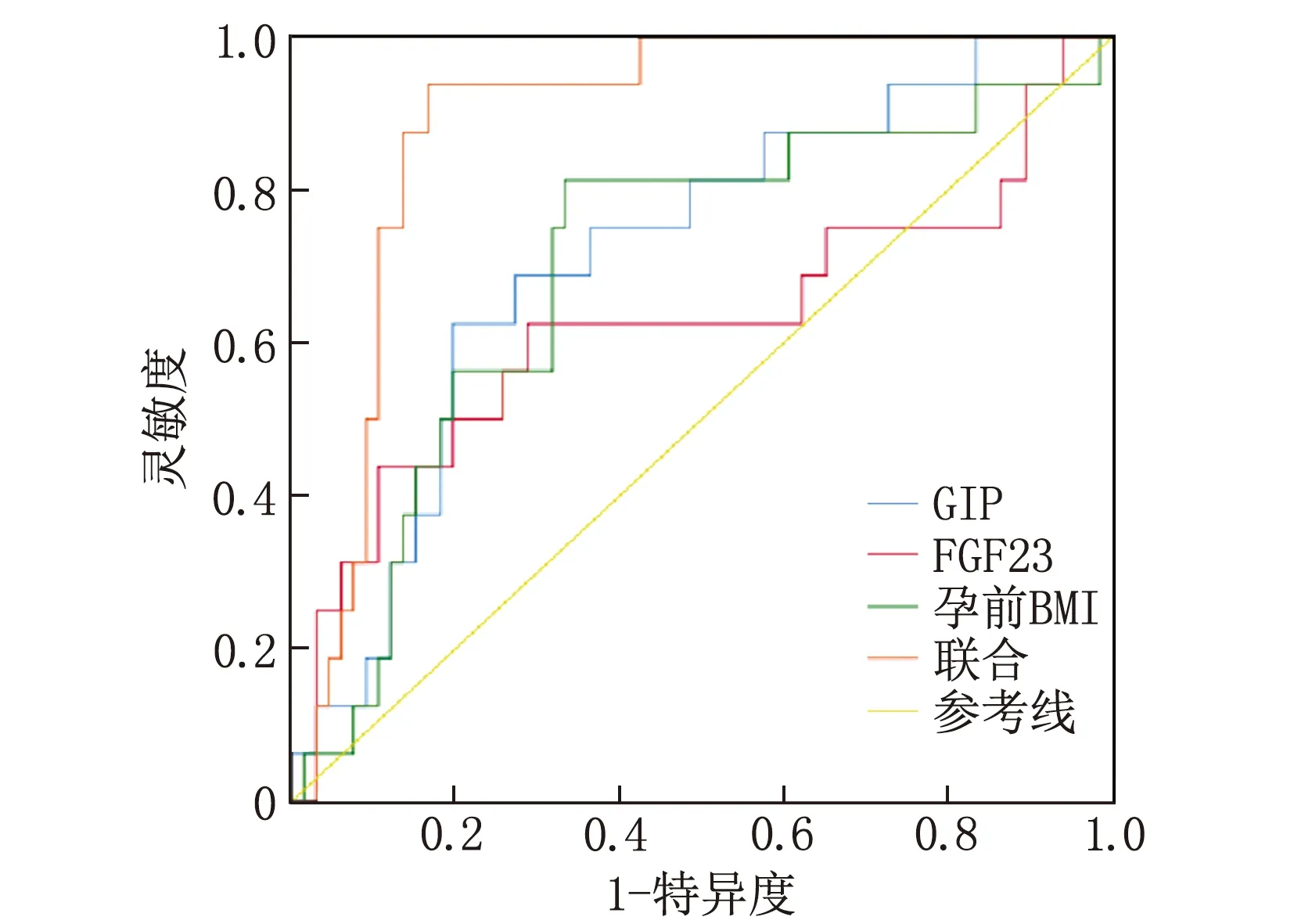
图1 GIP、FGF23、孕前BMI预测GDM患者产后糖代谢异常的ROC曲线图

表4 GIP、FGF23、孕前BMI预测GDM患者产后糖代谢异常的价值
3 讨 论
GDM是妊娠期间母体β细胞对胰岛素反应缺陷导致的糖耐受不良,虽然GDM产妇糖耐量通常在分娩后恢复正常,但GDM与持续长期代谢功能障碍和显性糖尿病的风险升高有关, GDM女性分娩后胰岛β细胞分泌能力和胰岛素敏感性的恶化速度更快,有GDM病史的女性发生产后T2DM及其并发症的风险较高,并且可能比无GDM的女性更早发生T2DM[7]。GDM女性产后T2DM的患病率为2.6%~70.0%, 与一般人群相比, GDM女性患T2DM的年龄相对较轻,患心血管疾病、非酒精性脂肪肝、肾脏疾病和发生早期死亡的风险更高[8]。因此,有必要探讨GDM向T2DM转变的潜在原因,临床多通过产后6~12周75 g OGTT筛查糖代谢异常风险,但空腹血糖和OGTT后2 h血浆葡萄糖水平的鉴别能力有限,且具有滞后性,不能早期预测糖代谢异常风险,故而需要一种简化的和更准确的标志物对GDM患者产后的糖代谢异常风险进行分层,以提高对糖代谢异常的识别效能。
GIP是一种由十二指肠和空肠黏膜上皮K细胞合成并分泌的肽激素,属于胃肠调节肽家族的一员,GIP基因位于染色体17q21.3~q22, 具有显著的促胰岛素分泌活性,高脂和高碳水化合物膳食能刺激GIP的表达和分泌, GIP通过与胰岛细胞膜上的GIP受体(GIPR)特异性结合激活腺苷酸环化酶-环磷酸腺苷-蛋白激酶A通路,开放钙通道,促使钙离子内流,继而刺激胰岛素原基因转录,促使胰岛素β细胞分泌胰岛素,发挥降血糖的作用[9]。GIP在妊娠后血糖调节中起重要作用,既往研究[10]显示GDM患者血清GIP水平显著下降,较低的GIP与GDM发病风险增加有关。本研究发现GIP与GDM患者产后糖代谢异常也有关,糖代谢异常组血清GIP水平低于糖代谢正常组, GIP是GDM产后糖代谢异常的保护性因素,表明GIP的正常分泌可能维持分娩后正常的糖耐量,降低糖代谢异常风险, GIP表达降低则使其促胰岛素分泌作用减弱,因此糖代谢异常风险增加。分析可能的机制为: 首先, GIP可直接增强外周靶组织对胰岛素的敏感性,增加胰岛素的降糖作用[11]; 其次, GIP也被证明以旁分泌的方式作用于邻近β细胞并促进β细胞存活,并刺激胰岛α细胞释放胰高血糖素样肽-1,改善葡萄糖代谢[12]; 最后, GIP可通过激活5′-磷酸腺苷(AMP)依赖的蛋白激酶/磷脂酰肌醇3-激酶/蛋白激酶B信号通路,减少活性氧的产生,抑制氧化应激反应,减少炎症细胞因子的释放,改善胰岛素抵抗状态[13],降低产后糖代谢异常风险。ROC曲线显示,血清GIP水平可预测GDM患者产后糖代谢异常的风险,提示临床通过检测孕中后期血清GIP水平可能识别产后糖代谢异常高危人群,对指导临床GDM治疗和产后糖代谢评估有重要的意义。
FGF23是一种骨髓来源的激素,在磷酸盐和钙代谢的调节过程中发挥重要作用, FGF23由成骨细胞和骨细胞分泌以应对磷酸盐水平升高,防止磷酸盐在肾近端小管再摄取。FGF23还是维生素D激素产生的有效抑制因子,可通过抑制1-α-羟化酶活性阻止25-羟基维生素D向活性形式的转化,反之当维生素D和磷酸盐水平增加时可刺激骨细胞FGF23的产生[14]。研究[15]显示FGF23与糖尿病及其并发症密切相关,糖尿病患者血清FGF23水平增高与糖尿病肾病进展有关, FGF23水平增高是T2DM患者颈动脉内-中膜厚度增加、动脉粥样硬化的危险因素[16]。GDM患者血清FGF23水平也显著增高,且与血脂血糖水平增高以及胰岛素抵抗有关[17]。本研究发现GDM患者血清FGF23水平增高是产后发生糖代谢异常的危险因素,说明FGF23水平增高可能提示产后糖代谢紊乱风险,对临床预防产后糖代谢异常有着积极的意义。FGF23参与GDM产后糖代谢异常的机制尚不清楚,推测可能是磷酸盐和钙代谢异常与糖代谢紊乱有关,血清磷酸盐水平降低可导致静息细胞内钙浓度增高,胰岛三磷酸腺苷的生成和胰岛素分泌减少,引起血糖水平增高和糖代谢紊乱,而补充磷酸盐有助于增加胰岛素的敏感性,降低血糖[18]。另外, FGF23与胰岛素抵抗也存在密切关系, FGF23通过激活磷酸肌苷3激酶/蛋白激酶B/信号转导因子叉头盒蛋白O1负向调控胰岛素水平,增加血糖水平,导致胰岛素抵抗[4]。由此可见, FGF23水平增高可能抑制胰岛素分泌,增加胰岛素抵抗,进而增加产后糖代谢紊乱的风险。ROC曲线分析显示, FGF23预测GDM患者产后糖代谢紊乱的AUC为0.625, 表明FGF23可作为GDM患者产后糖代谢紊乱的标志物,为临床产后糖代谢紊乱预测提供参考。
回归分析结果显示产前高BMI与GDM患者产后糖代谢异常也有关,说明肥胖可能增加产后糖代谢异常以及罹患T2DM风险,这与肥胖导致糖脂代谢紊乱和胰岛素抵抗有关。ROC曲线显示,联合GIP、FGF23和产前BMI可提高对GDM患者产后糖代谢紊乱的预测价值,表明GIP水平降低、FGF23水平增高且BMI增加预示更高的糖代谢紊乱风险。
综上所述, GDM产后糖代谢紊乱患者血清GIP水平降低, FGF23水平增高,低水平GIP和高水平FGF23与产后糖代谢异常有关,检测血清GIP和FGF23水平有助于预测GDM患者产后糖代谢异常的风险。
