限制性酶解修饰对郁李仁分离蛋白结构和功能特性的影响
2023-11-02赵新如程建明薛峰
赵新如,程建明,薛峰
(南京中医药大学药学院,江苏 南京 210023)
郁李仁为蔷薇科郁李的种仁,其又名小李仁或李仁肉,是我国传统的药食两用原料[1]。郁李仁富含纤维素,因此被认为具有促进消化和降低胆固醇的作用[2]。此外,郁李仁中还富含抗氧化物质,因此也被认为具有保护心脑血管和抗癌的作用[3-4]。一直以来,郁李仁被用于提取纤维素、油脂和苦杏仁苷。然而,关于郁李仁中蛋白质的研究却鲜有报道。郁李仁蛋白作为植物蛋白的一种,其研究与开发可以减少动物蛋白的使用,从而降低温室气体的排放[5]。然而,与动物蛋白相比,植物蛋白的功能特性较差,通常需要进行某些修饰以增强其功能特性。常用的修饰方法包括物理改性、化学改性和酶法改性[6]。然而,如何改善郁李仁蛋白质功能特性尚缺乏系统性的研究。
本团队前期研究发现,采用超声波处理可以改善郁李仁分离蛋白的溶解性、乳化性、起泡性和凝胶特性[1];采用高压均质处理可以改善郁李仁分离蛋白的溶解性和流变学特性[7];采用多糖接枝修饰可以改善郁李仁分离蛋白的成膜特性[8]。然而,能否采用酶法修饰改善郁李仁分离蛋白功能特性尚未可知。此外,与物理修饰和化学修饰相比较,酶法修饰具有特异性强、反应条件温和、工业化程度高以及安全性高等优势。限制性酶解技术是一种广泛用于改善植物蛋白质功能特性的生物学方法,可以对植物蛋白质进行部分水解,使得植物蛋白质发生去折叠化,从而暴露更多的活性基团[9]。目前,该技术已经成功用于改善大豆蛋白[10]、豌豆蛋白[11]、绿豆蛋白[12]、大米蛋白[13]、藜麦蛋白[14]以及核桃蛋白[15]的功能特性。因此,本研究拟采用限制性酶解技术来改善郁李仁蛋白的功能特性,以期为拓展郁李仁蛋白的应用领域提供理论依据和技术支撑。
1 材料与方法
1.1 试剂与仪器
郁李仁(货号:2212139,宁夏明德中药饮片有限公司);碱性蛋白酶、福林酚试剂、疏水荧光探针(ANS)、牛血清白蛋白、亮氨酸、磷酸氢二钠、磷酸二氢钠、十二烷基磺酸钠(SDS)、大豆油(货号:S10154、S30000、S27737、S12012、S20120、S24162、S30731、S15013、S24362,上海源叶生物科技有限公司);三硝基苯磺酸(TNBS)(货号:P2297,美国Sigma公司);上样缓冲液、预制胶、考马斯亮蓝染液、电泳缓冲液(货号:W004-1-1、W002-6-1、W010-1-1、W007-1-1,南京建成生物工程研究所);蛋白质标准品(货号:26616,美国Thermo Scientific公司);氢氧化钠(货号:150708,西陇化工股份有限公司);盐酸(货号:20170914,上海凌峰化学试剂有限公司)。
TD-6离心机,长沙湘智离心机仪器有限公司;FA1204电子分析天平,上海市安亭电子仪器厂;PHS-3E pH计,上海仪电科学仪器股份有限公司;LGJ-18S冷冻干燥机,北京松源华兴科技发展有限公司;HH-6水浴锅,常州国华电器有限公司;FM200高速剪切机,上海弗鲁克流体机械制造有限公司;752N紫外可见分光光度计,上海仪电分析仪器有限公司;F-7000荧光光谱仪,日本Hitachi公司;电泳仪,美国Bio-rad公司;Mos-450圆二色谱仪,法国Biologic公司;Q500差示扫描量热仪,美国TA公司;DSA25表面张力仪,德国Kruss公司;Spark10M酶标仪,瑞士Tecan公司。
1.2 试验方法
1.2.1 郁李仁分离蛋白的制备 采用本团队建立的碱提酸沉法来制备郁李仁分离蛋白[1],其步骤简述如下:将郁李仁粉碎过60目筛备用。在过筛后的郁李仁粉中加入正己烷脱脂。将脱脂后的郁李仁粉分散在去离子水中,调整pH值至8.5以提取蛋白质。调整pH值至4.5,离心收集蛋白质沉淀。将蛋白质沉淀分散在去离子水中,调整pH至7.0,冷冻干燥后于4 ℃保存备用。
1.2.2 限制性酶解 将5 g郁李仁分离蛋白分散到100 mL去离子水中。将蛋白质溶液放入恒温水浴锅中(60 ℃),调整pH至8.5。加入碱性蛋白酶,酶与底物的质量比例为0.05∶1。酶解时间为0~2 h。反应结束后采用高温(95 ℃,10 min)处理来终止酶解,并调整pH值至7.0。样品处理结束后,采用冷冻干燥获得酶解产物。
1.2.3 水解度的测定 采用TNBS法测定郁李仁分离蛋白的水解度[16],其步骤简述如下:将10 mg样品溶解在10 mL SDS溶液中。取0.125 mL样品溶液加入到1 mL磷酸盐缓冲液(0.2 mol·L-1,pH 8.2)中。加入1 mL TNBS溶液后启动反应。反应结束后在340 nm下测定吸光度。同时以亮氨酸做标准品,计算郁李仁分离蛋白的水解度。
1.2.4 亚基组成分析 采用聚丙烯酰胺凝胶电泳(SDS-PAGE)法分析样品的亚基组成[1]。
1.2.5 二级结构分析 采用圆二色谱法测定样品的二级结构[17]。样品浓度为0.2 mg·mL-1,扫描波长为190~250 nm。
1.2.6 三级结构分析 采用内源荧光光谱法测定样品的三级结构[17]。样品浓度为1.5 mg·mL-1,激发波长为290 nm,扫描波长为300~400 nm。
1.2.7 溶解性测定 采用福林酚法测定样品的溶解性[1],其步骤简述如下:采用去离子水配制2 mg·mL-1的样品溶液,分别调整pH值至3~8。在12 000×g下离心30 min,取上清液测定蛋白质浓度。以牛血清白蛋白为标准品,计算样品溶解度。
1.2.8 乳化性测定 采用浊度法测定样品的乳化活性和乳化稳定性[1],其步骤简述如下:采用磷酸盐缓冲液(10 mmol·L-1,pH=7.0)配制2 mg·mL-1的样品溶液。取30 mL的样品溶液与10 mL的大豆油混合。经高速剪切后,分别于0、5 min取50 μL乳液与5 mL SDS溶液混合,在500 nm下测定吸光值,用于计算乳化活性和乳化稳定性。
1.2.9 ζ-电势测定 采用ζ-电势仪测定样品的ζ-电势,样品浓度为0.2 mg·mL-1。
1.2.10 表面疏水性测定 采用荧光探针测定样品的表面疏水性[1],其步骤简述如下:将1 mL样品溶液(0.05~2.00 mg·mL-1)与5 μL ANS溶液(0.05%)混合后,测定其荧光强度。激发波长为390 nm,发射波长为470 nm。
1.2.11 表面张力测定 采用杜诺依环法测定样品的表面张力,其步骤如下:将2 mg·mL-1的样品溶液滴入大豆油中,于300 s后测定该体系的表面张力值。
1.2.12 热稳定性测定 采用差示扫描量热仪分析样品的热稳定性。样品质量5.0 mg,温度扫描范围20~200 ℃,升温速率10 ℃·min-1。
1.3 数据处理
每个样品平行测定3次,所获得的数据采用SPSS26.0软件进行平均值计算和单因素方差分析(One-WayANOVA)。在95%的置信区间,采用Duncan检验比较不同处理之间的显著性差异。
2 结果
2.1 酶解处理对郁李仁分离蛋白水解度的影响
如图1所示,随着酶解时间的延长,郁李仁分离蛋白的水解度呈现逐渐增加的趋势。这一结果表明,在碱性蛋白酶的作用下,郁李仁蛋白质中的肽键开始断裂,从而释放出更多的游离氨基。

注:相同字母表示P>0.05,不同字母表示P<0.05。
2.2 酶解处理对郁李仁分离蛋白亚基组成的影响
如图2所示,郁李仁分离蛋白的亚基主要集中在43~55 kDa和17~26 kDa两个区域。在加入碱性蛋白酶反应0.5 h后,郁李仁分离蛋白中分子量在43~55 kDa的亚基出现了缺失,而同时出现了2个分子量小于17 kDa的新亚基。这一结果说明碱性蛋白酶处理可以诱导郁李仁分离蛋白发生水解,从而形成新的亚基。此外,随着酶解时间的延长,郁李仁分离蛋白逐渐出现3个分子量小于17 kDa的新亚基,这一结果也很好地解释了水解度随着酶解时间的延长而增加的原因(图1)。

图2 限制性酶解处理对郁李仁分离蛋白亚基组成的影响
2.3 酶解处理对郁李仁分离蛋白二级结构的影响
如图3所示,在加入碱性蛋白酶反应0.5 h后,郁李仁分离蛋白中无规则卷曲结构出现明显的增加。这一结果表明碱性蛋白酶诱导的水解使得郁李仁分离蛋白结构由有序转向无序。然而,当酶解时间延长至2.0 h时,郁李仁分离蛋白中无规则卷曲结构的比例却开始下降。
2.4 酶解处理对郁李仁分离蛋白三级结构的影响
如图4所示,碱性蛋白酶修饰使得郁李仁分离蛋白的荧光强度增加。这一结果说明郁李仁分离蛋白中色氨酸上吲哚环的微环境发生了变化,即蛋白质发生了去折叠化现象,酶解修饰诱导郁李仁分离蛋白的三级结构发生了变化。然而,当酶解时间延长至2.0 h时,郁李仁分离蛋白的荧光强度发生了下降。
2.5 酶解处理对郁李仁分离蛋白溶解性的影响
如图5所示,郁李仁分离蛋白的溶解度在pH=5时最低,而当pH值偏离5时,溶解度逐渐增加,这说明郁李仁分离蛋白的等电点在5附近。与未经酶解修饰的郁李仁分离蛋白相比较,酶解处理可以增加郁李仁分离蛋白的溶解度,尤其是可以显著提高等电点附近的溶解度。此外,郁李仁分离蛋白的溶解度随着酶解时间的延长而增加。
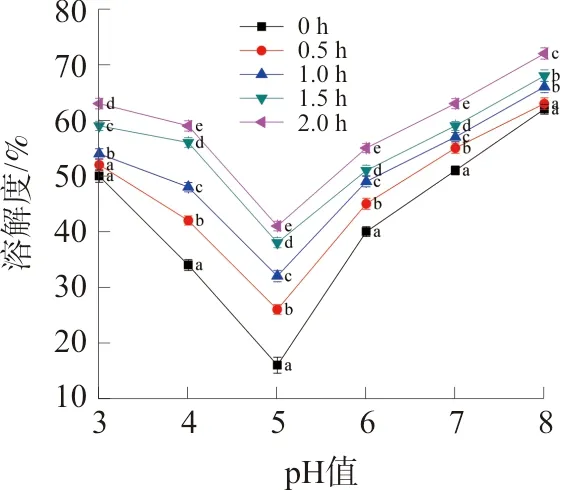
注:相同字母表示P>0.05,不同字母表示P<0.05。
2.6 酶解处理对郁李仁分离蛋白乳化性的影响
如图6~7所示,酶解处理可以显著改善郁李仁分离蛋白的乳化活性和乳化稳定性。然而,当酶解时间延长至2.0 h时,郁李仁分离蛋白的乳化活性和乳化稳定性均有所下降。
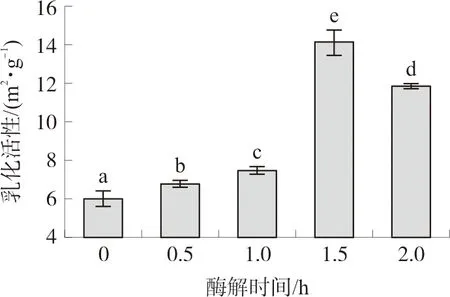
注:相同字母表示P>0.05,不同字母表示P<0.05。
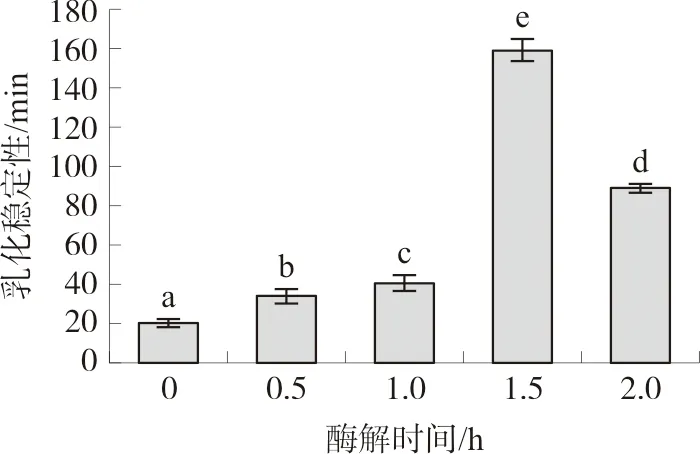
注:相同字母表示P>0.05,不同字母表示P<0.05。
2.7 酶解处理对郁李仁分离蛋白ζ-电势的影响
如图8所示,酶解处理可以显著增加郁李仁分离蛋白表面的电荷数量,这主要与酶解处理诱导蛋白质内部带点基团的暴露相关。而表面电荷数量的增加也有助于解释溶解性和乳化性的提高,因为蛋白质分子间静电相互作用力的增加有助于其在溶液中的分散以及提高其所制备乳液的稳定性[18]。然而,当酶解时间延长至2.0 h时,郁李仁分离蛋白表面的电荷数量有所下降,这同样可能与蛋白质聚集行为的产生有关。
2.8 酶解处理对郁李仁分离蛋白表面疏水性的影响
如图9所示,酶解处理可以显著增加郁李仁分离蛋白的表面疏水性,这主要与酶解处理诱导非极性氨基酸的暴露相关[19]。而表面疏水性的增加也有助于解释乳化性的改善(图6~7),因为较高的表面疏水性可以提高蛋白质在油水界面的吸附能力。然而,当蛋白质中过多的疏水基团暴露时,蛋白质分子间会通过疏水相互作用力形成新的聚集体,这也就是为什么当酶解时间延长至2.0 h时,表面疏水性会发生下降的主要原因。
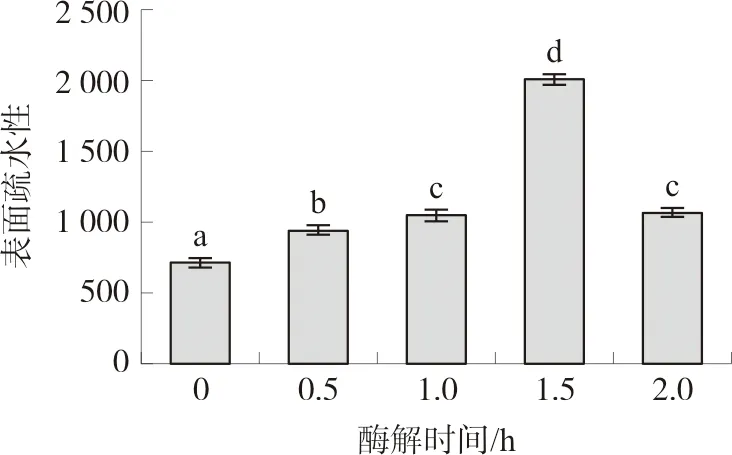
注:相同字母表示P>0.05,不同字母表示P<0.05。
2.9 酶解处理对郁李仁分离蛋白表面张力的影响
如图10所示,酶解处理可以显著降低郁李仁分离蛋白在油水界面的表面张力,这主要是因为酶解处理可以诱导小分子肽链的释放、疏水性基团的暴露以及蛋白质分子的去折叠化[20]。而表面张力的降低也有助于进一步解释乳化性的改善。此外,当酶解时间延长至2.0 h时,表面张力有所增加,这同样可以归因于过度酶解所导致的蛋白质聚集体的形成。

注:相同字母表示P>0.05,不同字母表示P<0.05。
2.10 酶解处理对郁李仁分离蛋白热稳定性的影响
如图11所示,酶解处理可以降低郁李仁分离蛋白的变性温度,且其变性温度随着酶解时间的延长而降低。这主要是因为酶解诱导小分子肽链的形成,而这些小分子肽链在热处理过程中,更易于发生结构变化,从而降低了蛋白质的热稳定性。
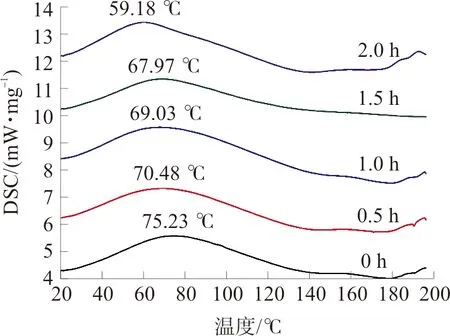
图11 限制性酶解处理对郁李仁分离蛋白热稳定性的影响
3 讨论
本研究采用碱性蛋白酶,是因为对于大多数植物蛋白而言,碱性蛋白酶比中性蛋白酶、复合蛋白酶、风味蛋白酶和木瓜蛋白酶具有更高的水解度[12]。因此,在获得相同水解度的时候,采用碱性蛋白酶所需的时间将更短。此外,碱性蛋白酶也被广泛用于藜麦蛋白、花生蛋白、大米蛋白、火麻仁蛋白和鹰嘴豆蛋白等植物蛋白的水解[21]。
本研究采用SDS-PAGE法对蛋白质亚基进行分析,该方法仅能对蛋白质亚基含量变化进行半定量分析,即通过观测相应条带的增减或者粗细来判断亚基含量的多少。因此,未来可以采用凝胶色谱柱或者分子筛技术对相应亚基进行分离纯化,继而对其进行定量和定性分析,这也可以为进一步阐释酶解修饰的分子机制提供理论依据。
酶解修饰导致蛋白质的二级结构由有序转向无序,主要因为酶解破坏了蛋白质一级结构中的氨基酸序列,从而导致维持二级结构的分子间相互作用力发生了变化,具体反映在二级结构中无规则卷曲含量的增加[22]。然而,过度酶解却导致二级结构中无规则卷曲含量的下降。这可能是因为酶解导致郁李仁分离蛋白内部的疏水性基团、氨基或者羟基过度的暴露,而这些暴露的基团可以通过疏水相互作用或者氢键迫使蛋白质重新形成有序的结构。导致蛋白质内部分子过度暴露的修饰技术不仅局限于酶解修饰,其他修饰技术,例如超声波,也会诱导植物蛋白内部基团的过度暴露,从而出现蛋白质重新聚集的现象[1,23-24]。
蛋白质内源荧光的强弱可以反映蛋白质三级结构的变化[25]。本研究表明,适度酶解可以诱导蛋白质三级结构发生去折叠化,而过度酶解却可以诱导蛋白质发生聚集现象,从而产生荧光遮蔽效应,具体反映在荧光强度的下降。这一现象与二级结构中无规则卷曲比例下降相一致(图3)。
酶解修饰最显著的特征便是小分子量肽链的增加、内部基团的暴露以及结构发生去折叠化,这些变化均可以增强蛋白质分子与水分子之间的亲和性,从而改善蛋白质的溶解性和乳化性[12,26]。此外,蛋白质溶解性随着酶解时间的延长而增加,这主要是因为小分子量肽链的释放随着酶解时间的延长而增加。这一点可以通过图2中蛋白质亚基组成的变化来证明,即蛋白质中小分子亚基的生成随酶解时间的延长而增加。
酶解修饰对郁李仁分离蛋白乳化性的改善主要归因于具有两亲性的多肽的释放以及蛋白质内部游离氨基的暴露,从而提高蛋白质在油水界面的吸附速度以及降低油水界面的表面张力[27]。而过度酶解所导致的乳化性能下降,可能与过度酶解诱导蛋白质聚集和亲水性基团的释放相关。前者可以降低蛋白质在油水界面的吸附速度,后者可以降低蛋白质在油水界面的吸附能力。
总而言之,限制性酶解技术可以显著改善郁李仁分离蛋白的溶解性、乳化性以及表面疏水性。这些功能特性的改善主要取决于限制性酶解处理对郁李仁分离蛋白结构的修饰作用,即诱导一级结构中小分子肽链的释放、诱导二级结构中无规则卷曲比例的增加,诱导三级结构发生去折叠化。然而,本文仅涉及郁李仁分离蛋白的基础性研究,并未探讨改性后的郁李仁分离蛋白的应用。鉴于改性后的郁李仁分离蛋白具有较好的溶解性、乳化性以及表面疏水性,未来的应用研究可以考虑其作为脂溶性功效成分的载体或者天然乳化剂。
