河北省野生苔草属植物ISSR分子标记开发及亲缘关系分析
2023-11-02周欣莹耿宇航贾艳艳孙浩男刘冬云
周欣莹,耿宇航,贾艳艳,孙浩男,刘冬云,李 艳
(河北农业大学园林与旅游学院,河北 保定 071000)
莎草科(Cyperaceae)苔草属(Carex)植物种类多,分布极广,全球约有2 000种,我国约有500种[1-2],其中,河北省内约有45种[3]。苔草属植物种类繁多,适应性强,观赏价值高,能够作为优质的草坪地被植物[4]。同时,苔草属植物在生态修复方面也发挥着重要的作用[5]。在苔草属的分类中,常常以小穗的单性或两性以及鳞片、果囊的差异等特征定性,形态学鉴定较为困难。要识别特定的苔草,首先确定其亚属定位,然后是选择正确的分组[6],因此有必要开发分子标记来鉴定和区别苔草属植物。
目前,用于研究苔草属植物的分子标记较少。Nagasawa等[7]基于二代转录组测序开发了日本北部索尔法塔拉地区的特有植物C.angustisquama的EST-SSR分子标记,并与其近源种C.doenitzi、C.podogyna进行分析后发现,C.angustisquama的较低多态性可能是由于种群进化关系导致。Jiménez-Mejías等[8]提出并讨论了ETS、ITS、matK 3种分子标记方法开发大型系统发育假说,以及这3种分子标记的使用方法,提出了新定义的系统发育假说,这也是苔草属植物的第一个大规模系统发育假说。我国学者常采用ISSR分子标记对苔草属进行研究,ISSR分子标记技术有操作简便、稳定性高等优点[9]。宁花等[10]建立了山东省苔草属植物的ISSR最优体系,并对28份山东省苔草属种质资源进行遗传多样性分析;胡延萍等[11]使用正交优化方法建立了黑褐苔草(C.atrofusca)的ISSR-PCR体系,扩增出了清晰稳定的条带。
河北省有着丰富的苔草属种类,但尚未系统性地调查收集这些种质资源,《河北省植物志》目前所记录的45种苔草中,大部分仅在花果期才能进行较为有效的区分和鉴定,极大地影响了其研究和开发利用。因此,本研究优化并建立了适用于河北省野生苔草属植物分类鉴定的ISSR分子标记体系,进行遗传多样性及亲缘关系分析,旨在从分子角度上为苔草属分类、鉴定、育种及指纹图谱等研究提供参考。
1 材料和方法
1.1 材料
供试材料包括33种河北省野生苔草(根据《河北省植物志》及《内蒙古植物志》鉴定),采自保定市、雾灵山、小五台山及承德等地,以及20份国外引种的苔草种质,共计53份,引种收集后栽植于河北农业大学试验基地,并对其表型性状进行测量和描述,详见表1。
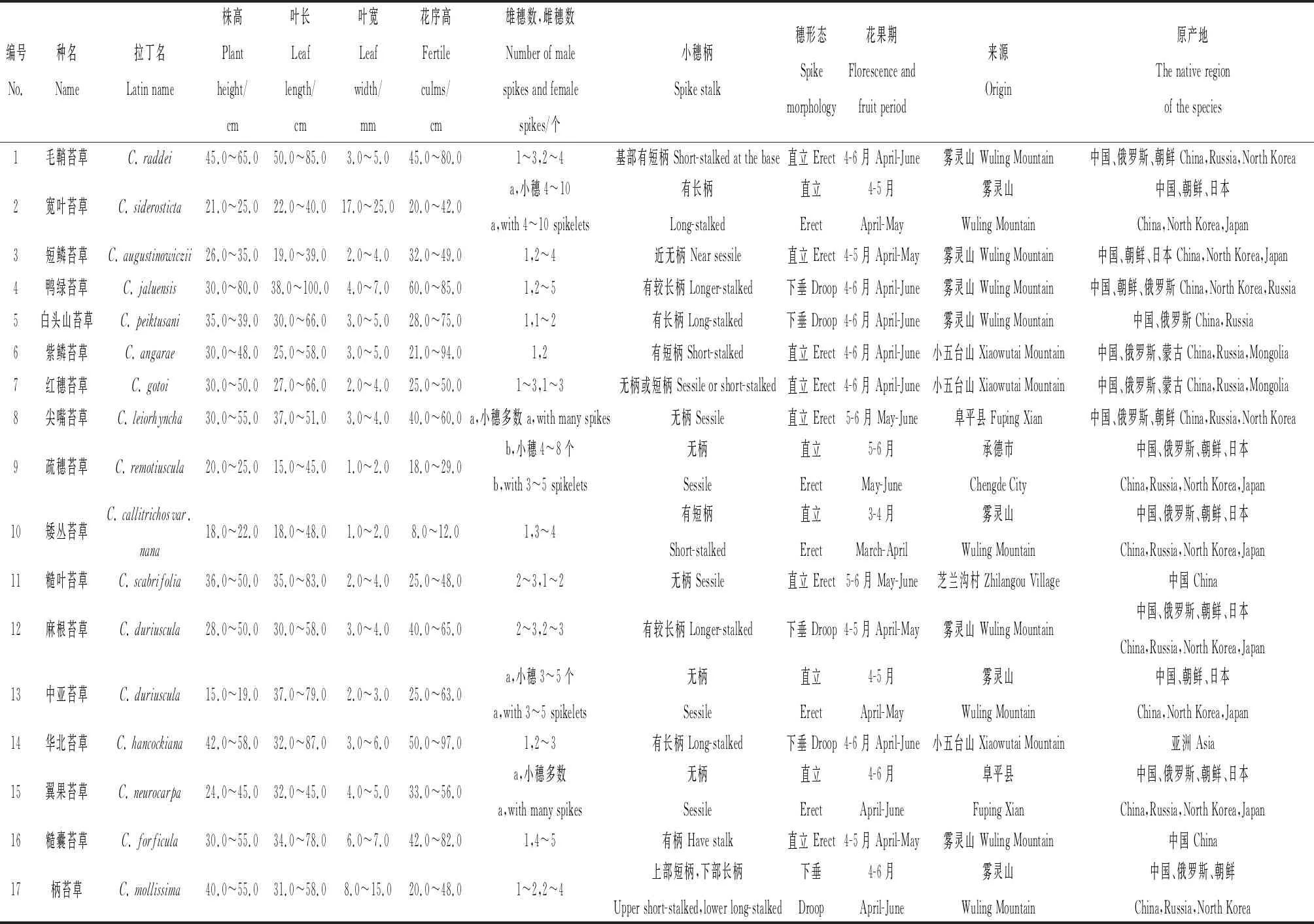
表1 供试苔草信息Table 1 The information of the tested Carex species
1.2 方法
1.2.1DNA的提取及目标引物的筛选 按照DNA提取试剂盒(CW0531S,康为世纪)说明书步骤提取53份苔草样本的DNA后,用Nano Drop微量分光光度计进行DNA纯度检测并使用1.2%的琼脂糖凝胶进行电泳检测。将DNA母液稀释至40 ng·μL-1。利用加拿大哥伦比亚大学(UBC)所公布的100条ISSR通用引物进行试验,选取中亚苔草和异鳞苔草DNA为模板进行初筛,去除无扩增产物以及弥散严重的引物,筛选出扩增产物稳定、条带清晰且多态性较好的引物。25 μL PCR反应体系:2 μL DNA模板、2 μL引物(6 μmol·L-1)、12 μL Master Mix,用ddH2O补足。PCR反应程序:94℃预变性3 min,94℃变性30 s,退火45 s,72℃延伸1 min,38个循环,72℃延伸10 min,4℃保存。试验所用引物、Master Mix和2 000 bp DNA marker均购自北京天根生物有限公司。
根据公式:η=1-(1-1/2)n(n为样品数,η为有多态性引物的选中概率),计算选中的有多态性引物的概率。本研究利用4个DNA样品进行测试,则有多态性引物的选中概率为93.75%。
1.2.2ISSR反应体系单因素优化 以U845为引物,芒髯苔草‘香草冰’的DNA作为模板,对DNA模板含量、引物浓度、Master Mix含量和循环数设定6个梯度,以单因素优化法进行4组试验(表2),如:当进行DNA模板优化试验时,其他3组因素保持不变,使用1.2.1中PCR反应体系及程序。

表2 ISSR-PCR反应体系的单因素优化Table 2 ISSR-PCR amplification by the single factor experiment
1.2.3ISSR-PCR反应体系正交优化 对各因素优化筛选后,选择能扩增出清晰条带的3个梯度进行正交优化,参考董如何等[12]的方法设计L9(34)正交表(表3)。

表3 ISSR-PCR反应体系的正交优化Table 3 Orthogonal design for ISSR-PCR
1.2.4ISSR-PCR正交反应体系优化结果评价 参照张丽[13]的方法,按照扩增出条带的数目、亮度、清晰度及特异性分别对9个组合评分,条带多、亮、无杂带拖带的得分最高,为6分,条带少、弱、拖带多的得1分,按照评分结果计算方差、极差,确定最佳体系与各因素对体系的影响。
1.2.5引物筛选及退火温度的优化 根据引物的Tm值来确定最优退火温度。以中亚苔草和翼果苔草的DNA为模板,设定退火温度为46.4℃,47.6℃,48.8℃,50℃,51.2℃,51.4℃,52.1℃,53.2℃,54.4℃,55.6℃,56.8℃,58.0℃。
1.2.6ISSR-PCR反应体系正交优化结果验证 随机挑选U823、U840、U845、U876这4条引物,对随机选出的宽叶苔草、矮丛苔草、白鳞苔草、早春苔草4份苔草样本进行扩增。验证所得到的ISSR-PCR反应体系,观察条带是否清晰且多态性高。
1.2.7数据分析 按照人工读带的原则[10],记下所有在产物同一区域显示出来的条带,将清晰、无拖尾的条带记为“1”,模糊或无条带的显示记为“0”,将统计结果输入Excel待分析。使用NTsys软件,采用UPGMA法绘制聚类图,使用POPGENE软件计算有效等位基因数(Ne)等指数。
2 结果与分析
2.1 形态学特征分析
由表1可知,供试苔草属植物的小穗分为小穗两性和小穗单性,小穗两性即为在同一小穗中存在雌雄同序的情况,包括翼果苔草、尖嘴苔草、卵囊苔草、细叶苔草、中亚苔草、疏穗苔草、棕榈叶苔草、宽叶苔草、紫鳞苔草、紫喙苔草、华北苔草、白头山苔草等,其中紫鳞苔草、华北苔草、白头山苔草均为顶生小穗雌雄顺序,其余小穗均为雌性。小穗单性雌雄同株的有毛鞘苔草、早春苔草、披针叶苔草、金穗苔草等。苔草种间的雌雄小穗数量也有差异,青绿苔草、短鳞苔草、早春苔草、矮丛苔草等的花序大多顶生1个雄小穗,2~4个雌小穗,毛鞘苔草、麻根苔草、糙叶苔草等的花序上部1~3个为雄小穗,下部2~3个雌小穗。小穗形态有直立和下垂两种形式,具短柄或无柄的小穗直立,包括青绿苔草、异鳞苔草、红穗苔草等;小穗柄长且种子数量大的易下垂,如鸭绿苔草、麻根苔草、扁囊苔草、森林苔草等。
不同种苔草的叶长叶宽不同,毛鞘苔草、鸭绿苔草、糙囊苔草、华北苔草等叶长较长,最长可达80.0~100.0 cm,‘宝藏岛’、金穗苔草、扁囊苔草、棕榈叶苔草等的叶长较短,为30.0 cm以下。宽叶苔草、‘宝藏岛’、柄苔草、三裂苔草等的叶宽较宽,最宽可达10.0~25.0 mm,细叶苔草、矮丛苔草、乌苏里苔草、干生苔草等的叶片较窄,在1.0~2.0 mm之间。
不同种苔草的自然丛高和花序高度也有差异。毛鞘苔草、华北苔草、鸭绿苔草、糙囊苔草等自然丛高可达50.0~80.0 cm,花序高度可达80.0 cm以上,植株较高;早春苔草、披针叶苔草、短鳞苔草、芒髯苔草‘香草冰’等自然丛高30.0~50.0 cm,花序高度20.0~50.0 cm,植株中等;而宽叶苔草、青绿苔草、矮丛苔草、金穗苔草等的自然丛高大多在30.0 cm以下,花序高度在50.0 cm以下,其中矮丛苔草花序较短为8.0~12.0 cm,隐藏于叶丛中。
2.2 DNA模板用量优化结果
模板DNA用量对PCR反应影响结果见图1。当模板用量过低时,扩增得到的条带数较少、颜色较淡。模板DNA处于60~80 ng时,扩增的条带清晰且明亮。
2.3 目标引物浓度优化结果
不同引物浓度对PCR反应影响结果见图2。引物浓度为3 μmol·L-1时最暗淡且不清晰,引物浓度在4~6 μmol·L-1之间时,能扩增出较为清楚的条带。当引物浓度大于6 μmol·L-1时,扩增得到的条带有拖带。
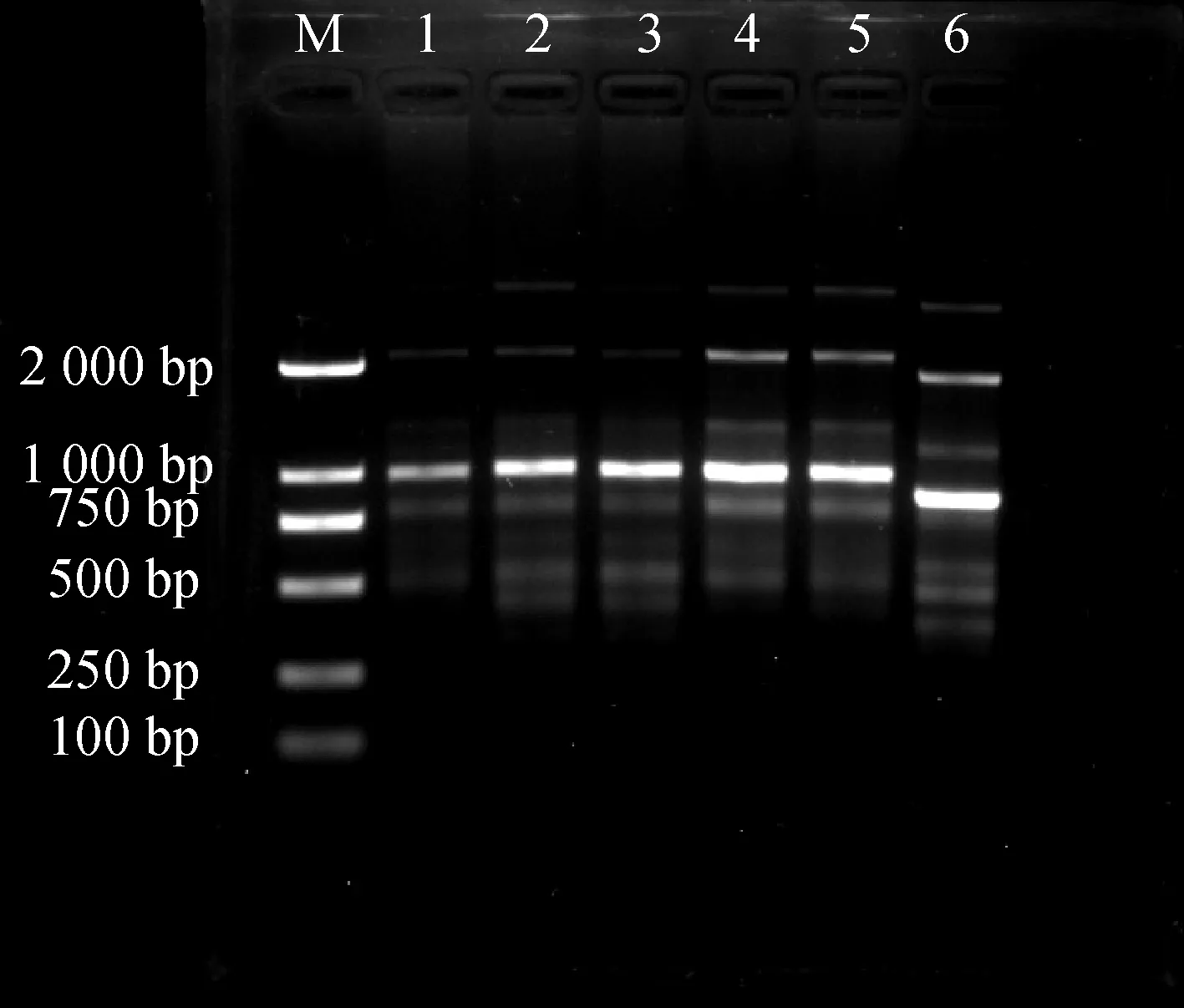
图1 DNA模板用量对ISSR-PCR反应体系的影响Fig.1 Effects of DNA dosage on ISSR-PCR reaction system注:M:DL 2000 DNA Ladder;1~6 DNA浓度分别为30,40,50,60,70,80 ngNote:M:DL 2000 DNA Ladder;1~6 DNA concentration of 1~6;30,40,50,60,70,80 ng respectively
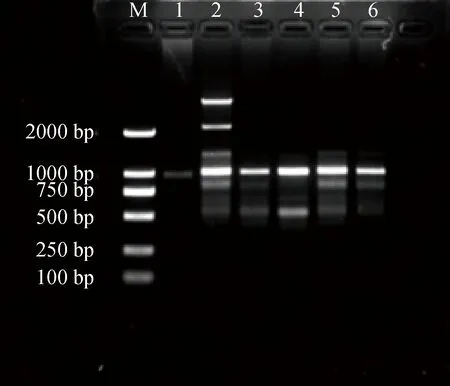
图2 引物浓度对ISSR-PCR反应体系的影响Fig.2 Effects of primers on ISSR-PCR reaction system注:1~6引物浓度分别为3.0,4.0,5.0,6.0,7.0,8.0 μmol·L-1Note:Primer concentration of 1~6:3.0,4.0,5.0,6.0,7.0,8.0 μmol·L-1 respectively
2.4 Master Mix体系用量优化结果
Master Mix含量对PCR体系影响结果见图3。Mix加入量小于11 μL时,扩增条带浅且数量较少。含量在11~14 μL时扩增条带变多且稳定清晰。考虑节约成本,11 μL为Mix最佳用量。
2.5 ISSR-PCR反应循环数优化结果
循环数对PCR反应体系的影响见图4。28个循环下无扩增条带出现,33个循环下条带颜色淡且模糊,53个循环下条带过亮且有拖带。38,43和48循环下均有条带产生,但38和43个循环扩增出的条带少,当PCR循环数为48时,条带清晰且稳定,故PCR反应循环数最佳为48个循环。
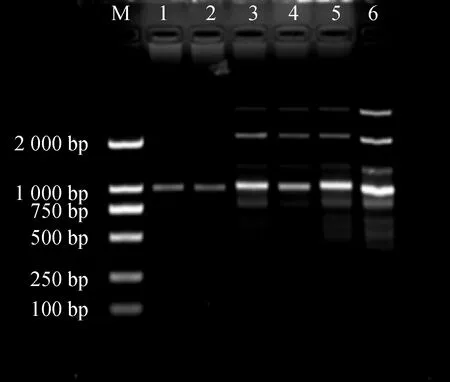
图3 Master Mix用量对ISSR-PCR反应体系的影响Fig.3 Effects of the Master Mix dosage on ISSR-PCR reaction system注:1~6 Master Mix用量:9.10.11.12.13.14 μLNote:The Master Mix dosage of 1~6:9.10.11.12.13,14 μL
2.6 ISSR-PCR反应体系的正交优化
检测ISSR-PCR正交优化扩增产物,见图5。结果表明,在9组不同组合中,组合1扩增条带弥散不清晰;组合2,3,4,9扩增条带极少且条带较暗或过亮;组合5,6,7,8扩增条带清晰且明亮,其中组合8扩增条带效果最好。3次重复评分分别为:
(1)1,2,3,3,4,4,4,6,2
(2)1,2,3,3,4,5,4,6,2
(3)1,2,3,4,4,5,5,6,2
用SPSS 22.0对评分结果进行分析,并计算各因子在4个试验水平的极差值(T值)和δ值。T值越大表示对ISSR-PCR扩增的影响越大,各因子浓度水平的影响从大到小依次为:模板DNA>循环数>Master Mix>引物(表4)。δ值的大小可以确定对应因素水平组合。由表4可知δ31>δ21>δ11,δ22>δ31>δ11,δ13>δ33>δ23,δ34>δ24>δ14,因此组合为A3B2C1D3(ABCD表示四个因素,该组合的下标表示该因素所在的水平)得到ISSR-PCR扩增的最优结果。由表5可知,模板DNA、引物、Master Mix、循环数对试验结果影响显著(P<0.05)。此时25 μL反应体系为模板DNA 80 ng,引物浓度5 μmol·L-1,Master Mix用量11 μL,循环数48个。

图5 ISSR-PCR反应的正交优化Fig.5 ISSR-PCR amplification by the optimal reaction system

表4 不同试验因子极差分析表Table 4 Score of different factors
2.7 ISSR引物筛选及多态性分析
以中亚苔草和翼果苔草的DNA为模板,首先在50℃退火温度下对100条通用引物进行扩增,初筛出条带清晰且有多态性的12条引物,再设置12个梯度对12条引物进行扩增,部分结果见图6。最终筛选的12条引物全部能扩增出清晰明亮且多态性良好的条带,详见表6。
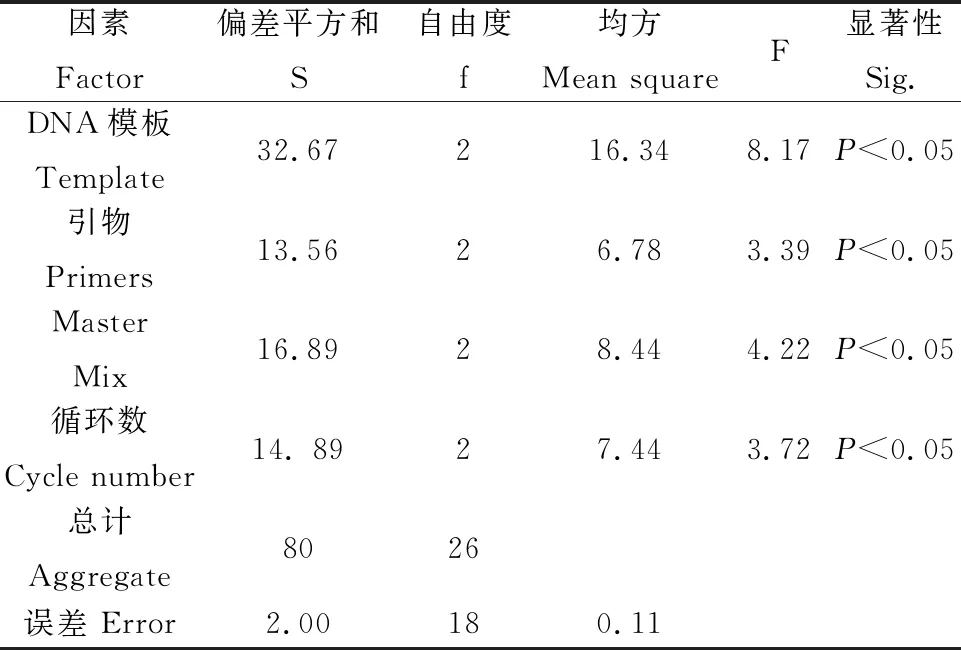
表5 ISSR-PCR正交试验方差分析Table 5 Optimal results of ISSR-PCR reaction
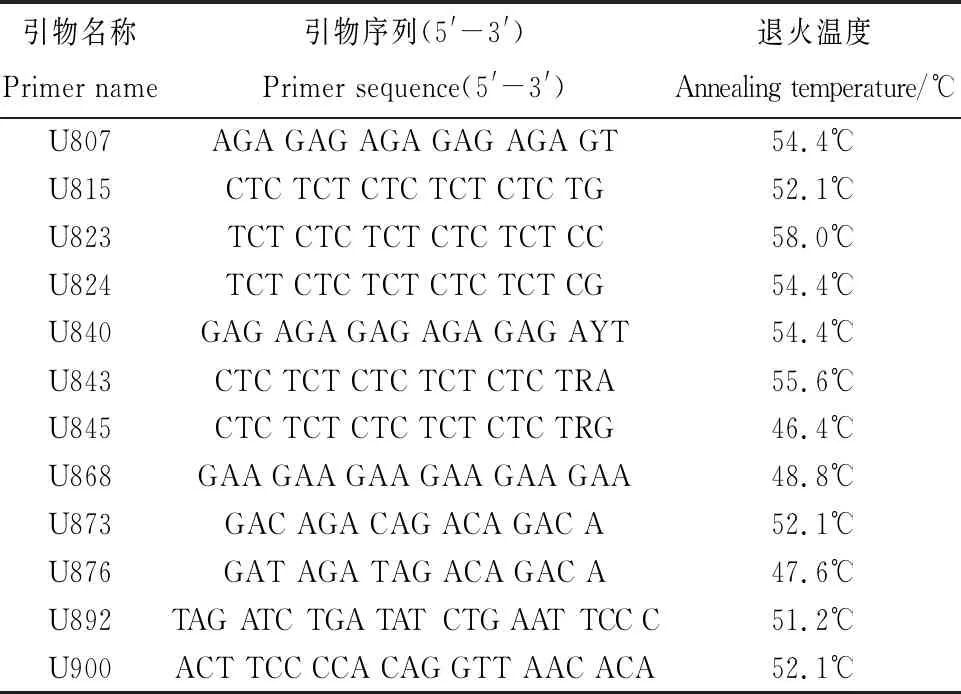
表6 ISSR引物信息Table 6 Information of 12 ISSR primers
2.8 ISSR-PCR反应体系的验证
随机挑选4个引物,使用优化过的反应体系对4份苔草样本进行扩增,结果见图7。不同的引物在不同苔草样本中均能扩增出清晰、明亮的条带。因此,本研究所建立的苔草属ISSR-PCR反应体系是稳定、可靠的,适用于后续苔草属的ISSR分析。
2.9 亲缘关系分析
2.9.1引物多态性分析 从100条ISSR通用引物中筛选出12条引物,共扩增出197条清晰条带,全部为多态性条带。每个引物平均扩增出16.4个条带,多态性百分比为100%,其中,扩增出来的多态性条带最多为引物U807,数量为22条,扩增出来的多态性条带数最少为引物U868和引物U873,数量为13条(表7),进一步证实了苔草属植物变异较广,且具有丰富的遗传度。部分扩增结果见图8、图9。
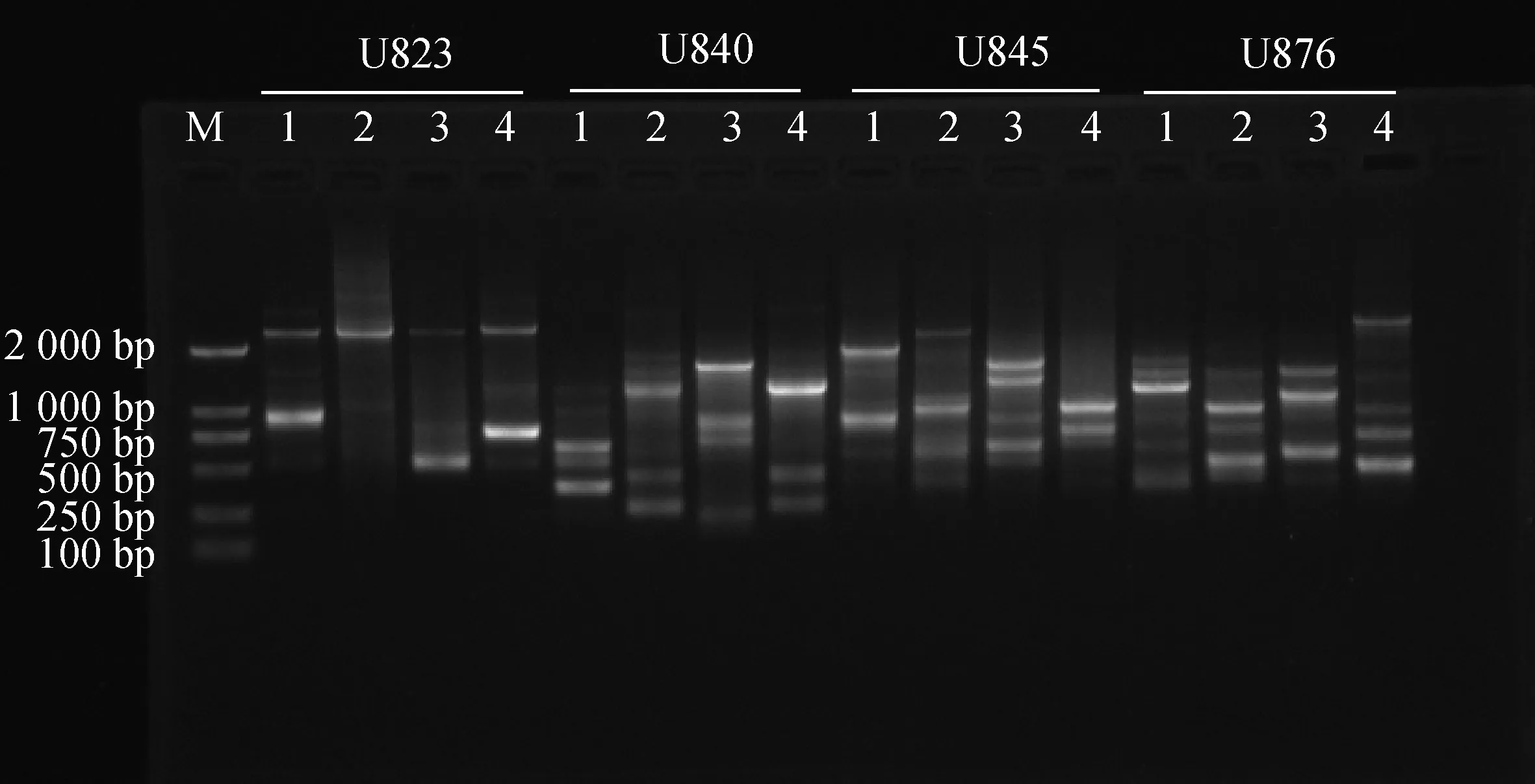
图7 ISSR-PCR优化反应体系的验证Fig.7 Verification of ISSR-PCR optimized reaction system注:1,宽叶苔草;2,矮丛苔草;3,白鳞苔草;4,早春苔草Note:1,C. siderosticta;2,C. callitrichos var.nana;3,C. pisiformis;4,C. subpediformi
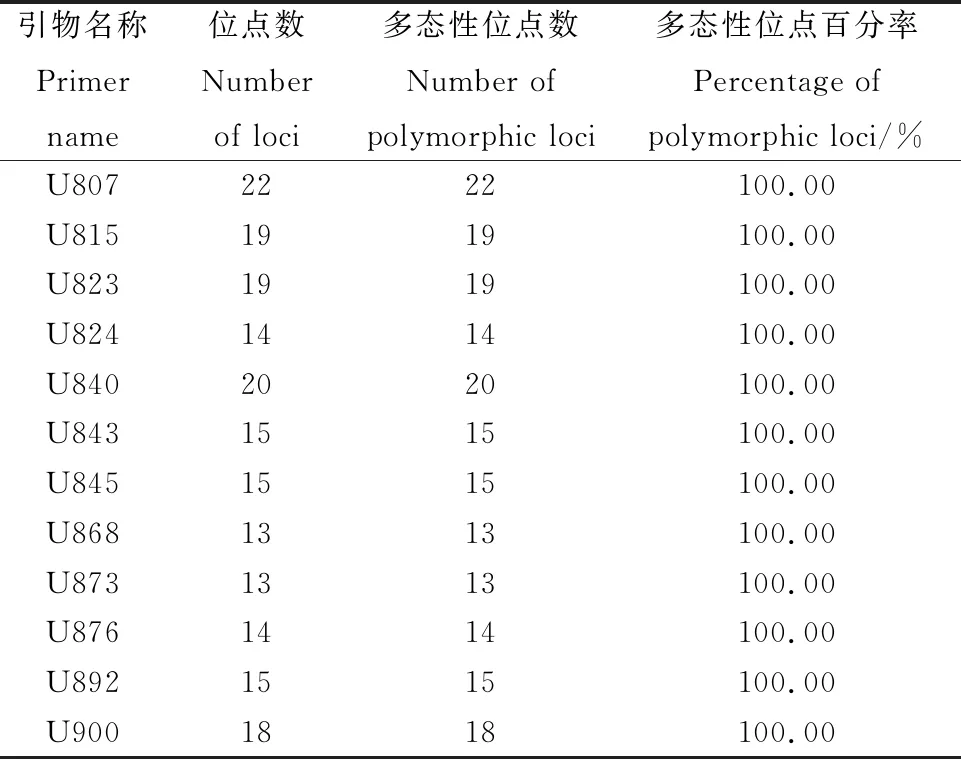
表7 12条引物在苔草属植物中的多态性分析Table 7 Polymorphism of tested Carex species in 12 ISSR primers
2.9.2亲缘关系分析 使用POPGENE对苔草的有效等位基因数(Ne)、基因多样性(He)、多样性信息指数(I)进行分析,结果分别为1.153 8,0.125 7,0.236 6。
使用NTsys对人工读带的0,1矩阵进行分析,利用非加权平均法(UPGMA)得到苔草属的聚类分析图(图10),绝大部分材料都能得到良好的划分,仅长鞭苔草、多刺苔草不能做到有效区分。在遗传距离为0.768处,53份苔草属种质可初步被分成6大类,与苔草属下的分组有一定关联。
第Ⅱ类由糙叶苔草与索兰德苔草组成,原产于中国和新西兰,分别属于苔草亚属沼生苔草组和苔草亚属(Carexsubg.Carex),两种苔草的小穗单性,常具1~4个雄小穗,其余小穗为雌小穗,雌花鳞片棕色,三棱形,但二者在形态上也有一定区别,索兰德苔草的叶宽为0.1~0.2 cm,基部小穗有较长柄,果囊浅棕或深棕色;糙叶苔草的叶宽为0.2~0.4 cm,基部小穗常无柄,果囊淡黄绿色。
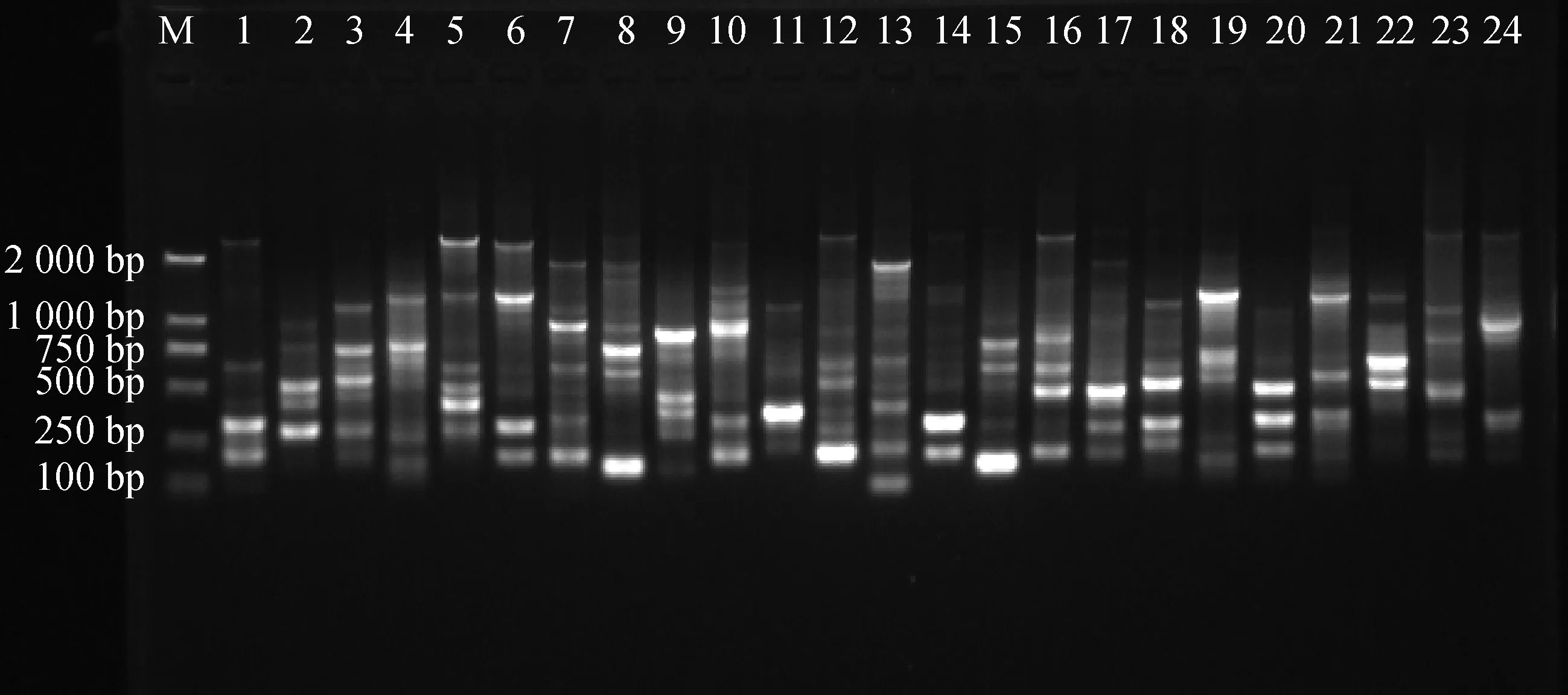
图8 引物U840的部分PCR扩增电泳图谱Fig.8 The electrophoretogram of PCR amplified patterns by ISSR primer U840
第Ⅲ类仅有柄苔草一种,属于苔草亚属中胀囊苔草组。第Ⅳ类仅有三裂苔草,属于苔草亚属(Carexsubg.Carex)。第Ⅴ类由红穗苔草和矮丛苔草组成,属于苔草亚属中沼生苔草组和指状苔草组,两种苔草的小穗单性,雌雄同株,果囊较小,果囊无喙或有短喙,喙口部截形或微凹,这两种苔草的花序高度和形态不同,红穗苔草的花序长于叶片,花序上部1~3个为雄小穗,雌花鳞片暗粟色;矮丛苔草花序短于叶片,常隐藏于叶丛中,顶生1个雄小穗,雌花鳞片中间绿色,两侧栗紫色。第Ⅵ类仅有麻根苔草,属于苔草亚属中膜囊苔草。
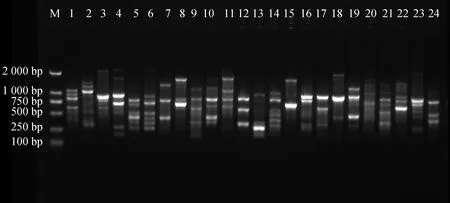
图9 引物U876的部分PCR扩增电泳图谱Fig.9 The electrophoretogram of PCR amplified patterns by ISSR primer U876
其余46个材料皆属于第Ⅰ类,同时包括二柱亚属(Carexsubg.Vignea)、苔草亚属(Carexsubg.Carex)和二柱苔草亚属中烈味苔草组和薮苔草组、苔草亚属中苔草组、宽叶苔草组、溪水苔草组等,二柱亚属(Carexsubg.Vignea)和苔草亚属(Carexsubg.Carex)为Villaverde等对苔草属亚属进行重新分类得出的新亚属,二柱亚属(Carexsubg.Vignea)形态特征为小穗2至多数,两性,聚集成穗状花序,柱头通常2个,与二柱苔草亚属的形态相似,苔草亚属(Carexsubg.Carex)形态特征为小穗通常单性,雌雄同株,柱头3个,与苔草亚属形态相似。且原产于不同国家的苔草聚在一起,表明地域性特点不突出。
3 讨论
12条引物对53种苔草属植物材料中共扩增出197个位点,多态性位点占100%,平均基因遗传多样性指数为0.1257 ,其中,33种河北省野生苔草属植物的平均遗传多样性指数为0.140 7,虽略低于山东省苔草种质[14],但整体上高于目前市面上较为流行的栽培种质。33种河北省野生苔草属植物在引种后发现,绝大部分都具有良好的适应性,虽在观赏特性上逊色于部分园艺品种,但仍有潜力用于后续开发成为良好的乡土植物,并结合一定育种手段筛选极具观赏特性的种质。
本研究收集了29种《河北省植物志》(1991)包含的苔草种质,与《河北省植物志》相比新增了4种苔草属植物,分别是扁囊苔草、干生苔草、灰脉苔草、瘤囊苔草,对于这4份苔草种质的鉴定均参考了《内蒙古植物志》。灰脉苔草、黄囊苔草等6种苔草为黄金祥等[15]在塞罕坝地区发现的新分布。新增材料全部是在河北省承德市塞罕坝北部坝上地区调查时发现,该地区与内蒙古交界,坝上属于内蒙古高原的东南缘[16],交界地区气候特点相似,具有相同的生境。且灰脉苔草与瘤囊苔草均属于苔草亚属中急尖苔草组,在形态学分类上关系较近,仅苞片与果囊不同。干生苔草与黄囊苔草同属于苔草亚属中黄囊苔草组,仅果囊形态与颜色略有不同,在以前的种质鉴定中有可能将其误判。Villaverde等[17]利用转录组测序对苔草属亚属的分类进行检验并重新分类,得到六个亚属分支:(1)宽叶亚属(Carexsubg.Siderostica);(2)蚤苔草亚属(Carexsubg.Psyllophorae);(3)尖苞亚属(Carexsubg.Euthyceras);(4)钩穗苔亚属(Carexsubg.Uncinia);(5)二柱亚属(Carexsubg.Vignea);(6)苔草亚属(Carexsubg.Carex),《中国植物志》将苔草属分为二柱苔草亚属、苔草亚属和复序苔草亚属。我国目前对苔草属下的分类是依据形态学进行分类,对于全国苔草属植物分子标记的系统分类还不完整,苔草属内鉴定与分类工作还需进行。
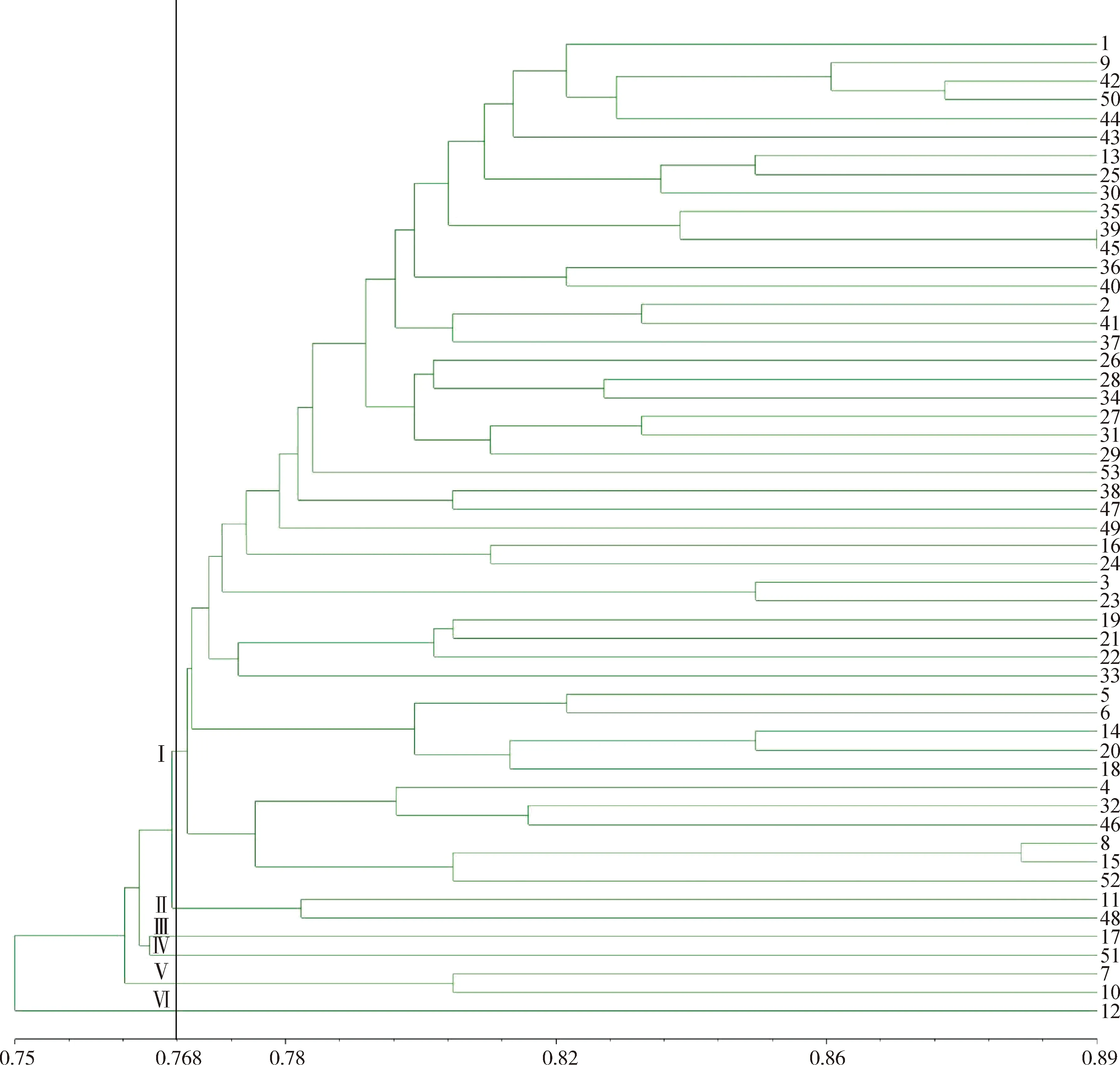
图10 53种苔草属植物遗传距离的ISSR聚类图Fig.10 ISSR dendrogram of 53 species of Carex
植物的交配方式中很少为单纯的自交或异交[18]。苔草属植物的小穗有两性和单性的区别,在两性小穗中又可分为雄雌顺序和雌雄顺序,小穗开花时雌花先成熟,雄花花药散粉后,花粉几乎全部洒落在雌花柱头上,这种特征极大的增加了自交的概率[19]。长期的自交或近交会降低种群的遗传多样性[20]。在对苔草属植物进行野外调查时发现其生境相似,大多分布在林下、水边等。其小穗开花数目多,且花粉粒体积小、质量轻、较干燥有利于随风传播,以风作为授粉媒介[21]。苔草属植物也具有易杂交的特性[22],因此,在同一生境下,花期相遇的近缘种可能会产生自然杂交,导致种间遗传多样性降低,日本[23]、乌克兰[24]、新西兰[25]等国家均发现苔草属植物的天然杂交种。但自然环境因素、气候因子、人为因素也是影响遗传分化的重要因素[26]。
根据位点分析得到的UPMGA聚类图可将53份供试材料分为6大类,苔草属植物分子标记聚类结果与传统聚类结果基本相符,但两者也存在一定程度的分歧,传统聚类方式是依据形态学性状对其分类,形态学性状是由基因与环境共同调控的,而分子标记的结果直接反应供试材料基因水平差异[27]。荷兰引种的‘宝藏岛’‘小矮人’与德国引种的多花苔草、索兰德苔草分别与河北省野生苔草属材料遗传距离较近,其原因可能是苔草的遗传多样性与原产地分布没有显著差异,符合刘凌云等[28]得出地域对苔草的遗传多样性没有显著差异的规律。对于一些亲缘关系较近的种质,很多分子标记难以对其进行区分,本研究使用的ISSR引物为通用引物,显示的结果会存在部分偏差。筛选出的12条引物可以将河北省野生苔草区分开,但是对于部分国外栽培种质区分不开,其中长鞭苔草与多刺苔草的遗传距离为1,但是两者小穗的形态和结构完全不同,因此在实际应用中需将形态学标记与分子标记充分结合才能对苔草属的分类进行更加准确的描述或区分。
4 结论
本研究首次建立并优化了适用于河北省野生苔草属的ISSR-PCR反应体系。25 μL反应体系采用模板DNA用量80 ng,引物浓度5 μmol·L-1,Master Mix用量11 μL,循环数48个。12条ISSR引物扩增出197条清晰明亮的条带,全部为多态性条带。可有效区分33种河北省野生苔草。在遗传距离为0.768时可将53份苔草种质划分为6类,聚类结果与形态学分类的结果基本吻合,种间亲缘关系与地理环境有一定的相关性。本研究从分子角度上为苔草属植物的分类鉴定、构建指纹图谱及育种等提供了理论参考。
