海雀稗PvCIPK9基因克隆及耐盐功能鉴定
2023-11-02宋志钢卢少云
宋志钢,刘 颖,刘 瑞,卢少云*
(1.华南农业大学生命科学学院,广东 广州 510642;2.青海大学农牧学院,青海 西宁 810016)
植物在生长发育过程中会受到各种不利的环境胁迫,如高盐、干旱、寒冷和病原体等。为了应对环境的波动以完成完整的生命周期,植物进化出了复杂的信号转导途径。钙是植物细胞信号转导中重要的第二信使,能够将外界信号转化为胞内信息,从而对特定的环境刺激做出相应的反应[1]。当植物遭受到环境胁迫后,以游离Ca2+的瞬时变化作为信号将外界环境信息传递到植物细胞内。这种Ca2+信号首先被钙离子感受器感知解码,再将信号向下游传递。高等植物的钙感受器已知有三类:钙依赖性蛋白激酶(Calcium-dependent protein kinases,CDPKs)、钙调素(Calmodulins,CaMs)/类钙调素蛋白(Calmodulin-like proteins,CMLs)、类钙调磷酸酶B蛋白(Calcineurin B-like proteins,CBLs)[2-3]。CBL是一类独特的钙感受器,CBLs自身没有酶活性,因此在它结合Ca2+后,还需要与其下游互作蛋白CIPKs(CBL-interacting protein kinases)结合才能发挥应有的生物学功能[4]。CBLs和CIPKs共同形成了以Ca2+介导的CBL-CIPK网络,这是近十几年来植物逆境信号转导的研究热点之一[5]。
CIPKs蛋白主要包含两个结构域:N端激酶结构域(Kinase domain)和C端调节结构域(NAF domain)。N端激酶结构域内有一个激活环(Activation loop),磷酸化激活环可激活蛋白激酶的活性。C端调节结构域内有一个保守的NAF结构域,NAF结构域既与CIPK分子内部的自我抑制相关,又可以与CBL特异性结合[6-7]。在NAF邻近位置有一个相对保守的PPI基序(Protein phosphatase interaction motif)能够与2C型蛋白磷酸酶(Protein phoshphatase 2C)之间发生蛋白互作[8]。
作为植物特有的Ca2+信号传导网络,CBL-CIPK信号网络在植物的生长发育、生殖及逆境响应等方面都发挥着极其重要的作用。许多CBL或CIPK通过调控植物体内Na+/K+和活性氧(Reactive oxygen species,ROS)平衡,参与植物对盐胁迫的响应,例如玉米(Zeamays)ZmCIPK21[9]、小麦(Triticumaestivum)TaCIPK24[10]、大豆(Glycinemax)GmCIPK10[11]等均参与了对盐胁迫的响应。随着对CBL-CIPK信号系统研究的深入,发现了越来越多的CBL和CIPK蛋白参与调控植物对各种逆境胁迫的响应。除盐胁迫以外,CBL、CIPK也参与对其它逆境的响应。拟南芥(Arabidopsisthaliana)AtCBL1-AtCIPK7,水稻(Oryzasativa)OsCIPK1和OsCIPK3参与植物对冷胁迫的响应[12-13],番茄(Solanumlycopersicum)SlCBL10-SlCIPK6参与植物对丁香假单胞菌(Pseudomonassyringae)病原的免疫反应[14]。同一个CBL或CIPK蛋白可以参与植物不同逆境的响应,比如过表达MdCIPK6L同时增强了转基因植株的耐盐性、耐旱性和抗冷性[15],OsCIPK15同时参与植物对盐、低氧胁迫和微生物病原的响应[16]。过表达水稻OsCIPK3提升植株对冷的耐受力,但会导致转基因植株对盐敏感[12,17]。大量的研究结果证明了CBL-CIPK具有多种多样的抗逆功能,对CBL-CIPK信号成分的挖掘和鉴定,不仅有助于解析植物在逆境胁迫应答的分子机制,同时为基因工程改良作物的抗逆性提供了基因资源。
盐生植物海雀稗(Paspalumsvaginatium)是禾本科(Gramineae)黍族(Paniceae)雀稗属(Paspalum)的一种多年生草本植物[18]。海雀稗兼具多种优良特性,如耐盐、耐涝、耐践踏和耐修剪等,对极端酸性土壤、碱性土壤等非生物胁迫也具有较高的耐性[18]。目前对海雀稗的研究主要集中在种间或品种间的耐逆性评价[19-20],在海雀稗关键耐盐基因的克隆和功能研究方面较少[21],因此挖掘海雀稗的耐盐基因资源,揭示海雀稗耐盐分子机制迫在眉睫。
实验室前期研究发现在海雀稗盐胁迫转录组数据中,PvCIPK9基因可能参与响应盐胁迫。为了深入研究PvCIPK9基因,克隆得到了PvCIPK9序列全长,并对其蛋白理化性质、结构特点等进行了分析和预测。为验证PvCIPK9基因在抗逆中的作用,本研究构建了过表达载体并转化拟南芥,获得了过表达PvCIPK9拟南芥植株,验证了过表达PvCIPK9对拟南芥耐盐性的影响。
1 材料与方法
1.1 试验材料
海雀稗(PaspalumvaginatumO.Swartz)品种‘Sea Spray’植株及拟南芥野生型(Col-0)种子为本实验室保存。
1.2 海雀稗PvCIPK9基因克隆与生物信息学分析
本研究以海雀稗的转录组数据库的序列为参考序列,设计特异性引物,以海雀稗cDNA为模板,利用PCR扩增PvCIPK9基因CDS序列。采用生物信息学网站(https://web.expasy.org/protparam/)分析该蛋白的理化性质。根据在线网站SignalP-4.1(https://services.healthtech.dtu.dk/services/SignalP-4.1/)对PvCIPK9进行信号肽结构预测,使用在线网站TMHMM-2.0(https://services.healthtech.dtu.dk/services/TMHMM-2.0/)预测PvCIPK9蛋白的跨膜结构域。利用在线软件SWISS-MODEL(https://swissmodel.expasy.org/)进行同源建模。使用NCBI(https://www.ncbi.nlm.nih.gov/)进行保守结构域预测。从NCBI网站获取模式植物拟南芥和水稻的CIPK家族蛋白序列,使用软件MEGA7.0构建系统进化树,构建方法使用邻接法。
1.3 启动子元件分析
通过植物基因组网站(https://phytozome-next.jgi.doe.gov/)获取PvCIPK9基因上游约1 500 bp序列,利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)对PvCIPK9基因启动子序列进行分析。
1.4 PvCIPK9基因表达模式分析
参照Zhang等[22]的方法,构建PvCIPK9与GFP融合表达载体,以mCherry作为Marker蛋白,同时转化水稻原生质体,28℃黑暗条件下培养20~24 h后,利用荧光显微镜下观察GFP和mCherry荧光。其中GFP的激发光和发射光分别为488 nm和507 nm,mCherry的激发光和发射光分别为587 nm和610 nm。
取长势良好且一致的海雀稗幼苗,洗净根部泥土,置于1/2霍格兰营养液中培养一周左右。使用含200 mmol·L-1NaCl的营养液中进行盐处理,以不含NaCl的营养液为对照,在处理2,6,12,24 h时分别对根和叶进行取样,液氮速冻后于-80℃冰箱中保存,待提RNA。
选取生长健壮的海雀稗精心培养至抽穗开花,对海雀稗的根、茎、叶、小穗进行取样,液氮速冻后保存在-80℃冰箱中,待提RNA。
使用RNA提取试剂盒RNAiso plus(9109,Takara)进行植物总RNA的提取。使用反转录试剂盒(RR047A,Takara)进行反应,获得第一链cDNA。以cDNA为模板,参照qRT-PCR试剂盒Tli RNaseH Plus(RR820A,Takara)使用说明书,将反应组分离心混匀后使用荧光定量PCR仪进行扩增,反应程序为:95℃ 3 min;95℃ 5 s,55℃ 30 s,进行39个循环;插入熔解曲线65℃ 5 s,95℃ 5 s。反应结束后确认扩增曲线和熔解曲线,以海雀稗Actin作为内参基因计算基因的相对表达量,数据由软件Bio-Rad CFX Manager(Version3.0)分析并收集。
1.5 植物表达载体构建及拟南芥转化
设计含有Xba I和Bamh I酶切位点的引物(表1),扩增PvCIPK9基因CDS序列,得到带有酶切位点的目的基因片段。用Xba I和Bamh I双酶切该基因片段和pCAMBIA3301质粒载体,经T4 DNA连接酶连接,将连接产物转化大肠杆菌DH5α,经PCR验证,挑选阳性克隆送生物公司测序,将测序正确的pCAMBIA3301重组质粒转化农杆菌感受态EHA105。用花序侵染法转化野生型拟南芥,在含有Basta的培养基筛选转基因抗性植株,使用CTAB抽提法提取DNA,通过PCR法鉴定转基因植株阳性苗。再经过自交和筛选后得到T3代转基因拟南芥,用于后续试验。
1.6 转基因拟南芥的耐盐性分析
挑选籽粒饱满、大小均匀的拟南芥种子,放于2 mL离心管内。在超净工作台内,加入75%乙醇消毒5 min,灭菌水清洗。加入15%次氯酸钠溶液消毒15 min期间须多次振荡。使用无菌水冲洗6~8次。将消毒后的种子均匀的点在1/2 MS培养基上,放于4℃冰箱春化处理2~3 d。将培养皿置于温度25℃,光暗周期为16 h∶8 h,光照为200 μmol·m-2·s-1的人工智能培养箱内培养。培养7 d的幼苗,选择长势一致的幼苗转至土壤中培养。将生长三周左右的幼苗进行盐处理,先用50 mmol·L-1NaCl浇灌4天,再把处理浓度提高至100 mmol·L-1NaCl,观察拟南芥生长表型。
1.6.1种子萌发率 取野生型和2个转基因株系,消毒处理后,无菌水清洗种子,分别播种于1/2 MS培养基(对照)和含有100 mmol·L-1NaCl的1/2 MS培养基(盐胁迫),每皿播种40粒种子,三次重复。春化三天后,置于培养箱培养。每天观察并统计种子萌发情况,连续统计5天,计算萌发率。以种子萌发突破种皮露白5 mm视为萌发。
1.6.2相对生长量 取WT和2个转基因株系进行消毒,无菌水清洗种子,然后播种于1/2 MS培养基上。播种7天后,取长势一致的幼苗移到培养瓶中,内含等量的1/2MS培养基(分别含有0,100,150 mmol·L-1NaCl),每瓶放5株,光下生长20 d后,分别称根系鲜重和地上部鲜重,计算整株鲜重、相对生长量。
1.6.3抗氧化酶活性 粗酶液提取:取0.1 g拟南芥叶片,加入2 mL的缓冲液(SOD、CAT缓冲液(50 mM PBS含1%的PVP,pH7.8)、APX缓冲液(50 mmol·L-1PBS含15 mmol·L-1AsA,0.1 mmol·L-1EDTA,1%的PVP,pH值7.0)),冰上研磨成匀浆,4℃,12 000 r·min-1离心10 min,上清液即为酶的粗提液。参照Chen和Zhuo的方法[23-24]进行超氧化物歧化酶(Superoxide dismutase,SOD),过氧化氢酶(Catalase,CAT),抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)活性的测定。采用考马斯亮蓝G-250测定酶粗提液的蛋白质含量[25]。
1.7 数据统计与分析
所有数据均进行三次重复,利用IBM SPSS 19.0进行统计分析,采用方差分析差异显著性,计算各指标的平均值和标准误,数据均采用3个独立样本的平均值和标准误表示,采用Excel作图,Word制表。不同小写字母表示差异显著性(P<0.05)。实验中用到的所有引物用Primer Premier 5.0软件设计,引物序列见表1。

表1 引物信息Table 1 Primer used in the study
2 结果与分析
2.1 海雀稗PvCIPK9基因的克隆及生物信息学分析
通过克隆获得海雀稗PvCIPK9基因的CDS全长序列(图1a),PvCIPK9基因的开放阅读框(Open reading frame,ORF)全长为1 332 bp,编码443个氨基酸,蛋白分子量为49.87 KDa,理论等电点为8.02,不稳定指数36.34,属于稳定蛋白,亲水性总平均值(GRAVY)为-0.412,属于亲水性蛋白(图1b)。PvCIPK9蛋白没有信号肽结构(图1c),预测该蛋白在第197~216个氨基酸间存在一个跨膜结构域(图1d)。该蛋白具有典型的激酶结构域和NAF结构域(图1f)。
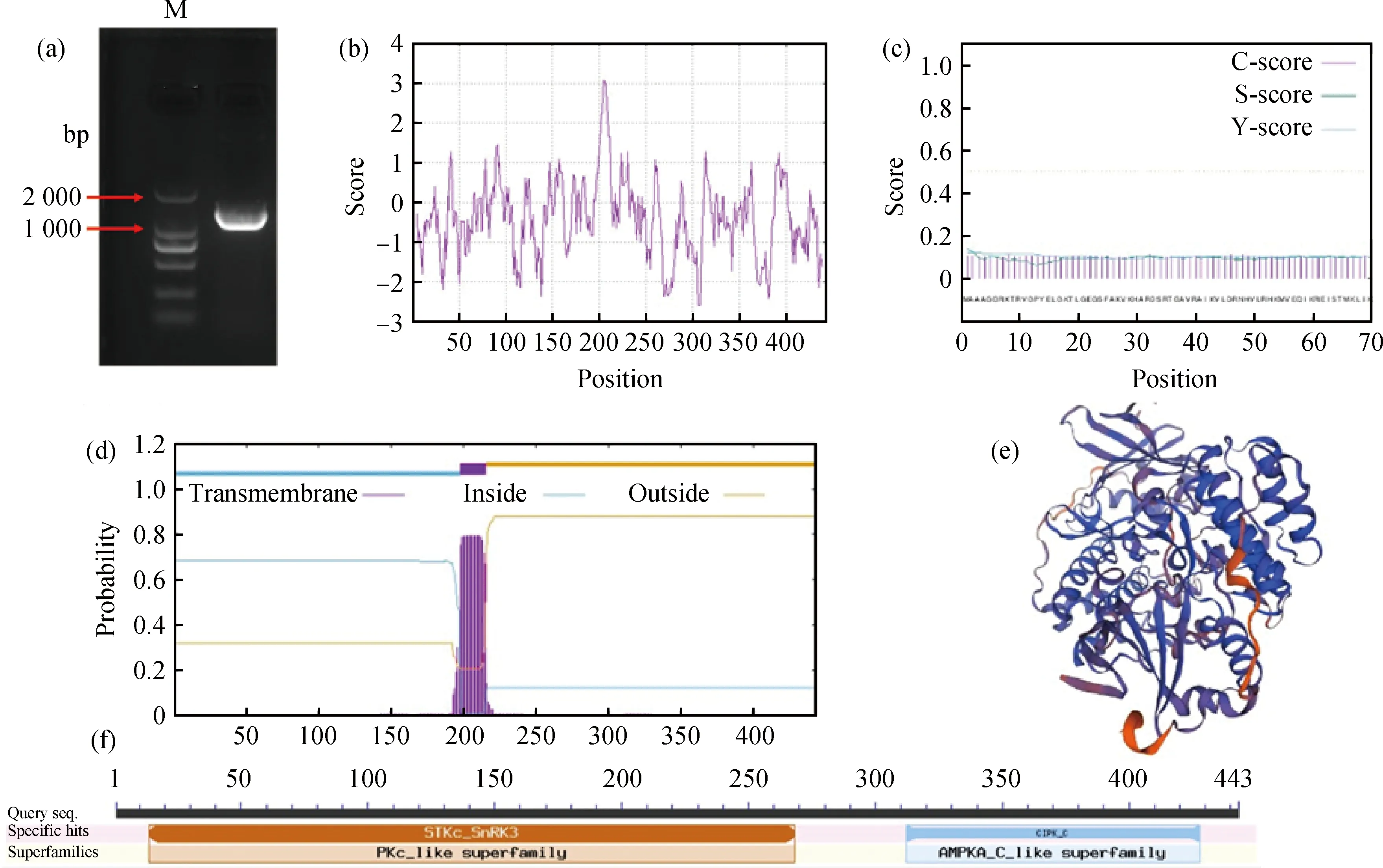
图1 PvCIPK9的生物信息学分析Fig.1 Bioinformatics analysis of PvCIPK9注:(a)克隆PvCIPK9基因(b)海雀稗PvCIPK9蛋白亲水性分析;(c)海雀稗PvCIPK9蛋白信号肽预测;(d)海雀稗PvCIPK9蛋白跨膜结构域预测;(e)海雀稗PvCIPK9蛋白三级结构模型;(f)海雀稗PvCIPK9蛋白保守结构域预测Note:(a)Clone PvCIPK9 gene;(b)Analysis of hydrophilicity of PvCIPK9 protein in P.vaginatum;(c)Prediction of PvCIPK9 protein signal peptide in P.vaginatum;(d)Prediction of transmembrane domain of PvCIPK9 protein in P.vaginatum;(e)Tertiary structure model of PvCIPK9 protein in P.vaginatum;(f)Prediction of the conserved domain of PvCIPK9 protein in P.vaginatum
将PvCIPK9分别与拟南芥26个CIPKs以及水稻33个CIPKs家族成员构建进化树。进化分析结果显示,PvCIPK9分别与拟南芥AtCIPK9(图2a)和水稻OsCIPK9亲缘关系最近(图2b)。
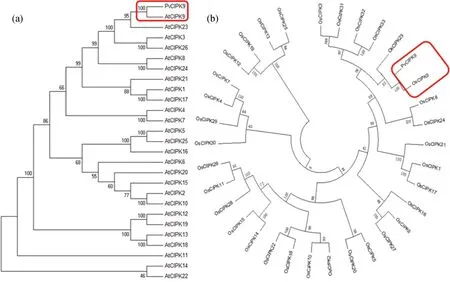
图2 PvCIPK9与拟南芥和水稻CIPKs的进化分析Fig.2 Evolutionary Analysis of PvCIPK9 and Arabidopsis CIPKs and Rice CIPKs注:(a)PvCIPK9与AtCIPKs的进化分析;(b)PvCIPK9与OsCIPKs的进化分析Note:(a)Evolutionary Analysis of PvCIPK9 and AtCIPKs;(b)Evolutionary Analysis of PvCIPK9 and OsCIPKs
2.2 启动子分析
在海雀稗基因组数据中获取PvCIPK9基因上游基因约1 500 bp序列,利用plantCARE对海雀稗PvCIPK9基因启动子元件进行分析,发现启动子区包含多个参与光反应的元件如G-Box,ARE等;多种激素响应元件如生长素反应元件TGA-element,脱落酸响应元件ABRE,水杨酸响应元件TCA-element,茉莉酸响应元件TGACG-motif,CGTCA-motif;逆境胁迫响应元件如LTR,ABRE等。
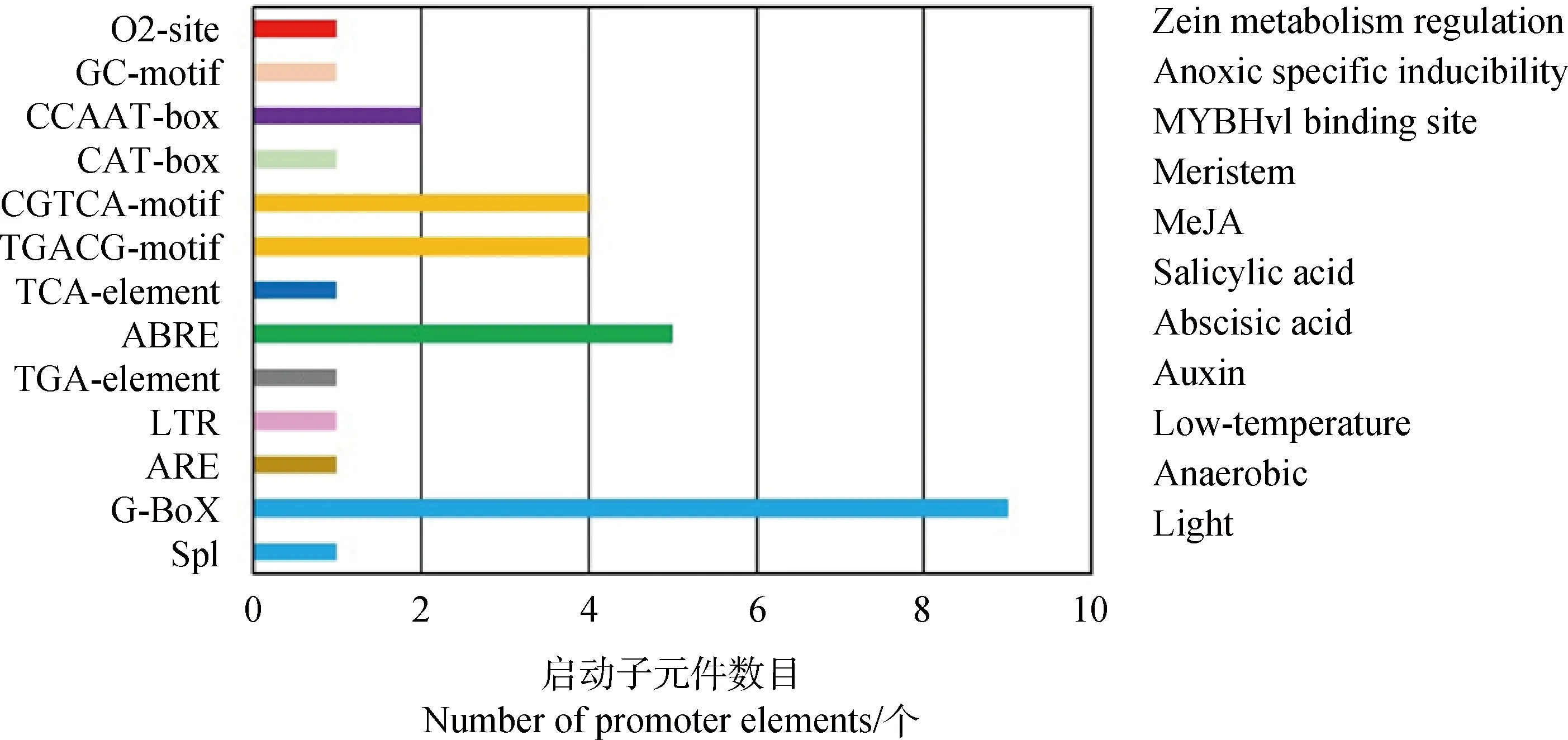
图3 海雀稗PvCIPK9基因启动子元件分析Fig.3 Gene promoter element analysis of PvCIPK9
2.3 PvCIPK9的表达模式分析
2.3.1PvCIPK9的亚细胞定位 将融合载体和mCherry共转化水稻原生质体,以GFP和mCherry共转为对照,通过激光扫描共聚焦显微镜观察荧光信号出现部位。结果显示,PvCIPK9-GFP荧光信号与mCherry荧光信号明显重叠在细胞核(图4),表明PvCIPK9主要存在于细胞核中。
2.3.2PvCIPK9的组织特异性表达分析 利用RT-qPCR检测海雀稗不同器官组织中的PvCIPK9基因表达量,结果表明,正常生长条件下,PvCIPK9基因在根、茎、叶、穗中均有不同程度的表达,在叶中的表达量最高且显著高于其他组织(图5)。
2.3.3海雀稗PvCIPK9盐胁迫响应分析 以野生型海雀稗作为材料,通过qRT-PCR分析200 mmol·L-1NaCl盐胁迫不同时间对叶片和根系中PvCIPK9基因表达的影响。结果显示,与正常生长条件下的海雀稗相比较,盐处理后,海雀稗叶片中的PvCIPK9基因表达量呈上升趋势,在根中,PvCIPK9的基因表达量在2,6,24 h时显著上升(P<0.05),在12 h时无显著差异(图6)。
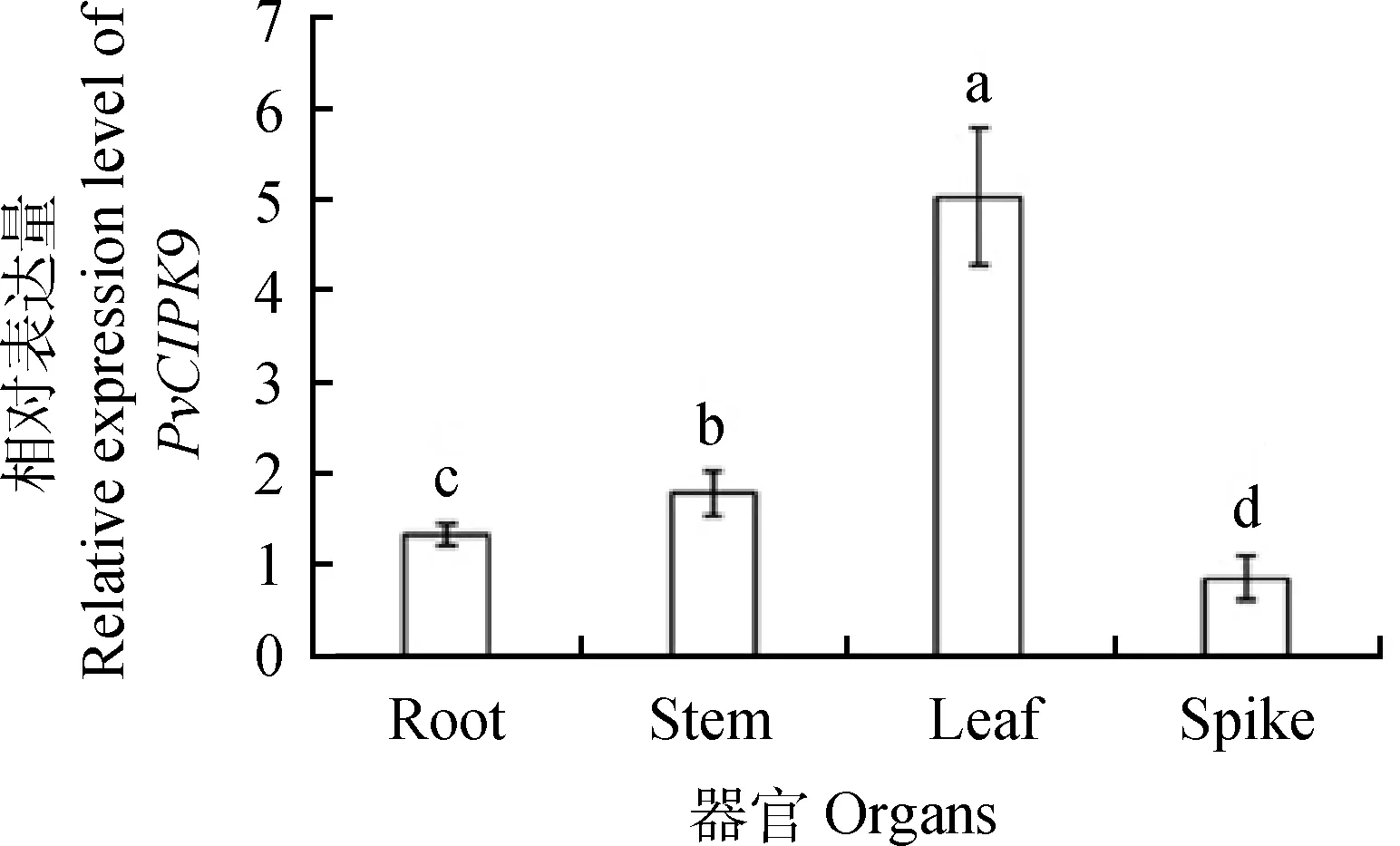
图5 PvCIPK9的组织特异性表达分析Fig.5 Analysis of tissue specific expression of PvCIPK9

图6 海雀稗PvCIPK9盐响应胁迫分析Fig.6 Analysis of salt response of Paspalums vaginatium PvCIPK9注:海雀稗叶片(a)和根(b)中PvCIPK9的基因表达分析。不同小写字母表示处理组与对照组差异显著(P<0.05)Note:Analysis of gene expression of PvCIPK9 in leaves (a) and roots (b) of Paspalums vaginatium. Different minuscule indicate significant difference between treatment group and control group (P<0.05)
2.4 过表达PvCIPK9遗传材料的表型鉴定
2.4.1过表达PvCIPK9拟南芥植株的获得 用花序侵染法转化野生型拟南芥,在含有Basta的培养基上筛选得到两个株系。以转基因拟南芥DNA为模板,采用引物Bar-F和Bar-R进行PCR检测鉴定,检测结果符合Bar基因的片段大小(图7a)。进一步采用引物扩增载体上启动子部分片段和目的片段全长,扩增长度1 756 bp,电泳结果符合预期(图7b)。通过实时荧光定量PCR鉴定转入基因的表达情况,结果显示,过表达株系的目的基因表达量均显著高于野生型拟南芥(图7c)。为方便我们把PvCIPK9-1和PvCIPK9-8转基因株系分别命名为OE1和OE8。
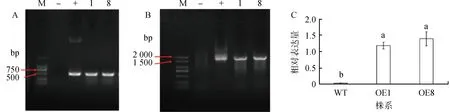
图7 转基因拟南芥的检测鉴定Fig.7 Detection and Identification of Transgenic Arabidopsis注:(a)PCR检测Bar基因(b)PCR检测PvCIPK9基因(c)定量PCR检测PvCIPK9基因表达量。M,DL2000 Marker;—,野生型;+,pCAMBIA3301-PvCIPK9质粒;1,8,过表达转基因拟南芥株系Note:(a) PCR for Bar gene (b) PCR for PvCIPK9 gene (c) PvCIPK9 gene expression by qPCR.M,DL2000 Marker;—,Wild type;+,pCAMBIA3301-PvCIPK9 vector;1,8,Overexpression of transgenic Arabidopsis lines
2.4.2盐胁迫对转基因拟南芥种子萌发率的影响 连续统计5天的种子萌发率(图8a),不含NaCl的1/2 MS培养基上,转基因和野生型拟南芥均在第2天开始萌发,第4天时转基因株系和野生型株系的萌发率分别为87%,94%和82%,且无显著性差异(图8a)。在含100 mmol·L-1NaCl的1/2 MS培养基上,所有株系在第3天开始萌发,第 4天时,野生型株系的萌发率仅有8%~10%,而过表达株系的萌发率分别为40%~64%,60%~73%,显著高于野生型(图8b)。说明盐处理对过表达PvCIPK9拟南芥种子萌发的抑制作用显著小于野生型。
2.4.3盐胁迫对转基因拟南芥相对生长量的影响 正常条件下,过表达PvCIPK9转基因株系的整株、地上部和根的鲜重略低于野生型,但差异不显著。在含盐培养基上,转基因株系的整株、地上部和根的鲜重显著高于野生型(图9a,9b,9c)。进一步计算相对生长量,发现过表达株系的整株,地上部及根的相对生长量均显著高于野生型。以上结果说明过表达PvCIPK9提高了转基因拟南芥的耐盐性。

图9 盐胁迫处理对野生型与过表达PvCIPK9拟南芥的生长影响Fig.9 Effect of salt stress treatment on the growth of PvCIPK9 transgenic Arabidopsis and WT注:盐处理后整株(A)、地上部(B)和根(C)的鲜重;(D)将7天龄的幼苗分别在含0,100,150 mmol·L-1 NaCl的1/2 MS培养基上生长18 d后的生长状况Note:After salt treatment,fresh weight of whole plant (A),shoot (B) and root (C);(D) The growth status of 7-day-old seedlings after growing on 1/2 MS medium containing 0,100 and 150 mmol·L-1 NaCl for 18 days
2.4.4盐胁迫对转基因拟南芥抗氧化酶活性的影响 正常条件下,转基因株系和野生型株系的SOD酶活性没有显著性差异。盐处理后,与WT相比,过表达PvCIPK9株系的SOD酶活性显著提高(图10a);在正常条件下,过表达株系的CAT活性与野生型无显著差异,盐处理后,过表达株系的CAT活性显著高于野生型(图10b);无论是在正常生长条件还是盐胁迫条件下,所有株系间的APX活性均无显著性差异(图10c)。上述结果说明过表达PvCIPK9提高了盐胁迫下转基因拟南芥SOD和CAT的活性,对APX的活性无影响。
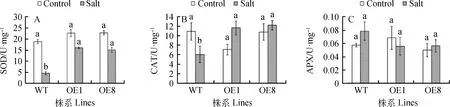
图10 盐胁迫对转基因拟南芥抗氧化酶活性的影响Fig.10 Effect of the antioxidant enzyme activity of transgenic Arabidopsis under salt stress注:盐处理14天后,测定拟南芥的SOD(A)、CAT(B)和APX(C)的活性Note:After 14 days of salt treatment,the activities of SOD (A),CAT (B) and APX (C) were measured in Arabidopsis
2.4.5盐胁迫下转基因拟南芥的表型观察 通过土壤栽培,观察自然环境下转基因材料对盐胁迫的耐受性,由图11所示,盐胁迫条件下,野生型植株叶片稀疏,叶面细小,受到明显的伤害,而转基因株系的叶片较大且数量多,长势更好,盐处理对过表达PvCIPK9拟南芥植株的伤害较小,表明过表达PvCIPK9基因能够提高拟南芥的耐盐性。
3 讨论
海雀稗作为具有极强耐盐性的盐生植物之一,在盐碱地改良与修复上有着巨大的应用潜力[21]。但是关于海雀稗耐逆性,特别是耐盐性的机制研究报道甚少。作为植物特有的蛋白激酶,CIPKs(CBL相互作用蛋白激酶)家族在解码和转导胁迫产生的Ca2+信号中发挥着重要作用[26]。本文从盐生植物海雀稗中克隆得到一个CIPKs家族的新成员—PvCIPK9。该基因与水稻和拟南芥中的OsCIPK9和AtCIPK9同源关系较近。进一步分析发现PvCIPK9在海雀稗根、茎、叶和小穗中均有表达,广泛的空间分布表明PvCIPK9可能参与了多种生理响应过程,其中叶中表达量最高,这与AtCIPK9主要在根中表达不同[27],这可能与海雀稗作为盐生植物独有的盐腺有关[28]。分析PvCIPK9在盐胁迫下的表达水平,结果表明根系和叶片中PvCIPK9的转录水平均随着盐胁迫的诱导而上调,与拟南芥AtCIPK9和水稻OsCIPK9受盐胁迫诱导上调的结果一致[27,29]。
不同基因的启动子区含有不同功能的顺式作用元件,植物响应环境胁迫与这些顺式作用元件有关[30]。进一步分析PvCIPK9上游1 500 bp左右的启动子元件,发现海雀稗PvCIPK9的启动子区含有多种顺式作用元件,包括多种光反应响应元件、激素响应元件、逆境胁迫响应元件等,但并未发现仅对盐胁迫有响应的顺式作用元件,如GT-1。同一顺式作用元件也不只对同一种环境胁迫做出响应,如ABRE不仅对ABA有响应,还响应干旱和盐,DRE不只响应干旱,也对ABA、低温、高盐有响应[31]。本文中海雀稗PvCIPK9虽不含特定的盐响应元件,但可能会通过其他顺式作用元件对盐胁迫作出响应。
一般认为CIPK的亚细胞定位取决于CBL-CIPK复合体中CBL的亚细胞定位[32]。同一个CIPK与不同的CBL相互作用,有着不同的亚细胞定位,从而发挥不同的功能[33]。当CIPK单独存在时,一般在细胞核、细胞质和质膜上广泛分布,CIPK在细胞内的广泛分布有利于其与不同的CBL结合发挥不同的功能,与大多数CIPK不同的是,PvCIPK9的亚细胞定位仅定位于细胞核中,推测PvCIPK9可能会与同样定位于核中的某一个或几个CBLs特异性结合发挥特定的功能。
为进一步探究PvCIPK9的耐盐性功能,将PvCIPK9过表达转化拟南芥,对获得转基因拟南芥植株进行盐胁迫下的耐受性分析。结果表明,盐胁迫下,与野生型WT相比,过表达PvCIPK9转基因拟南芥株系叶片更大,且数量较多,受到的伤害更小。进一步测定种子萌发率和相对生长量也发现转基因株系有着更高的萌发率和相对生长量,表明过表达PvCIPK9能够提高转基因拟南芥对盐胁迫的耐受性,有研究表明白刺(Nitrariatangutorum)NtCIPK9与植物耐盐性有关,过表达NtCIPK9拟南芥株系在盐胁迫下表现出更高的种子萌发率以及更长的根长[34]。此外,拟南芥AtCIPK9参与K+稳态,且AtCIPK9与VDAC3互作调节拟南芥的氧化应激反应[35],还有报道油菜(Brassicanapus)BnCIPK9在介导葡萄糖转化和ABA信号转导之间的相互作用以调节油菜籽中的油代谢中发挥着重要作用[36],这些与PvCIPK9同源关系较近的基因报道的各种基因功能,为研究PvCIPK9除盐胁迫耐受性以外的功能提供了借鉴,说明PvCIPK9具有潜在的功能多样性,为后续探索PvCIPK9的其他功能提供了理论基础。
逆境胁迫下,植物自身可以通过一系列复杂的抗氧化防御体系来减轻和修复因逆境产生的活性氧造成的伤害[37]。在本研究中对过表达PvCIPK9拟南芥进行盐胁迫处理,发现过表达PvCIPK9拟南芥的SOD,CAT酶活性显著高于野生型,这说明在盐胁迫条件下转基因拟南芥具有更强的活性氧清除能力,可以减轻盐胁迫对拟南芥的伤害。有研究表明番茄中过表达SOD基因能显著提高转基因番茄的耐盐性[38],在盐胁迫条件下,与盐敏感的黄瓜(Cucumissativus)植株相比,耐盐黄瓜的抗氧化酶活性显著提高[39],说明植株的高耐盐性与较强的抗氧化酶活性的有关。综上,可推测提高抗氧化酶活性是PvCIPK9提高植物耐盐性的一种途径。
盐超敏感(Salt overly sensitive,SOS)途径是植物中最先被发现的CBL-CIPK通路,参与植物对盐胁迫的响应,该通路的作用机制主要是通过排出细胞内多余的Na+,从而维持体内的Na+/K+平衡,提高耐盐性[40-41]。AtCIPK9已经被证实是低K+胁迫相关的调节因子[42],后续研究发现,AtCIPK9可靶向下游的VDAC3,AP2C1或HAK5等调节K+稳态[35,43-44],根据进化分析的结果,PvCIPK9与AtCIPK9同源性较高,作为同源基因,PvCIPK9可能具有同样的功能,即通过调节K+稳态来维持Na+/K+平衡,进而提高植物耐盐性,这为进一步探究PvCIPK9具体的分子调控机制提供了方向。
4 结论
本研究通过前期海雀稗盐胁迫条件下转录组测序筛选出对盐胁迫有响应的PvCIPK9基因,对该基因进行了生物信息学和表达模式等分析,发现该基因编码稳定的亲水性蛋白,无信号肽结构,存在一个跨膜结构域;PvCIPK9定位于细胞核中;PvCIPK9在海雀稗的根、茎、叶和穗均有表达,在叶中的基因表达量最高;盐胁迫下PvCIPK9在根和叶中表达均上调。对转基因拟南芥进行盐胁迫处理,测定转基因拟南芥在盐胁迫条件下的种子萌发率、相对生长量、抗氧化酶酶活性等生理指标,结果表明转基因拟南芥的耐盐性明显优于野生型拟南芥,说明过表达PvCIPK9提高了拟南芥的耐盐性,这为揭示海雀稗耐盐机制及挖掘新的耐盐基因资源奠定了基础。
