基于脑电特征的焦虑障碍患者人群机器学习分类研究
2023-10-31冯廷炜李丹阳王步遥刘旭峰
冯廷炜,任 垒,毋 琳,李丹阳,杨 伟,张 鹏,王步遥,王 卉,刘旭峰
(1空军军医大学军事医学心理学系基础心理学教研室,陕西 西安 710032;2新疆师范大学教育科学学院,新疆 乌鲁木齐 830054;3西京学院心理咨询中心,陕西 西安 710123;4北京中医药大学东方学院心理咨询中心,河北 廊坊 061199)
焦虑障碍是最常见的精神疾病[1],其核心特征是病理性焦虑,即脱离现实依据的持续不可控的紧张不安[2]。在我国,焦虑障碍年患病率为24.47‰,终身患病率为41.12‰[3]。世界卫生组织在28个国家和地区进行的流行病学调查显示,世界范围内焦虑障碍的终身患病率为13.6%~28.8%,年患病率为5.6%~19.3%[4]。且焦虑症高比例的损伤和残疾有关[5]。即使接受系统性的药物治疗,焦虑障碍患者仍然具有较高的复发率,给社会带来沉重负担[6]。
脑电(electroencephalogram,EEG)技术是从认知神经科学角度研究焦虑障碍的有效工具,在诸多EEG相关研究中,不同频段与焦虑障碍具有一定程度的相关性[7]。不同研究结果差异较大,但均提示存在与焦虑障碍具有相关性的特征性频段。在delta频段,一系列研究证实delta和beta频段之间的跨频段相关与焦虑障碍有关[8]。在theta频段,XING等[9]研究表明,焦虑患者组在静息态任务中头皮中央线theta频段的振荡相干性增强。IMPERATORI等[10]研究表明,高特质焦虑者表现出theta和beta连通性降低。HRUBY等[11]研究表明,在年轻女性中,alpha频段的额叶不对称与焦虑风险显著相关。特质焦虑人群也与alpha频段具有一定相关性[12]。KNYAZEV等[13]研究表明,在静息态EEG研究中,特质焦虑人群在alpha波范围内具有更高的功率,同时在alpha频段具有明显的波峰。WARD等[14]研究表明,特质焦虑人群相较于正常对照,由静息态转为 Eriksen 侧翼任务时出现了alpha波段的去同步化,差异具有统计学意义。在beta频段,JANG等[15]研究指出,beta频段的增强与焦虑症状有一定相关性。OATHES等[16]研究表明,在gamma频段范围内,焦虑障碍患者组与对照组之间在顶叶及左颞叶处差异显著。综上所述,焦虑障碍相关的EEG研究间存在一定差异性,现有研究对于频段选择与指标提取的指导价值有限。当下EEG频段研究缺乏标准化,研究结果的可重复性及稳定性是需要被关注的问题[17]。
军人心理选拔是军事心理学研究的核心问题。我军目前使用的征兵心理检测系统在兵员精神疾病识别上取得了很好效果,但近年来,入伍新兵中无精神病却有异常心理症状的比例大幅增加。为了应对这一新状况,本研究在被试作答问卷的同时,旨在只通过一次问卷施测,同时得到针对同一被试的主观问卷行为学指标及客观问卷作答态、睁眼闭眼时的EEG指标,利用机器学习技术提高人群分类研究鉴别能力,探索焦虑障碍高危人群在进行自陈式问卷作答时的EEG特征,以期为心理筛查与心理评估提供客观证据。
1 对象与方法
1.1 对象
招募解放军总医院医学心理科、联勤保障部队第九二三医院焦虑障碍患者人群参与研究,同时向社会、学校招募健康正常人作为正常对照组。共采集到54份EEG数据,其中焦虑障碍组24人,正常组30人。本研究通过空军军医大学西京医院临床试验伦理委员会审核(许可证号:KY20182047-F-1)。
1.2 实验材料
入组初筛:①精神病前驱期问卷(Prodromal Questionnaire-16,PQ-16)得分在正常范围内,无精神病性症状;②长谷川智能量表报告智力正常;③色觉初步筛查报告无色觉、色弱等病理现象;④中国人利手量表报告为右利手;⑤状态特质焦虑预测量表(State-Trait Anxiety Inventory,STAI)对两组人群进行焦虑预评分。在上述五项基础上,焦虑障碍组加做焦虑自评量表(Self-Rating Anxiety Scale,SAS)和抑郁自评量表(Self-Rating Depression Scale,SDS),并辅助临床医生进行评估。在上述七项基础上,正常组加做症状自评量表(Symptom Checklist 90,SCL-90)排除基本心理病理状况。
STAI有40个条目,反映人格焦虑倾向。本研究使用划界分数的制定基于STAI的美国正常成人常模结果,分别为特质焦虑维度男性>53分、女性>55分。STAI可同时测定情景相关焦虑及特质焦虑。
焦虑障碍组纳入标准:①16~65岁;②经两名高年资主治以上级别医生诊断,符合《精神疾病诊断与统计手册》(第五版)焦虑障碍谱系疾病的诊断标准;③右利手。排除标准:①严重躯体疾病或乙醇等物质滥用史;②精神或神经系统疾病史;③试验前3个月内接受过电休克治疗;④头部创伤史;⑤色盲及色弱者;⑥智力障碍者。
正常组纳入标准:①16~65岁;②SAS得分<50分;③SDS得分<50分;④SCL-90总分<160分;⑤PQ-16条目分<7分,痛苦分<8分;⑥右利手;⑦特质焦虑维度男性<53分、女性<55分。
1.3 方法
问卷EEG同步施测:被试签署知情同意书,清洁头皮,坐于实验电脑前,显示器为17英寸LCD屏幕,屏幕距离约为70 cm,刷新率为60 Hz。在采集电脑上运行Neuroscan Scan 4.5系统记录EEG信号。实验人员对被试进行宣教后,被试根据实验提示先进行睁眼闭眼各5 min采集。然后被试用E-Prime 3.0程序作答焦虑状态-特质问卷,第1至40条目顺序出现,每题之间以500 ms加号间隔,要求被试按“1”键进行“是”,“2”键进行“否”作答,每项条目作答时间不限,被试选择后题目立刻消失。
EEG设备采用NeuroScan SynAmps2放大器及采集系统,并应用NeuroScan 32导联的Ag/AgCI电极帽进行EEG信号记录。本研究使用国际标准10-20系统进行电极定位,其中两个电极分别记录水平眼电(horizontal electro oculogram,HEOG)和垂直眼电(vertical electro oculogram,VEOG);VEOG位于左眼上下框1.5 cm,HEOG位于双眼外侧1 cm处安置电极记录;两个参考电极A1和A2位于双侧乳突;根据国际心理生理学会和国际临床神经生理学联合会的指导意见,记录时的参考电极为鼻尖处的Ref电极,以前额中央为接地。重参考后的参考电极为双侧乳突平均;采集电极分别为 FP1、FP2、F3、F4、F7、F8、Fz、FC3、FC4、FT7、FT8、FCz、T3、T4、C7、C8、Cz、CP3、CP4、TP7、TP8、CPz、P3、P4、T5、T6、Pz、O1、O2、Oz、VEOG和HEOG。实验中各电极处的头皮阻抗均在5 kΩ以下,采样率为1 000 Hz。
EEG数据处理为离线处理,使用MATLAB/eeglab 12.0.2.6b进行分析。预处理步骤为:导入数据,电极定位,剔除无用电极,再重参考,双侧乳突平均做参考,后滤波(30 Hz低通滤波,高通滤波1 Hz),消除50 Hz工频干扰,再做分段(-200 ms,800 ms)后做基线校正,剔除坏段和插值坏导,再做独立成分分析:去眼电(VEOG、HEOG)、心电和肌电。最后叠加平均。以 2 s 为一个时间单位,将问卷作答状态下的脑电数据分段;预处理后的EEG原始信号采用傅里叶变换进行频域分析,得到脑电各频带的功率谱(单位:μV2)。预处理后,将变换后的各频率上的EEG功率分为6个波段:delta(1~3 Hz)、theta(>3~7 Hz)、alpha(>7~12 Hz)、beta[>12~30 Hz,其中beta1(>12~20 Hz)、beta2(>20~30 Hz)]、gamma(>30~40 Hz)。
1.4 统计学分析
使用统计学软件SPSS 20.0进行分析,资料类型为计量资料,所有数据均进行正态性检验及方差齐性检验。EEG功率差异分析采用两组独立样本间的单因素方差分析,若通过方差齐性检验,经Sidak校正后在两组间进行两两比较;若未通过方差齐性检验,经DunnettT3校正后在两组间进行两两比较。P<0.05表示差异有统计学意义。
2 结果
2.1 频域分析
2.1.1 问卷作答结果 EEG包含不同生理意义的特定频段,不同频段的特征对于表征不同大脑活动具有十分重要的意义。为了深入了解整体脑区频域快速傅里叶变换(fast fourier tansform,FFT)的变化,我们进一步平均了6个频段,选取了16个电极(FP1、FP2、F3、F4、C3、C4、P3、P4、O1、O2、F7、F8、T3、T4、T5、T6)的FFT值,分别采用独立样本T检验进行统计分析,如图1~2所示。
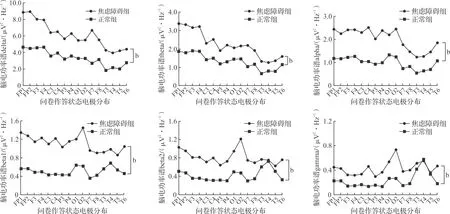
图1 两组人群问卷作答状态下诱发的脑电功率谱在不同频段电极分布图(bP<0.01)
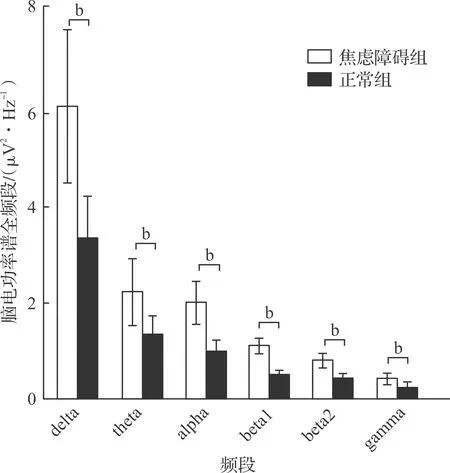
图2 两组人群各频段脑电功率谱柱状图(bP<0.01)
本研究在问卷作答状态下delta频段差异显著(T=6.015,P<0.001),焦虑障碍组高于正常组[(6.16±0.61)μV2/Hzvs(3.36±0.06)μV2/Hz];theta频段差异显著(T=4.47,P<0.001),焦虑障碍组高于正常组[(2.25±0.07)μV2/Hzvs(1.34±0.39)μV2/Hz];alpha频段差异显著(T=7.99,P<0.001),焦虑障碍组高于正常组[(2.02±0.45)μV2/Hzvs(0.98±0.02)μV2/Hz];beta1频段差异显著(T=12.58,P<0.001),焦虑障碍组高于正常组[(1.14±0.01)μV2/Hzvs(0.50±0.01)μV2/Hz];beta2频段差异显著(T=6.015,P<0.001),焦虑障碍组高于正常组[(0.43±0.01)μV2/Hzvs(0.23±0.01)μV2/Hz];gamma频段差异显著(T=7.94,P<0.001),焦虑障碍组高于正常组[(0.81±0.01)μV2/Hzvs(0.42±0.01)μV2/Hz]。
2.1.2 睁眼结果 本研究在睁眼状态下,焦虑障碍组与正常组全频段均有显著性差异(图3)。delta频段(T=6.49,P<0.001);theta频段(T=2.66,P<0.01);alpha频段(T=5.37,P<0.001);beta1频段(T=6.87,P<0.001);beta2频段(T=6.81,P<0.001);gamma频段(T=3.67,P<0.001)。综上所述,睁眼状态全频段下焦虑障碍组EEG功率谱密度(power spectral density,PSD)均高于正常组。

图3 两组人群睁眼状态下诱发的功率谱密度频域在不同频段电极分布图(bP<0.01)
2.1.3 闭眼结果 本研究在闭眼状态下,焦虑障碍组与正常组在beta1、beta2及gamma有显著性差异。beta1频段(T=5.71,P<0.001);beta2频段(T=8.00,P<0.001);gamma频段(T=6.30,P<0.001)。综上所述,三个频段的焦虑障碍组EEG的PSD均高于正常组(图4)。

图4 两组人群闭眼状态下诱发的PSD频域在不同频段电极分布图(bP<0.01)
焦虑障碍组睁眼闭眼状态下发现theta频段差异不显著,其余频段均显著:delta频段(T=4.719,P<0.001);alpha频段(T=-11.98,P<0.001);beta1频段(T=-3.44,P<0.01);beta2频段(T=2.44,P<0.05);gamma频段(T=6.62,P<0.001)。以上频段EEG PSD睁眼状态均高于闭眼状态。正常组睁眼闭眼状态beta2频段差异不显著,其余频段均显著;delta频段(T=-9.63,P<0.001);theta频段(T=-10.73,P<0.001);alpha频段(T=-14.67,P<0.001);beta1频段(T=-2.40,P<0.05);gamma频段(T=6.42,P<0.001)。以上频段EEG的PSD睁眼状态均高于闭眼状态。
对比两组人群睁眼闭眼结果表明,在6个频段16个EEG通道的波幅随着频率的增加而减小。然后比较两种条件的PSD值,我们得到了以下有趣的结果:问卷作答下随着频率的增加,PSD幅值不断降低。在delta、theta和alpha低频频段两组人群PSD差异显著,均为焦虑障碍组高于正常组。且两组人群对比发现,只有问卷作答状态下焦虑障碍组与正常组会出现明显的alpha频段的睁眼抑制,闭眼PSD会高于睁眼。
本研究在睁眼状态下两组人群全频段PSD差异显著,焦虑障碍组高于正常组;在闭眼状态下,仅beta1、beta2及gamma频段PSD具有显著差异性,焦虑障碍组高于正常组。说明闭眼状态下低频能够一定程度调节焦虑障碍患者,使得焦虑障碍组与正常组在低频阶段没有差异,为我们在今后的临床应用中提供干预思路。
2.2 机器学习结果
采用Python 2.0 scikit-learn包的SVM与KNN分类器分别对焦虑障碍组、正常组进行二分类,结果显示,基于以上两组54(被试)×16(电极)×3(行为、PSD、多质融合)个指标,SVM分类器对行为学准确率从82%提高到87%。KNN分类器对行为学准确率从76%提高到79.71%。故采用多质融合的方法一定程度上能够提高人群的识别率,说明这两组人群功率谱特征指标具有良好的区分能力,可以作为征兵心理选拔检测的指标。
3 讨论
本研究结果发现焦虑障碍患者睁眼时全频带的功率变异性高于正常人,表明焦虑障碍患者在低频带EEG产生更强的活动性,在高频段EEG产生较低的活动性,这与焦虑障碍以低频频段功率增高和高频频段功率降低的EEG特征相吻合。不同波段的EEG功率反映了特定的认知加工过程,而在变化趋势上,睁眼状态下,两组人群的功率皆随静息态时间的延长而升高,升高趋势相同;而焦虑障碍组在alpha频段的睁眼和闭眼对比中均出现alpha睁眼抑制效应。在闭眼状态下,仅beta1、beta2及gamma频段PSD具有显著差异,且焦虑障碍组高于正常组。
本研究发现焦虑障碍组的额区中线位置delta功率增高,这与文献[17]研究结果一致,该研究发现左前额叶delta波增多与焦虑障碍患者症状相关,这种delta功率增高发生的机制可能是左侧大脑半球语言功能缺乏区在右侧大脑半球同源区域的抑制引起的。本研究也发现焦虑障碍患者睁眼时theta功率增高,这与一些研究结果一致[18],有研究认为这种过量的theta波的溢出有可能是海马区GABA-氨基丁酸能神经元活动改变导致的[19],这些神经元是产生theta波的主要部位。这种由大脑内分子机制改变导致的稳定的EEG活动异常,使得theta波段功率的异常可以成为一个筛查指标提取并应用于焦虑障碍症人群的检测和筛查。研究还发现焦虑障碍患者的alpha功率显著增高,alpha和gamma波段功率分别反映了注意朝向内部和外部的不同过程,而静息态过程中alpha功率的增高与注意力朝向内部自我相关[20]。冥想过程中,顶叶部位的alpha功率反映了自我意识,alpha功率在做自我相关的冥想时更高,Fz和Pz之间的alpha相干性也更高[21]。并且那些以具体的认知和行为来冥想自己的个体表现出较低的alpha和较高的gamma功率,而那些用一种抽象的、独立的、潜在的自我意识冥想自己的个体,表现出较高的alpha和gamma能力。焦虑障碍患者在睁眼状态下alpha功率显著高于正常人,说明在睁眼状态下,焦虑障碍患者的思维意识较正常人而言更朝向于自我内部世界,这或许与患者的先占观念有关,说明内在产生的思维导致的内向体验使患者的现实定向和适应能力受损。
正常对照组和焦虑障碍组在静息态睁眼和闭眼的差异模式又有所不同。闭眼后,焦虑障碍组与正常对照组的功率差异波段变少,只体现在delta波段上。有学者认为,静息态EEG活动增强与视觉皮质兴奋性降低有关,此时外部定向注意力相关的大脑区域活动减少,视觉皮质兴奋性降低有助于阻止视觉输入外部干扰而打扰个体内省状态[22]。正常人在闭眼后,因为视觉信息的内部流入切断,而导致低波段EEG功率增加,theta和alpha波段这两个中低波段功率与焦虑障碍组无差异,而delta波段功率始终有差异,提示了delta功率发生机制与视觉皮层活动无关,可能来源于其他脑区的异常活动。
本研究结果表明,不论是低频功率的增高还是高频功率的降低,健康正常被试显示出较快的适应性特征,但本研究样本量较小,焦虑障碍人群在入组进行实验时,由于多种担忧造成心理压力大、认知负荷较重,使得EEG信号受到其他心理因素的影响。最后,本研究能够在征兵心理检测前加入30 s的睁眼闭眼静息态EEG检测,若将指标投入应用,还需扩大被试量结合机器学习其他分类器的方法进行辅助诊断。
