盐胁迫下夹竹桃生理光合特性及生态修复应用
2023-10-30丁伟伦陈慧英汤坤贤孙元敏蔡鹭春马勇张飞
丁伟伦陈慧英汤坤贤孙元敏蔡鹭春马勇张飞
(1.自然资源部第三海洋研究所 厦门 361005;2.自然资源部海洋生态保护与修复重点实验室 厦门 361005;3.自然资源部海峡西岸海岛海岸带生态系统野外观测研究站 厦门 361005;4.福建省海洋生态保护与修复重点实验室 厦门 361005)
0 引言
滨海植物是海岸生态系统的重要组成。一方面,土壤盐碱化对植物造成根系盐胁迫[1];另一方面,浪花飞溅、盐雾等又造成植物地上部和叶片的盐胁迫[2]。生长状态抑制是植物对盐胁迫的直观表现[3],如株高、叶片数、茎长以及地上部分的干重等均有所下降等[4-5]。采用赋值法能有效量化评价植株生长状态[2]。盐分产生的渗透胁迫使土壤水势降低,导致植物根系吸水能力下降,引发生理干旱[6]。持续存在的渗透胁迫导致植物体内离子失衡,表现为离子毒害和营养元素亏缺,进而造成氧化胁迫导致细胞膜透性改变、机体代谢紊乱和有毒物质积累,最终影响植物的生长发育和表观形态[7-9]。对此,植物会产生一系列生理响应来应对盐胁迫。如产生脯氨酸、甜菜碱等一些渗透调节物质,以及通过抗氧化物酶的表达来清除活性氧,减少膜损伤,维持细胞正常的功能[10-12]。作为植物重要的生理过程,光合作用对环境变化非常敏感[13-14]。研究表明,盐胁迫会造成植物光合作用和呼吸作用的抑制,进而影响植株正常的生长发育[15-17];在影响因素上,主要分为气孔因素和非气孔因素[18]。
作为一种龙胆目(Gentianales)夹竹桃科(Apocynaceae)的常绿灌木或小乔木,夹竹桃(Nerium indicum)在我国热带亚热带地区被广泛栽植,兼具园林绿化、环境修复、观赏和经济价值等特点[19]。目前,国内外对夹竹桃的耐盐研究主要集中在根系盐胁迫,尚未见夹竹桃对叶片盐胁迫耐受特性的文献报道[16-17,20]。本课题组在野外实地考察时发现,不同植物根系、叶片的耐盐能力存在差异。故本研究以夹竹桃为研究对象,分别开展夹竹桃根系和叶片盐胁迫实验,通过测定植物生长状态、净光合速率(Pn)、蒸腾速率(Tr)、水分利用率(WUE)、气孔导度(Gs)、叶片饱和水分亏缺(WSD)和细胞膜透性等指标,探究夹竹桃根系、叶片对不同盐胁迫的生理响应和耐受能力。以期能更好地评估其耐盐特性,为植物耐盐特性研究和夹竹桃在海岸生态修复应用提供参考。
1 材料与方法
1.1 实验材料与地点
实验苗木采用长势良好,高约1.2 m 的2年生夹竹桃苗,种于直径30 cm、高35 cm 的塑料花盆,种植基质为按1∶1土沙比混合的土壤。实验地点位于自然资源部第三海洋研究所漳州古雷基地可通风大棚内。棚内温度略高于外部,光强约为外部自然光照环境的2/3,湿度与环境差异不大,实验时间为较干燥的12月至翌年3月。
1.2 实验方法
1.2.1 根系盐胁迫实验
设置对照组(0%)和0.3%、0.6%、1%、2%、3%浓度的根系盐胁迫组,每组10株重复。实验用水采用粗盐和地下水配置,用盐度计(WTW Multi 3320)测量,调节至相应盐浓度。各处理组在根系盐胁迫阶段每7 d浇一次对应浓度的盐水,每次浇水量1 L。胁迫处理13周后,按相同间隔和浇水量正常浇水4周。
1.2.2 叶片盐胁迫实验
盐度梯度及实验用水配制同1.2.1,每组5株重复。叶片盐胁迫阶段,每7 d用喷壶对各处理组植株叶片喷洒对应浓度的盐水,每次喷洒量0.5 L。喷至叶片表面湿润并均匀挂有水珠;胁迫处理13 周后,按照1.2.1方式正常浇水4周。
上述两个实验均在每次浇水前查看叶片受损程度,并剪取各处理植株相同叶位的叶片,冰袋冷冻保鲜放入采样箱内并带回实验室进行生理指标的测定。实验前、盐胁迫周期及正常浇水周期全程记录植株生长状态。
1.2.3 叶片光合参数测定
在根系盐胁迫末期及正常浇水后测定叶片光合指标,测定时选取晴天下同一时段,分别挑选两个实验各组植株相同叶位的叶片,每组选3个,设定光强500μmol/(m2·s-1),用Li-6400XT便携式光合系统测定仪(Li-Cor 6400,Li-Cor Inc.,Lincoln,NE,USA)测定叶片净光合速率(Pn)、蒸腾速率(Tr)、水分利用率(WUE)、气孔导度(Gs),每片叶3个重复。
1.2.4 叶片生理指标测定
将新鲜叶片用去离子水冲洗干净后擦干,避开主脉用打孔器打取相同面积的圆叶片放入刻度试管,加入20 ml去离子水,真空干燥箱中用真空泵抽气20 min后,摇匀静置1 h,在室温下测定初始电导率S1;然后将各试管加塞煮沸30 min,冷却至室温后测定电导率S2,按如下公式算得细胞膜相对透性(RMP)[21]:
叶片水分饱和亏缺(WSD)用饱和称重法测定[22]。新鲜叶片取回后立刻测得鲜重(W f),纯水浸泡一天后取出,吸干表面水分称其饱和鲜重(Wt),然后放入烘箱105℃杀青15 min,再调至80℃烘干至恒重,测得干重(W d)。按如下公式算得WSD:
1.3 数据收集与分析
采用SPSS25.0 对测指标进行单因素方差(ANOVA)分析和Pearson相关性分析。将数据汇总入Excel后,用Origin 8.0制作图表。
2 结果与分析
2.1 盐胁迫对夹竹桃生长状态的影响
生长状态采用赋值法[2]进行量化作图。图1(a)表明夹竹桃生长状态在根系盐胁迫下均不同程度降低,其中,1.0%以上浓度的处理组生长状态下降尤为显著,根系盐胁迫35 d后组间差异达到极显著(P<0.01)。正常浇水后,1.0%浓度及以下处理组植株生长状态逐渐恢复至接近对照水平,成活率均为100%;2.0%及以上浓度处理组生长状态回升较缓或难以恢复,特别是3.0%处理组有约40%植株枯死,组间差异为极显著水平(P<0.01)。根据生长状态赋值表,生长状态值长期大于2能够耐受,小于2为不能耐受。说明夹竹桃对1.0%浓度及以下的根系盐胁迫耐受较好,对2.0%及以上根系盐胁迫耐受较差(图1)。
相比于根系盐胁迫,叶片盐胁迫下夹竹桃生长状态下降幅度整体较小(图1)。其中1.0%及其以上浓度处理组在29 d以后生长状态与对照比差异达到极显著(P<0.01),0.6%处理组在50 d以后生长状态与对照比差异极显著(P<0.01);各处理组正常浇水后生长状态具有不同程度回升,但0.6%、2.0%和3.0%处理组与对照比仍差异极显著(P<0.01)。总体上,各处理生长状态值无论在胁迫期间还是正常浇水后均大于2,表明了整体上夹竹桃对各处理叶片盐胁迫的较为耐受。
2.2 盐胁迫对夹竹桃净光合速率的影响
根系盐胁迫对夹竹桃的净光合速率(Pn)整体影响较大,见图2(a),各处理组叶片Pn在根系盐胁迫期间和正常浇水后组间差异均极显著(P<0.01)。其中,根系盐胁迫下除2.0%浓度处理组外,其余组夹竹桃叶片Pn均为负值。这可能是由于光合测定位于胁迫阶段末期,植株生长状态下降明显,各处理组叶片出现不同程度变黄、萎蔫,呼吸作用强于光合作用所导致。低浓度根系盐胁迫组Pn低于高浓度处理组,可能是因为低浓度组的叶片气孔导度较大,而高浓度组因受根系盐胁迫影响严重,气孔导度相对较低的原因。各处理组夹竹桃叶片Pn在正常浇水后均显著上升,且与根系盐胁迫浓度梯度呈负相关趋势,这可能是高浓度的根系盐胁迫使植株叶片光合系统严重受损所导致。

图2 正常浇水前后夹竹桃叶片净光合速率Fig.2 Net photosynthesis of Nerium indicum before and after normal watering
从图2(b)可以看出,叶片盐胁迫对夹竹桃植株胁迫前后组间的净光合速率(Pn)影响均极显著(P<0.01)。叶片盐胁迫下,各处理夹竹桃叶片Pn均有不同程度下降,3.0%组叶片Pn与对照组相比差异极显著(P<0.01),0.3%组叶片Pn与对照组差异显著(P<0.05),其余组与对照组差异不显著(P>0.05)。停止胁迫正常浇水一段时间后,0.3%组叶片Pn与对照组相比差异显著(P<0.05),其余组均与对照组相比差异极显著(P<0.01)。
2.3 盐胁迫对夹竹桃蒸腾速率的影响
如图3(a)所示,根系盐胁迫期间各处理组叶片蒸腾速率(Tr)与正常浇水后相比组间差异极显著(P<0.01)。根系盐胁迫下,1.0%浓度以上处理组植株Tr与其余组比差异极显著(P<0.01)。实验过程中对照组植株Tr前后变化不大,正常浇水一段时间后,处理组植株Tr与对照组比差异极显著(P<0.01),各组间植株Tr差异不显著(P>0.05)。表明根系盐胁迫对夹竹桃植株的蒸腾速率(Tr)影响较大且较为持久,正常浇水后仍不能恢复至对照水平。

图3 正常浇水前后夹竹桃叶片蒸腾速率Fig.3 Transpiration rate of Nerium indicum before and after normal watering
叶片盐胁迫下,如图3(b)所示,夹竹桃植株蒸腾速率(Tr)各处理组间差异不显著(P>0.05);正常浇水一段时间后的各处理组植株Tr与胁迫期间各组差异极显著(P<0.01),其中3.0%处理组植株Tr极显著低于(P<0.01)其余正常浇水后各组,可能是由正常浇水后各组气孔导度相对叶片盐胁迫期间显著提升导致。叶片盐胁迫对夹竹桃Tr影响不大,可能是叶片具有发达角质层等特殊结构,使其能较好地抵御叶片盐胁迫,但正常浇水后高盐处理组受影响仍显著,可能是持续的盐胁迫造成的损伤。
2.4 盐胁迫对夹竹桃气孔导度的影响
植株会根据环境变化来调节气孔关闭程度,进而影响光合、呼吸与蒸腾作用,提升其对环境适应性。根系盐胁迫下,如图4(a)所示,1.0%及其以下浓度处理组夹竹桃叶片Gs与对照组比差异不显著(P>0.05),2.0%及以上浓度处理组Gs与其余组比差异极显著(P<0.01),正常浇水后Gs组间差异显著(P<0.05)。这表明夹竹桃植株在高浓度根系盐胁迫下,会通过气孔导度降低的方式来影响光合、呼吸和蒸腾速率,以提升其应对外界环境胁迫的能力。

图4 正常浇水前后夹竹桃叶片气孔导度Fig.4 Stomatal conductance of Nerium indicum before and after watering
叶片盐胁迫下,如图4(b)所示,夹竹桃叶片气孔导度(Gs)组间整体差异不显著(P>0.05),其中,3.0%处理组Gs较低,与1.0%和2.0%处理组比差异显著(P<0.05)。正常浇水后,各处理组叶片Gs均有不同程度提高,整体组间差异极显著(P<0.01),其中,3.0%处理组Gs分别与对照组、0.3%和0.6%处理组差异极显著(P<0.01),与2.0%处理组差异显著(P<0.05),其余组间Gs差异不显著(P>0.05)。即除3.0%处理组外,其余组正常浇水后植株叶片Gs能够恢复至和对照组同一水平。
2.5 盐胁迫对夹竹桃水分利用率的影响
如图5所示,夹竹桃植株在叶片盐胁迫下各处理水分利用率(WUE)组间差异极显著(P<0.01)。其中,1.0%及以上的处理组植株的WUE均与0.3%处理组比差异极显著(P<0.01),2.0%处理组植株WUE与0.6%处理组差异显著(P<0.05),3.0%处理组与0.6%处理组差异极显著(P<0.01),其余组之间差异不显著(P>0.05)。各处理组在停止胁迫正常浇水后组间整体差异不显著(P>0.05),其中3.0%与0.3%、0.6%、1.0%处理组WUE 差异显著(P<0.05),其余均组间差异不显著(P>0.05)。

图5 夹竹桃叶片在正常浇水前后的水分利用率Fig.5 The water use efficiency of Nerium indicum before and after normal watering
2.6 盐胁迫对夹竹桃细胞膜透性的影响
根系盐胁迫浓度在1.0%及以下时,夹竹桃植株叶片细胞膜透性(RMP)无明显变化,1.0%以上浓度处理组在胁迫后期细胞膜透性显著升高,正常浇水后分别持续增大到39.22%和100%,可能是土壤中仍残留一定浓度盐分并继续对夹竹桃植株造成胁迫导致,表明3.0%浓度根系盐胁迫下夹竹桃植株细胞膜系统严重损伤而无法恢复,如图6(a)所示。叶片盐胁迫下,各处理组夹竹桃叶片细胞膜透性无显著差异,如图6(b)所示,最高峰出现在胁迫中期的2.0%和3.0%处理组,分别是28.40%和29.16%;正常浇水后夹竹桃叶片细胞膜透性最值出现在3.0%处理组,为24.88%。

图6 不同浓度盐胁迫下夹竹桃叶片细胞膜透性变化Fig.6 Changes of cell membrane permeability of Nerium indicum under different concentrations of root salt stress
2.7 盐胁迫对夹竹桃叶片饱和水分亏缺的影响
当根系盐胁迫浓度≤1.0%时,夹竹桃叶片水分饱和亏缺(WSD)与对照比变化不显著,但根系盐胁迫浓度>1.0%时,叶片WSD 受胁迫影响均非常显著,2.0%处理组植株叶片WSD 在正常浇水后有所恢复,但3%处理组WSD 在正常浇水后仍呈直线上升趋势,如图7(a)所示。夹竹桃植株在叶片盐胁迫下各处理组WSD 整体差异不大,植株叶片WSD在停止胁迫浇水充足后有下降趋势,如图7(b)所示。
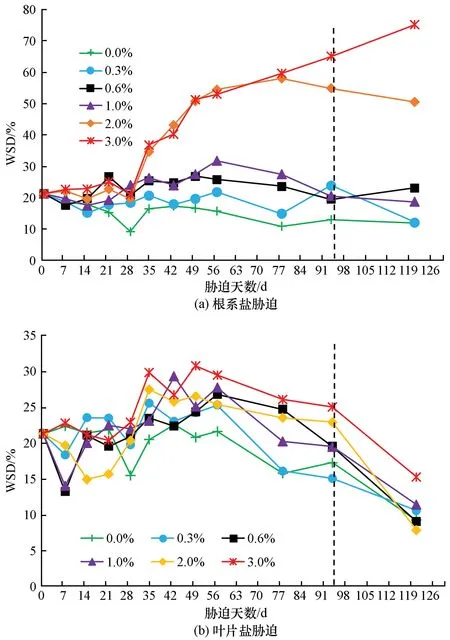
图7 不同浓度盐胁迫下夹竹桃叶片水分饱和亏缺变化Fig.7 Changes of water saturation deficit of Nerium indicum under different concentrations of salt stress
2.8 指标间相关性分析
将夹竹桃生长状态、光合指标和生理指标通过Pearson相关性分析,如表1所示,夹竹桃植株的生长状态与不同盐胁迫均呈极显著负相关关系。

表1 夹竹桃指标间相关性分析Table 1 Correlation coefficient among indexes
光合响应上,根系盐胁迫下,夹竹桃叶片Pn与 盐胁迫浓度极显著正相关,Tr和Gs与盐胁迫浓度均极显著负相关,Pn和Tr均与Gs极显著相关,表明气孔因素作用极显著。叶片盐胁迫下,Pn与盐胁迫浓度呈极显著负相关,Tr和Gs与盐胁迫浓度相关性不显著,但Tr与Gs之间有极显著相关性,植株WUE与盐胁迫程度呈极显著负相关性,其余指标间相关性不显著。
生理响应上,根系盐胁迫下,夹竹桃叶片WSD与细胞膜透性同盐胁迫程度均为显著正相关;WSD与细胞膜透性之间也极显著正相关;叶片盐胁迫下,夹竹桃叶片饱和水分亏缺与细胞膜透性同盐胁迫程度相关性不大。
3 讨论
3.1 夹竹桃对不同盐胁迫的耐受性
耐盐性指植物对盐胁迫能全部或部分忍受,表现为不受伤害或受伤害较轻[16]。盐胁迫对植物直观影响的表现为生长抑制,如植株生长量减少、株高增长率降低等;且盐胁迫浓度越高,生长抑制越明显[23-25]。本研究表明,根系盐胁迫和叶片盐胁迫均会对夹竹桃植株生长和表观形态产生影响;两种盐胁迫在表观上均是从叶尖开始损害植株叶片,表征为不同程度的叶尖焦枯、卷曲、变黄与凋落。这与卞阿娜等[26]对甜土植物枇杷的根系、叶片分别受NaCl胁迫的研究结果一致。根据生长状态赋值,根系盐胁迫浓度≤1.0%时,夹竹桃生长状态普遍大于2,且正常浇水后生长状态能较好恢复;根系盐胁迫浓度≥1.0%时,夹竹桃状态向着小于2的方向发生不可逆下降。叶片盐胁迫下夹竹桃生长状态普遍大于2。因此,从生长状态看,夹竹桃对浓度1.0%及以下根系盐胁迫耐受性较好,对3.0%及以下叶片盐胁迫耐受性均较好。
3.2 不同盐胁迫下夹竹桃的光合响应
盐胁迫会改变植物细胞的渗透压,使过多的盐分离子进入植物蒸腾流中,造成光合作用抑制、离子平衡破坏和膜脂过氧化等,从而损害植物细胞,影响植物生长和净光合速率(Pn)[27-28]。本研究发现,根系盐胁迫下,各处理组夹竹桃Pn 均大幅降低,与对照比差异极显著;叶片盐胁迫下,Pn下降幅度小于根系盐胁迫,仅3.0%浓度处理组与对照组比下降极显著。说明盐胁迫会影响植株叶片Pn;根系盐胁迫比叶片盐胁迫对夹竹桃叶片Pn 影响更大。
Tr与Gs也是反映植株叶片光合效率的重要指标。气孔通过调控植株水分运输和对CO2的吸收来影响植物的蒸腾和光合作用[5]。本研究表明,根系盐胁迫下,夹竹桃2.0%、3.0%处理组Gs与对照组比极显著降低,Tr与Gs变化趋势相同;叶片盐胁迫下,夹竹桃各处理组Tr和Gs与对照组比均无显著变化。Pearson 相关性分析表明,夹竹桃Gs与Tr、植株生长状态呈极显著相关,这与许大全[29]的观点一致。特别是高浓度根系盐胁迫下,气孔因素对夹竹桃光合的影响较为显著。说明不同根系和叶片盐胁迫方式对植株光合作用影响不同,根系盐胁迫对气孔和蒸腾的影响比叶片盐胁迫更为显著;同种胁迫方式下,盐浓度越高,Pn、Gs、Tr抑制越明显[30-32]。Gs下降严重阻碍CO2向叶绿体扩散,导致细胞间CO2浓度和Pn的下降[24];同时减少蒸腾失水,缓解水分亏缺,降低盐胁迫对植物生存的危害[33-34]。这与戴伟等[35]对包括夹竹桃在内的5种园林灌木在根系盐胁迫下光合响应比较研究结果一致。
停止盐胁迫正常浇水后,不同盐胁迫处理组有不同程度恢复。其中,根系盐胁迫处理组的各项光合指标在不同程度恢复的同时,与对照组比差异仍显著,甚至有个别组为极显著;叶片盐胁迫处理组除Pn与对照组差异显著外,其余指标与对照组差异不显著。说明根系盐胁迫比叶片盐胁迫对夹竹桃光合作用抑制后恢复难度更大,影响更持久。
3.3 夹竹桃对不同盐胁迫的生理响应
盐胁迫会对植物细胞膜产生直接影响,使膜结构和功能受到损伤。植物在盐逆境中细胞膜透性增加是组织受损的表现[36],这会对植株的水分利用[37]和光合作用产生影响[38]。本研究表明,根系盐胁迫下,1.0%及以下浓度处理组夹竹桃叶片的细胞膜透性和WSD 与对照组比无明显变化,2.0%和3.0%处理组在胁迫初期变化不大,但在胁迫后期,夹竹桃细胞膜透性和WSD 显著升高;叶片盐胁迫下,各组夹竹桃细胞膜透性和WSD 与对照组比差异不显著。Pearson相关性分析表明细胞膜透性和WSD二者有显著正相关性。停止胁迫正常浇水后,夹竹桃2.0%和3.0%根系盐胁迫处理组WSD 与细胞膜透性的值和对照组相比仍然较高;2.0%和3.0%叶片盐胁迫的处理组WSD 与细胞膜透性均有不同程度下降。总体上,根系盐胁迫对膜的损伤和植株体内水分状况的影响要大于叶片盐胁迫。
可见,根系盐胁迫前期,夹竹桃表现出一定程度耐受性,随着胁迫时间延长,质膜透性显著增强。说明高浓度根系盐胁迫下,夹竹桃细胞膜受损程度比较严重,无法恢复至正常水平,这与耿晓东等[39]对小黄花菜的研究结果一致。同时,不同盐胁迫下夹竹桃细胞膜透性、WSD 和生长状态、光合作用变化趋势可以很好对应,说明膜系统受损会反过来影响夹竹桃生长和光合作用,特别是光合膜系统的受损,会导致CO2同化能力降低[40],光合色素受损[41],以及其他非气孔因素的光合抑制。
3.4 夹竹桃耐盐特性的应用
通过对夹竹桃根系、叶片盐胁迫的分别研究,能更好地评价夹竹桃的耐盐特性。根据生长状态赋值,综合根系、叶片盐胁迫下夹竹桃光合与生理响应的差异,笔者认为夹竹桃对1.0%及以下根系盐胁迫浓度耐受较好,对3.0%及以下叶片盐胁迫普遍耐受;总体上,夹竹桃叶片耐盐能力强于根系耐盐能力。大棚试验模拟盐雾对滨州杨梅幼苗造成的叶片盐胁迫发现,其对植株影响甚微,可能原因是叶表面有厚厚的角质层限制了盐分进入[42]。研究表明,我国境内夹竹桃叶片角质层发达,平均厚度为19.5±4.57μm,具有良好的保护作用[43]。因此,叶片盐胁迫比根系盐胁迫对夹竹桃影响较弱,可能与夹竹桃叶片本身具有发达的角质层,可以很好地抵御盐分从叶片进入有关。
在滨海生态环境中,盐分是植物生长的主要环境胁迫因子[44]。植株受盐胁迫影响的部位和程度因分布高程和离海距离而异,其耐盐性也就不同。生长在高潮位上滩涂或湿地的植株,受海水直接淹没或浪花飞溅影响,根、茎、叶兼具很强耐盐性;生长在地下水受海水入侵的沙滩后滨或离岸有一定距离低洼地的树种,根系有较强耐盐性;生长在一定高程海岸带坡地的植物,叶片有较强的耐盐性[1]。因此,在滨海植被修复和群落构建时,要因地制宜地综合考虑植物根系、叶片耐盐性的差异来选取树种搭配。通过对夹竹桃根系和叶片盐胁迫生理光合特性研究表明,夹竹桃能够耐受较高浓度叶片盐胁迫和低浓度根系盐胁迫,比较适宜种植在有一定高程的海岸地带,如滨海步道、海堤护岸坡顶等。该处植株根系受海水影响甚微,但茎和叶主要受盐雾和海洋飞沫等影响较大。研究表明夹竹桃较强耐旱能力又能很好地适应该地带水分供给不及时的情况[45]。此外,夹竹桃根系错综复杂,较多的细根能与土体形成有效加筋网络,改善土体强度和变形特征同时提高海堤护岸边坡浅层土体的稳定性[46]。综上,本研究为夹竹桃在滨海生态化应用提供了理论指导。
