云南省不同地区滇黄精的分子生物学鉴定
2023-10-30宁晨晨刘强丽丁子航夏婷婷施建莲
宁晨晨,刘强丽,丁子航,夏婷婷,施建莲,韦 瑾
(1.云南新兴职业学院,云南 昆明 650500;2.昆明医科大学海源学院,云南 昆明 650106;3.甘肃畜牧工程职业技术学院,甘肃 武威 733006)
滇黄精(Polygonatum kingianumColl.et Hem sl.)隶属于百合科黄精属,主要分布于云南、四川、贵州等地[1],其干燥根茎是中药黄精的重要来源之一。大量的研究资料表明,滇黄精根茎较为粗大,有效成分含量高,是黄精药材中质量较好的品种之一[2]。根据其形态不同,又有“大黄精”“鸡头黄精”“姜形黄精”等不同习称[3]。云南是滇黄精的主产区,当地居民将黄精入药的历史悠久。《滇南本草》《云南植物志》等中均有黄精药用的记载,因此黄精是一种重要的“云药”品种[4]。
现代化学及药理作用研究表明,黄精中含有多糖、甾体皂苷、三萜皂苷、黄酮类等多种重要成分,有补气养阴、健脾、润肺、益肾之功效,还有降血糖血脂、抗辐射、抗肿瘤、抗衰老以及提高记忆能力的作用,在高血压、高血脂、糖尿病等疾病的治疗中广泛应用[5-8]。此外,黄精富含淀粉、多糖及其他营养成分,保健功能突出,且味甜爽口,是优良的药食同源植物,在保健食品开发领域显示出了较高的价值[9-10]。滇黄精作为药用黄精的主要品种,产量及市场份额大,在当地的经济社会发展中占据重要地位。
滇黄精长期以野生资源供应市场,随着人们对滇黄精需求量的日益增加,野生药材被过度采挖,导致野生黄精类群大量减少,已远不能满足市场需要,常常出现供不应求的局面[11]。董治程[12]调查发现,滇黄精主要分布在贵州、云南师宗和楚雄以及大理地区,野外已很难发现其踪迹。目前,人工栽培的滇黄精渐渐进入市场,在云南大理、红河、普洱、临沧等地种植面积已具备一定规模[13]。然而,人工种植的品种来源不一,加上本种形态变异相当大[2],易与其他种混淆,因此种植品种混乱的情况常有发生,导致药材质量无法精准控制,而传统的鉴别方式有时难以区分,极易误用,严重影响用药效果和用药安全[14]。
DNA 分子鉴定具有分子信息量大,且不受外界因素和生物体发育阶段及器官组织差异的影响,准确性高、客观性强,可快捷、准确地进行植物分类、系统发育和鉴定分析。中药材DNA 条形码已被纳入《中国药典》(2020),为中药材建立了“基因身份证”,可从基因层面解决中草药与混伪品的物种识别问题。Chen 等[15]建议将ITS2 作为药用植物标准DNA 条形码,同时建议将ITS2 作为新的通用条形码用于鉴定更广泛的植物类群。杨培等[16]在黄精属药用植物的DNA 条形码鉴定研究中认为,叶绿体全序列或通过叶绿体全序列筛选合适的DNA 片段可能是该属药用植物分子鉴定的方向。丛悦等[17]采用叶绿体基因(cpDNA)非编码区rpl20-rps12、trnL-trnF和psbAtrnH序列探索3 种黄精的基源分子鉴定方法,认为叶绿体rpl20-rps12 片段序列更适合黄精的基源鉴定。该研究在借鉴前人经验的基础上,采用核糖体RNA(rRNA)基因转录区ITS2序列及cpDNA 非编码区rpl20-rps12、trnL-trnF和psbA-trnH序列对不同来源的滇黄精进行分子鉴定,以初步了解实际流通中黄精药材的基源,探究在滇黄精药材资源利用过程中是否存在品种混淆的问题。
1 材料与方法
1.1 试验材料
该研究从云南省多个地区的黄精种植户手中共收集22 份滇黄精样品,大多为根状茎,少数带有茎和叶片,极个别为植物全株,全株样品进行了一段时间的培养,各样品信息见表1。
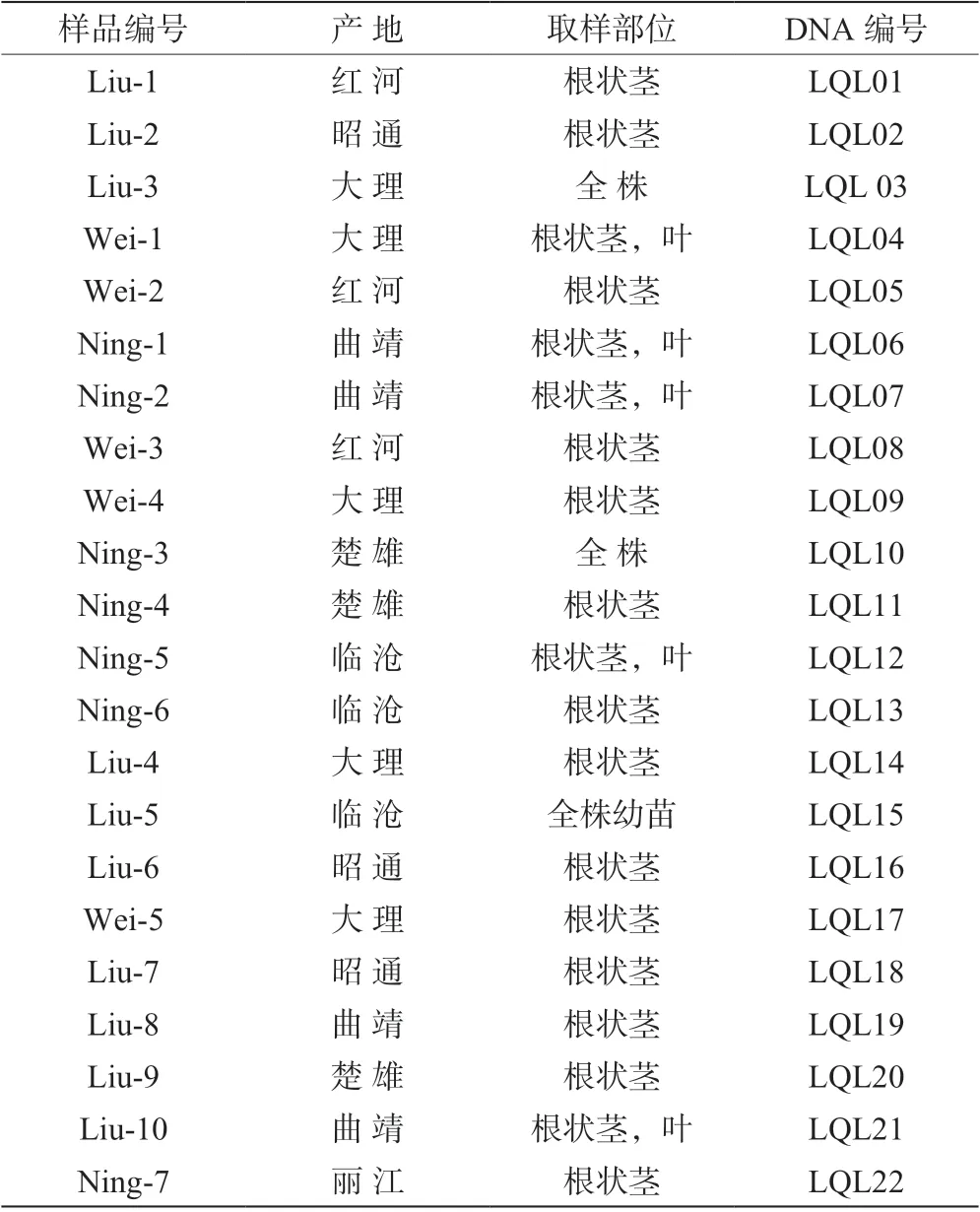
表1 22 份滇黄精样品的基本信息
1.2 试验方法
1.2.1 总DNA 提取 将样品清洗干净并干燥,根状茎样品取30~50 mg,叶类样品取约20 mg,置于DNA 提取研磨机内将样品打碎至粉末。随后利用植物组织基因组DNA 提取试剂盒进行总DNA 提取。用灭菌双蒸水溶解提取的DNA,保存于-20℃冰箱待用。
1.2.2 PCR 扩增及测序 PCR 扩增体系:在无菌PCR 管中分别加入10×扩增缓冲液(含MgCl2)2.5 μL、前后引物各1 μL、原浓度dNTP 1 μL、DNA 模板1 μL、TaqDNA 聚合酶0.2 μL(5 U/μL),再加入灭菌的双蒸水调节体积至25 μL。试验所用的PCR扩增引物见表2,由生工生物工程(上海)股份有限公司合成。反应条件参考他人文献[15,17]进行设置。扩增产物用加有核酸染料的1%琼脂糖凝胶进行电泳,在紫外仪下检测显示单一明亮条带。PCR 产物纯化后送至生工生物工程(上海)有限公司进行测序,测序引物与扩增引物一致,如果1/3 序列为重峰时,需再用正向引物测序。

表2 PCR 扩增引物序列
1.2.3 序列处理与数据分析 将测序色谱峰图用Bioedit 打开,检查测序质量,确保碱基准确性。经Bioedit 检查后的序列在NCBI 上进行Blast 比对,确认其近缘种类,GenBank 中获取的序列信息详见表3。自测序列片段和GenBank 下载的序列全部转换为 FASTA 格式,采用muscle 对序列进行自动比对,用Bioedit 进行人工校对和编辑,采用MEGA7.0.26构建邻接(NJ)系统聚类树。
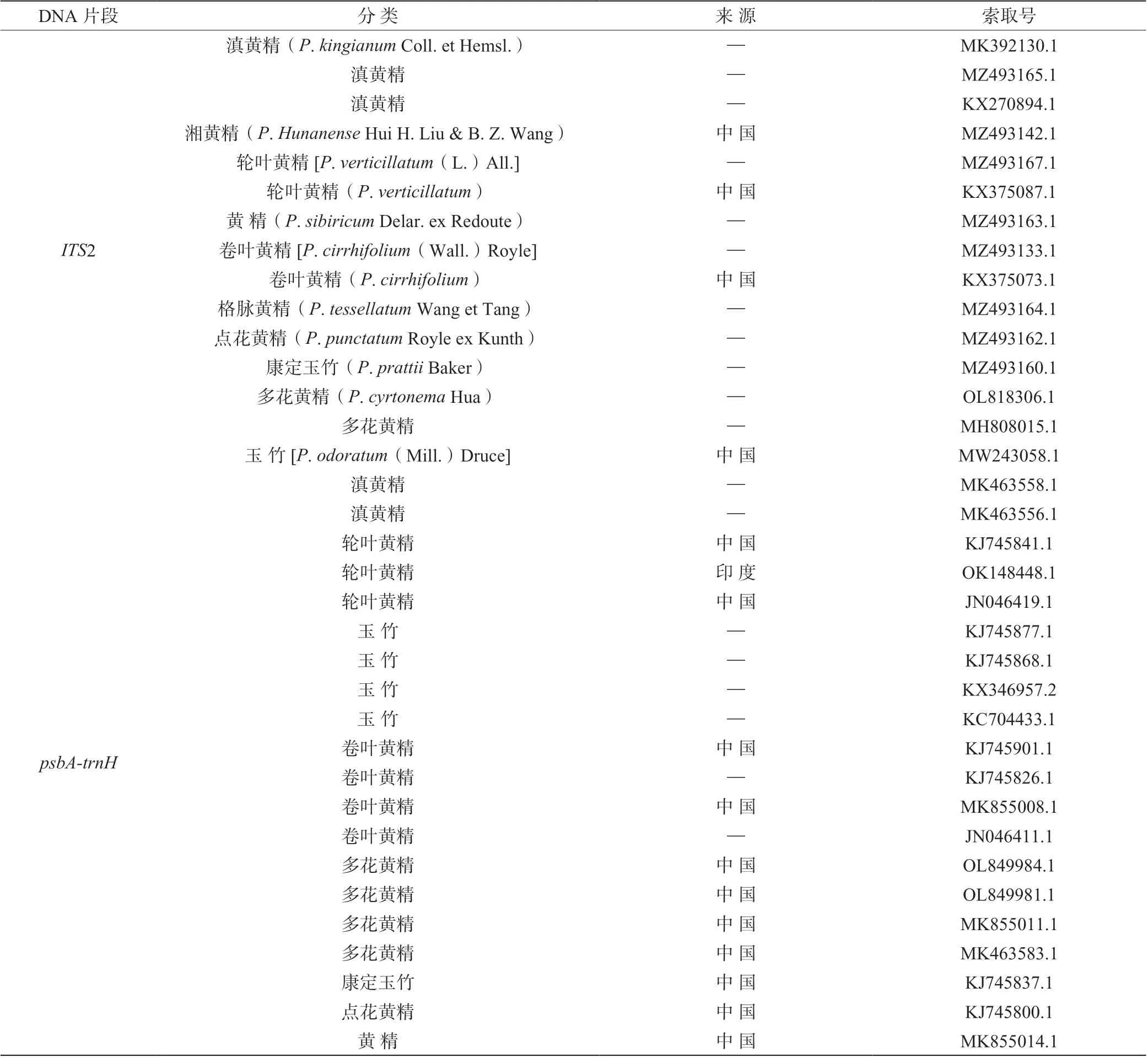
表3 GenBank 中获取的序列及其信息
2 结果与分析
通过DNA 提取及扩增,除去少数样品DNA 片段测序失败或峰形重叠无法使用,共成功获取rpl20-rps12 片段(700~900 bp)序列7 条,trnL-trnF片段(300~400 bp)序列13 条,psbA-trnH片段(400~600 bp)序列21 条,ITS2 片段(300~400 bp)序列22 条,测序结果及序列片段长度见表4。
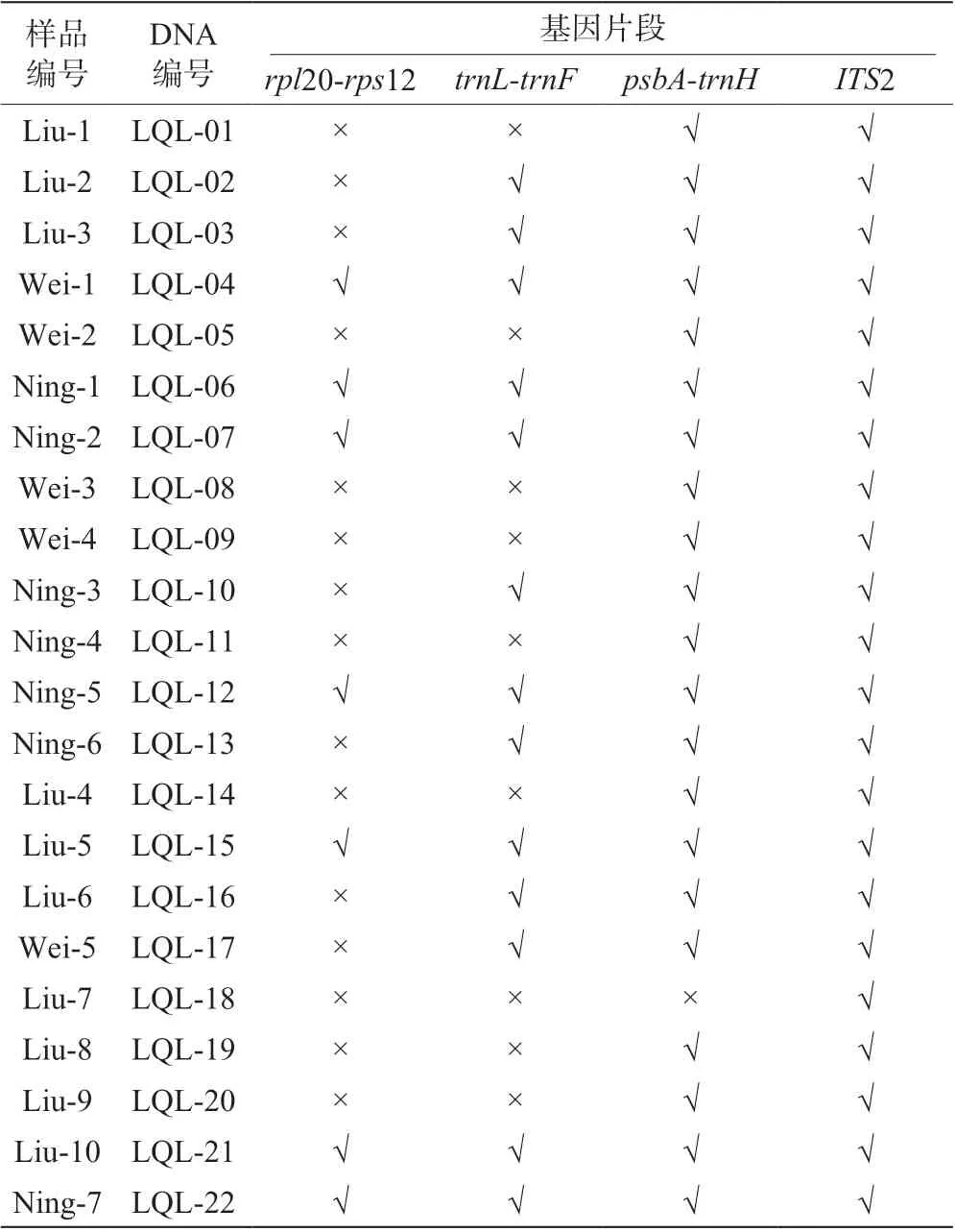
表4 22 份滇黄精样品的测序结果
由于rpl20-rps12 片段、trnL-trnF片段扩增成功率较低,且从GenBank 上能获取的参考序列不足,因此未对上述2 个DNA 片段进行进一步系统发育分析。将各样品的psbA-trnH片段序列、ITS2 片段序列和GenBank 下载的相关序列进行系统发育分析,分别得到psbA-trnH、ITS2 这2 个序列的NJ 树(图1 和图2)。
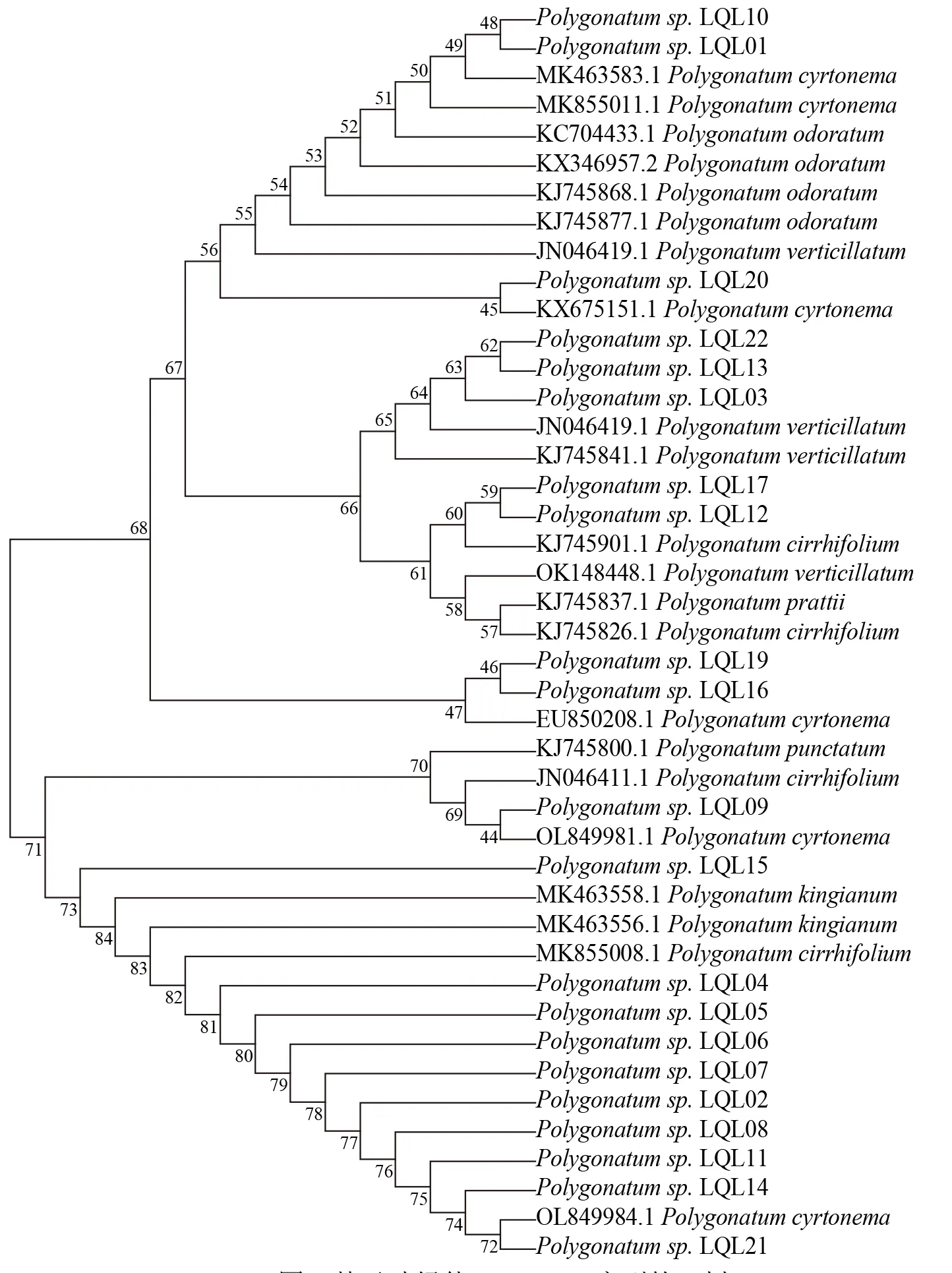
图1 基于叶绿体psbA-trnH 序列的NJ 树
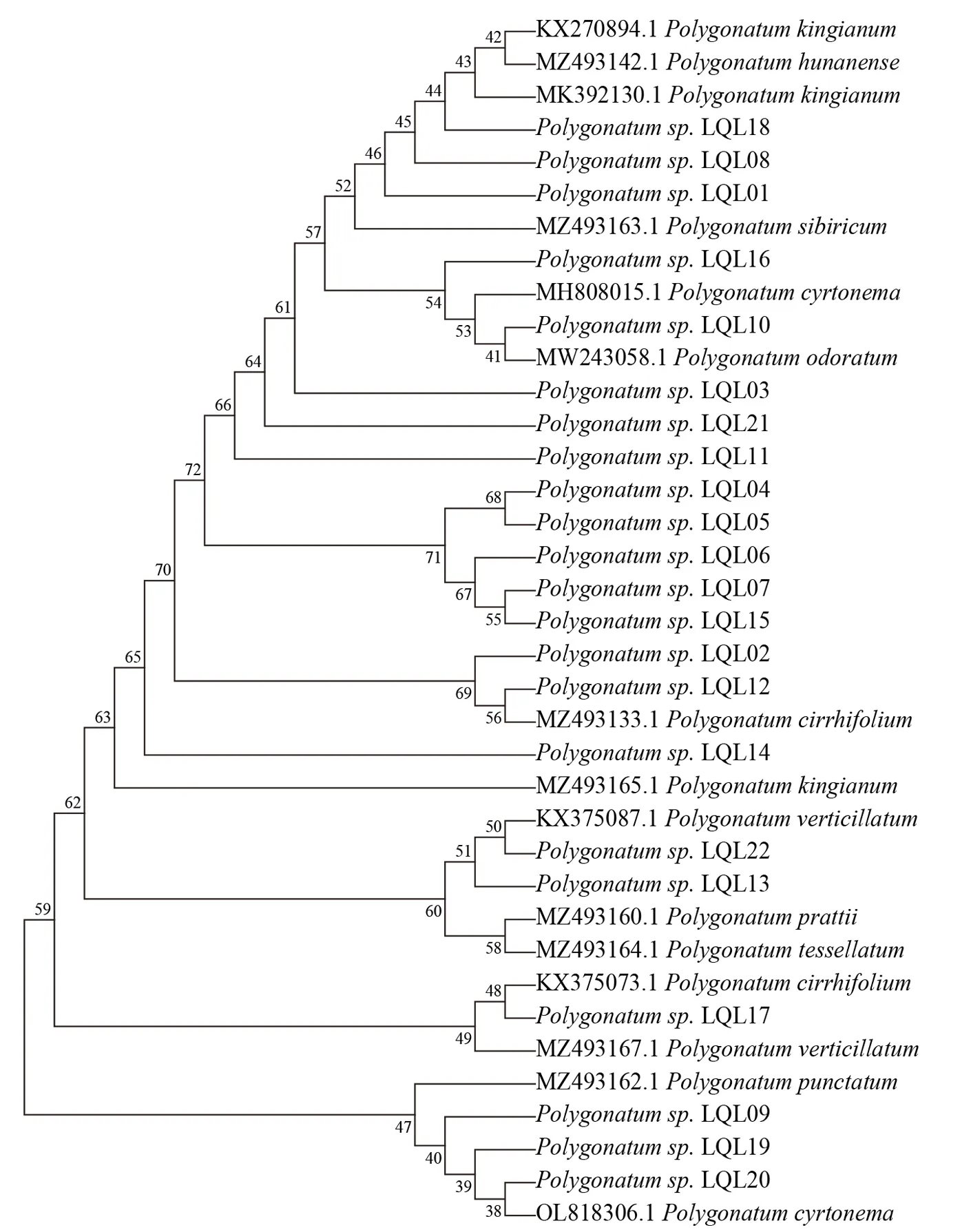
图2 基于ITS2 序列的NJ 树
由图1 和图2 可知,2 个基因片段均可在一定程度上将不同种的黄精属植株区分开来,具有一定的物种鉴别能力,但总体来说,分辨能力并不强,分支支持率不高,尤其是ITS2序列较psbAtrnH序列鉴别能力更弱,不能明显地从ITS2序列的NJ 树上看出同一物种的分布趋势。而psbA-trnH序列基本能将大多数物种区分开来,除多花黄精(P.cyrtonema)、卷叶黄精(P.cirrhifolium)分散在多个分支中,其余物种聚类较明显,参考序列与样品序列在NJ 树中的分布有一定的规律性,可初步作为物种鉴定的依据。
由 图1 可 以 看 出, 样 品LQL01、LQL9、LQL10、LQL16、LQL19、LQL20、LQL21 显 示 与多花黄精聚在一起形成多个分支,而在ITS2 序列的NJ 树中,LQL01 更倾向于与滇黄精聚在一起,LQL09、LQL16、LQL19、LQL20、LQL21 与 多 花黄精聚在一起,而LQL10 与玉竹(P.odoratum)聚为一支,LQL21 则不能明确鉴定。结合样品植物形态的观察,LQL09、LQL16、LQL19、LQL20 和LQL21 同多花黄精相似,均为连珠状或结节成块根茎,叶互生,椭圆形、卵状披针形至矩圆状披针形,由此可初步将上述5 个样品鉴定为多花黄精,而LQL10 与玉竹形态特征相似,因此初步鉴定为玉竹。
样 品LQL03、LQL13、LQL22 在psbA-trnH序列NJ 树中较好地与轮叶黄精(P.verticillatum)聚为一支,而在ITS2 序列的NJ 树中,LQL13、LQL22与轮叶黄精聚在一起,但LQL03 独自为一支。根据形态特征,LQL03、LQL13、LQL22 这3 个样品形态与轮叶黄精比较一致,根状茎一头粗,一头较细,粗的一头有短分枝,叶多为3 叶轮生,条状披针形,植株较高,因此可鉴定为轮叶黄精。
样 品LQL12、LQL17 在psbA-trnH序 列NJ 树中与卷叶黄精(P.cirrhifolium)聚为一支,而在ITS2 序列NJ 树中这2 个样品同样与卷叶黄精聚在一起但形成2 个分支。结合形态特征,初步鉴定这2 个样品为卷叶黄精,形态上均呈现出根状茎连珠状,叶4~6 枚轮生,细条形至条状披针形,先端拳卷或弯曲成钩状,花序轮生。
样品LQL04、LQL05、LQL06、LQL07 在2 种NJ 树中均聚在一起,在psbA-trnH序列NJ 树中位置与滇黄精靠近。结合样品本身形态,根状茎近圆柱形或近连珠状,多枚叶片轮生,条形、条状披针形或披针形,先端拳卷。综合考虑将上述4 个样品鉴定为滇黄精。
此外,样品LQL02、LQL08、LQL11、LQL14、LQL15 在2 个NJ 树中位置比较模糊,但总体来说比较接近滇黄精的位置,且形态特征上支持其为滇黄精或卷叶黄精。另外,LQL01 虽然在psbA-trnH序列NJ 树中与多花黄精聚在一起,但形态上更接近于滇黄精,需要结合更多证据进一步研究。
综上所述,得到初步鉴定结果如表5 所示,在收集的22 份样品中,初步判定可能为滇黄精的有11份,可能为卷叶黄精的有7 份,其中暂无法确定为滇黄精或者卷叶黄精的有5 份,鉴定为轮叶黄精的有3 份,玉竹1 份,多花黄精5 份。
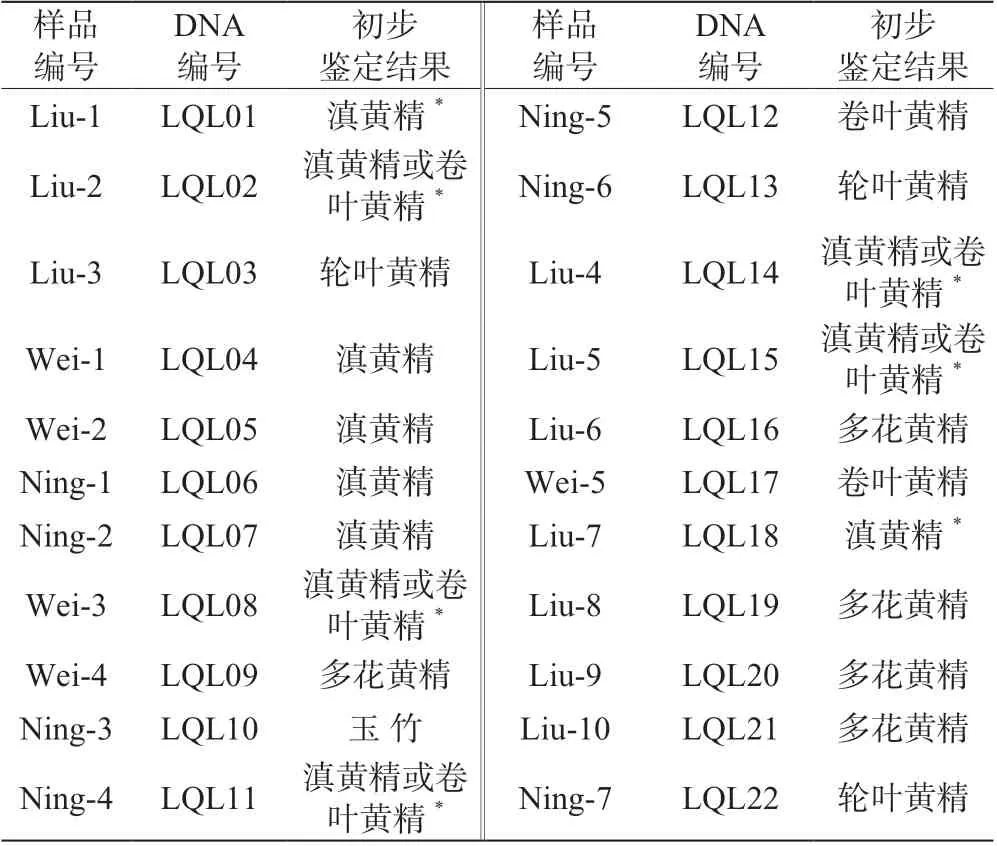
表5 DNA 分子初步鉴定结果
3 讨 论
该研究对收集自云南省不同地区的22 份滇黄精样品进行了DNA 序列的分析,从分子水平探究了实际流通中黄精药材的基源。结果表明,收集的22 份样品都属于黄精属植物,其中大部分基源是准确的,有11 份初步判断或者推测可能是真正的滇黄精,但同时也发现有一部分可能是与其形态较为相似的如多花黄精、轮叶黄精、卷叶黄精或玉竹等种类。由此可见,云南省目前各地种植的滇黄精存在一定量的混淆品,这些混淆品也可以作为黄精药用,但药效、成分都与滇黄精有所区别,如果混用将影响用药的安全性和有效性。这些混淆品药用部位形态与滇黄精基本相似,均为不规则块状或连珠状,但通过进一步观察植株形态可发现,它们的地上部分还是有所差别的。例如多花黄精,其根茎虽与黄精形似,但植物叶片生长方式为对生,而滇黄精的叶片为轮生,其次植株高度、花的形态、叶片形态也均有差别。因此,如果仅以根茎部位作为辨认药材的依据,很容易与其相似植物混淆。其次,有些混淆品与滇黄精在植株整体形态上确实很难区分,如卷叶黄精,无论叶的形态还是根茎均与滇黄精极为相似,从形态上很难辨别,这无疑增加了准确使用黄精药材的难度。另外,根据笔者的调研采访,发现大多种植户对于自家种植的滇黄精的基源并不十分清楚,这是导致滇黄精种植基源模糊的重要原因。
《中国药典》中标明,药材黄精来自于黄精属植物滇黄精、黄精或多花黄精的干燥根茎,按形状不同,习称“大黄精”“鸡头黄精”“姜形黄精”。但这些习称分别代表何种黄精物种并没有明确区分,可见黄精药材包括滇黄精等植物,由于形态多变,依据传统的方法无法准确鉴定。因此,有必要找寻更方便有效的基源鉴别方式,如DNA 分子鉴定。目前,基于ITS 序列的植物类药材DNA 条形码鉴定体系已经初步建立,但该研究显示,以ITS序列构建的系统发育树对于鉴定黄精属植物依然存在困难,ITS2 序列无法高效地将不同种的黄精属植物辨别开来,而叶绿体基因psbA-trnH序列分辨效果相对较好,可初步将其作为黄精属药材分子鉴定的片段使用。然而,对于根茎类药材,市场上多见为干燥药材或者中药饮片及粉末,DNA 破坏严重,提取困难,加上叶绿体基因片段提取技术要求高,难以广泛推广使用。该研究尝试用不同的引物序列(rpl20-rps12、trnLtrnF、psbA-trnH、ITS2)来扩增黄精的DNA,从而获取不同的片段进行聚类分析,初步探索了分子鉴定在滇黄精基源鉴别上的应用效果。笔者认为DNA分子鉴定在一定程度上确实可以作为黄精类药材基源鉴定的依据,但该技术仍需进一步完善和验证。
因时间和条件限制,该研究所采集的样品数量有限,只对云南省内的滇黄精进行了取样,样品含量不够充足;另外,该研究仅限于常用的几个DNA片段的分析,未能综合显微结构、化学成分等方面进行研究,得出的结论较为局限。但初步的结果表明,利用分子生物学方法对物种进行分子鉴定的确是一种较简便、可靠的方法,在中药鉴定、中药材质量控制上有一定的帮助。
