聚苯乙烯微塑料和纳米氧化锌对锦鲫的复合生物效应
2023-10-29周海玲王静艾弗逊王晓琳尹颖
周海玲,王静,艾弗逊,王晓琳,尹颖
(污染控制与资源化研究国家重点实验室,南京大学环境学院,南京,210023)
颗粒态污染物由于独特的性质被广泛应用于生产生活,但在生产运输及使用中难以避免进入环境并产生生态效应,在环境中常常通过吸附、络合等途径与其他污染物相互作用,最终毒性表现出协同或拮抗作用.例如微塑料(MPs)可通过吸附作用减少纳米铜及Cu2+的毒害作用,降低对中肋骨条藻(Skeletonema costatum)的毒性[1],但同时也可与纳米金表现出协同作用,增强对大型蚤(Daphnia magna)的生殖毒性并诱导子代死亡[2].
纳米氧化锌(ZnO NPs)作为一种常见的颗粒态污染物,凭借其优良性质被广泛应用,同时对生态系统及其中的生物产生作用[3].研究表明,ZnO NPs 可对生物造成氧化损伤[4],还具有胚胎毒性和神经毒性[5]等.Kaya et al[6]报道了ZnO NPs 对尼罗罗非鱼(Oreochromis niloticus)的不同器官都造成了一定程度的氧化损伤,且粒径为10~30 nm 的ZnO NPs 毒性强于粒径为100 nm 的ZnO NPs.刘倩等[7]研究ZnO NPs 对D.magna的效应时发现ZnO NPs 可以黏附在D.magna肠道和体表,从而对其产生个体及行为毒性.
MPs 因其粒径小,比表面积大,所以具有较强的吸附能力,可以吸附环境中的重金属[8]及各种污染物[9],并作为载体改变它们在生物体内的积累情况和生物毒性,最终产生的毒性表现为协同、相加和拮抗作用[10-11].MPs 可改变贻贝(Perna viridis)对全氟辛烷磺酸类物质的氧化应激响应,使内脏中MDA 含量升高[12].粒径为50 nm 的聚苯乙烯MPs(Polystyrene Microplastic,PS MPs)和菲共暴露对D.magna的毒性具有相加效应[11],在14 d 的培养过程中PS MPs 显著增加了生物体内的菲累积.目前对于MPs 与其他污染物的复合效应,研究对象多为有机污染物和重金属,而与纳米金属氧化物的复合影响研究较少,两种典型的颗粒态污染物是否会在水生态系统中不稳定或易沉降,从而改变污染物的生态效应,现阶段鲜见报道.
本实验通过不同浓度PS MPs 与ZnO NPs 的共暴露实验,研究两者在水环境中的赋存状态及其对锦鲫的生物效应,为MPs 和纳米金属氧化物对水生态环境的影响及机制研究提供更多的理论依据.
1 材料与方法
1.1 实验材料与试剂ZnO NPs(上海麦克林生化科技有限公司,中国)粒径为(30±10)nm,纯度99.9%.苯乙烯(上海凌峰化学试剂有限公司,中国)使用前先经减压蒸馏纯化处理去除所含阻燃剂.锦鲫(Carassius auratus)购于南京市夫子庙花鸟市场.
PS MPs 的制备:采用分散聚合的方式制备实验所用PS MPs[13],向140 mL 纯水中充入N210 min 后,保持180 r·min-1滴加苯乙烯,在室温下搅拌分散10 min.再加入10 mL 已通N25 min 的过硫酸钾溶液(23 g·L-1),调节N2流速至平衡系统匀速冒泡.之后使用油浴锅(98-3 型,予华仪器有限公司,中国)在78 ℃条件下加热1~2 h,继续反应24 h.反应过程中持续通入N2防止产物发生氧化,连续合成24 h 后取出产物洗涤纯化.
1.2 实验设计随机选取生长状态一致的健康锦鲫分别暴露于设置的浓度条件下(表1),每组八条鱼,每缸中共30 L 暴露液.经10 d 适应阶段及驯养阶段,前3 d 为适应阶段,不喂食不换水,后续7 d 为驯养阶段,间隔一天换水喂食,之后开始暴露实验.本研究采取静态暴露,按照对应浓度分别称取PS MPs 和ZnO NPs 粉末加入到100 mL 超纯水中,超声分散10 min 后转移到鱼缸中.暴露实验持续两周,其间采用半换水法.
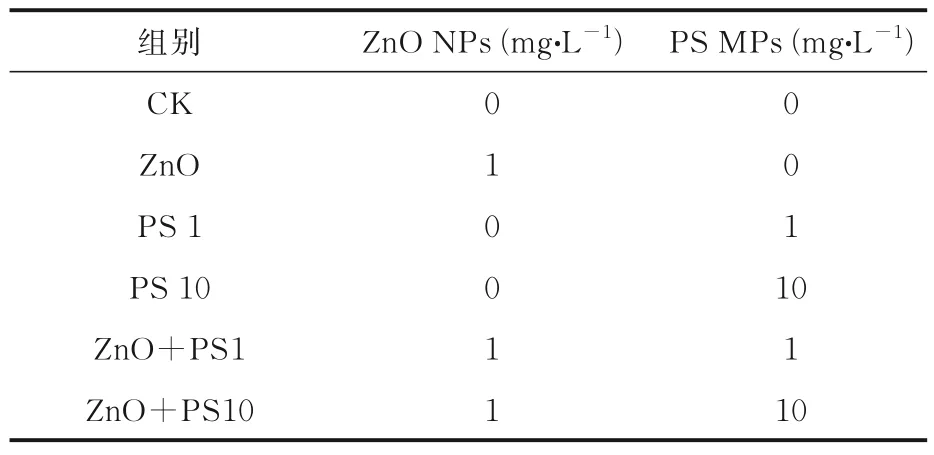
表1 各处理组污染物浓度Table 1 The materials and contents of each group
1.3 样品采集暴露结束后捞出锦鲫,用超纯水冲洗干净皮肤,称重后迅速解剖,剪下左侧鱼肉,取出肝脏称重后制成肝脏匀浆,经低速离心后取上清液用于测定.之后依次取出性腺、肠道、鳃、眼、脑并称重,置于-20 ℃冰箱中冷冻保存备用.
1.4 分析方法PS MPs 与ZnO NPs 的形貌表征:分别取少量两种固体粉末在透射电子显微镜(TEM,JEM-2100,JEOL Ltd.,日本)下采集图像,使用Nano Measure 1.2 软件统计两种颗粒污染物粒径.
水体粒径及Zeta 电位的测量:准确称量适量PS MPs 与ZnO NPs 粉末,加入100 mL 超纯水中,超声分散10 min 后,再稀释至所需浓度(表1),并使用纳米粒度及Zeta 电位分析仪(Zetasizer NaNo ZS,英国马尔文公司,英国)测定两种污染物水合粒径及体系Zeta 电位[14].
水中Zn2+释放量的测定:取水样加入硝酸酸化,在4 ℃条件下3500 r·min-1离心10 min,取上清液过0.22 μm 有机微孔滤膜,利用ICP-MS(Nex-ION 300X,Perkinelmer,USA)测定水体中溶解锌的浓度[15].
组织中Zn 富集量的检测:组织对Zn 的富集量按照刘林[16]的方法进行测定.样品经解冻、干燥、称重后,加入5 mL 浓硝酸预消解12 h,控制温度为90 ℃消解1 h,在120 ℃条件下继续消解至溶液剩余1 mL.加入5 mL 浓硝酸和1 mL 高氯酸,消解至无白烟,再加入10 mL 硝酸(2%),转移至25 mL 容量瓶中,用硝酸(2%)定容.混匀后过0.22 μm 有机微孔滤膜,取5 mL 消解液用ICPMS 测定Zn 含量(dw,mg·kg-1).
肝脏组织氧化损伤指标的测定:蛋白的测定采用考马斯亮蓝法,以小牛血清蛋白为标准,加入考马斯亮蓝显色剂混匀,反应2 min 后使用紫外-分光光度计在595 nm 处测定吸光度,计算蛋白含量.超氧化物酶活性(SOD)、丙二醛含量(MDA)及活性氧水平(ROS)分析试剂盒均购自南京建成生物工程研究所,将制备的匀浆液按照试剂盒说明书操作步骤进行测定.
1.5 数据处理实验结果用平均值±标准差(mean±SD)表示,使用SPSS 21.0 软件进行数据统计分析,并采用单变量方差分析和协方差分析(One Way ANOVA)确定处理组间差异的统计学意义,以p<0.05 来表示显著性差异.
2 结果
2.1 TEM 表征图1 为透射电镜(Transmission Electron microscope,TEM)下PS MPs 与ZnO NPs 的形貌图,可以看出,PS MPs 呈规则球状,外表光滑,粒径约为430 nm;ZnO NPs 多为不规则的块状和颗粒状,粒径分布为23.17±14.72 nm(n=400),颗粒大小差异较大,有明显团聚.

图1 PS MPs (A)与ZnO NPs (B)的TEM 图像Fig.1 TEM images of PS MPs (A) and ZnO NPs (B)
2.2 水合粒径颗粒态污染物在水体中通常表现出较强的团聚性,影响其生物可利用性.实验中ZnO NPs 的水合粒径为(425.8±32.08)nm,在水中发生明显聚集,在与PS MPs 复合后,粒径分别增大至(568.0±62.99)nm 和(581.8±24.42)nm(p<0.05),PS MPs 的浓度对ZnO NPs 的水合粒径无影响.PS MPs 在水中同样也发生聚集,但浓度与复合对其粒径无显著影响.加入ZnO NPs 后,1 mg·L-1与10 mg·L-1的PS MPs 粒径分别为(572.7±24.39)nm 与(594.8±13.28)nm,组间不存在显著差异.如图2 所示.
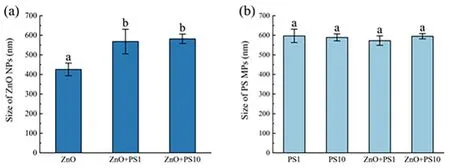
图2 PS MPs 与ZnO NPs 水体粒径Fig.2 Particle size of PS MPs and ZnO NPs in water
2.3 Zeta 电位Zeta 电位可反映胶体分散体系的稳定性,影响颗粒物的聚集与离子释放.一般认为Zeta 电位在-30~30 mV 时物质处于不稳定的状态,小于-30 mV 或者大于30 mV 时,体系具有良好的稳定性和分散性[17].单一ZnO NPs 的Zeta 电位约为-14 mV,而单一PS MPs 的Zeta 电位接近-30 mV(图3),PS MPs 在水中介稳性高于ZnO NPs.与ZnO NPs 相比,ZnO NPs 与PS MPs 复合后Zeta 电位绝对值显著增大(p<0.05),在水体中稳定性增强.1 mg·L-1PS MPs 复合组的Zeta 电位绝对值低于10 mg·L-1PS MPs复合组,表明浓度会影响复合体系的稳定性.
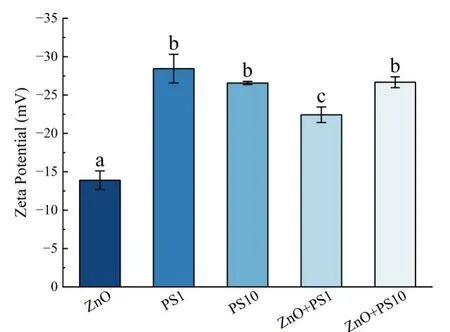
图3 不同组别水体的Zeta 电位Fig.3 Zeta potential of different groups
2.4 水体中Zn2+的含量金属离子的释放是纳米金属颗粒造成水生生物毒性的主要原因[18].实验中未添加ZnO NPs 的三组水体中锌含量极低,单一ZnO NPs 组、1 mg·L-1PS MPs 复合组以及10 mg·L-1PS MPs 复合组的Zn2+溶出率分别为64.6 %,62.9 %,58.5%(图4),10 mg·L-1PS MPs 复合组水体中Zn2+含量显著低于前两组(p<0.05),表明10 mg·L-1PS MPs 复合可减少ZnO NPs 中Zn2+的释放,从而可能降低其带来的毒性效应.
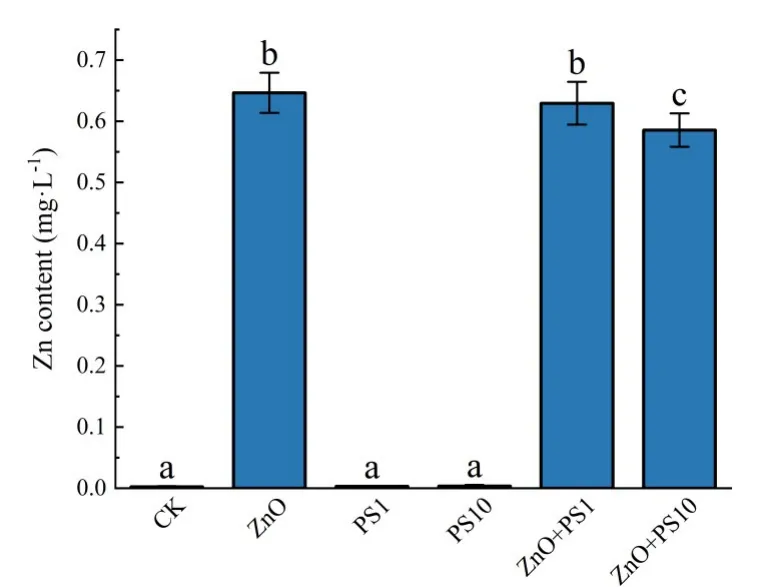
图4 养殖水体中Zn2+的释放量Fig.4 Release of Zn2+ in aquaculture water of different groups
2.5 Zn 在锦鲫各组织中的分布金属氧化物颗粒及其溶解释放出的金属离子可通过多种途径蓄积在靶器官中,并对生物产生毒性.Zn 在锦鲫各器官中含量排序为:肠>眼>鳃>肉>性腺>脑(表2).相较于ZnO NPs 单一胁迫,复合胁迫对肠道、鱼肉、鳃和性腺中Zn 含量并无显著作用;在眼部,PS MPs 的添加与浓度均可影响Zn 的富集,ZnO NPs 单一胁迫下Zn 含量为(426.1±95.4)mg·kg-1,10 mg·kg-1PS MPs 复合后Zn 含量显著增大((555.8±154.2)mg·kg-1),高浓度PS MPs(10 mg·kg-1)可促进眼中Zn 的富集;与眼部不同的是,在富集量最低的脑中,低浓度 PS MPs(1 mg·L-1)复合后可抑制脑中Zn 的转运与富集(p<0.05),而高浓度则无显著影响.
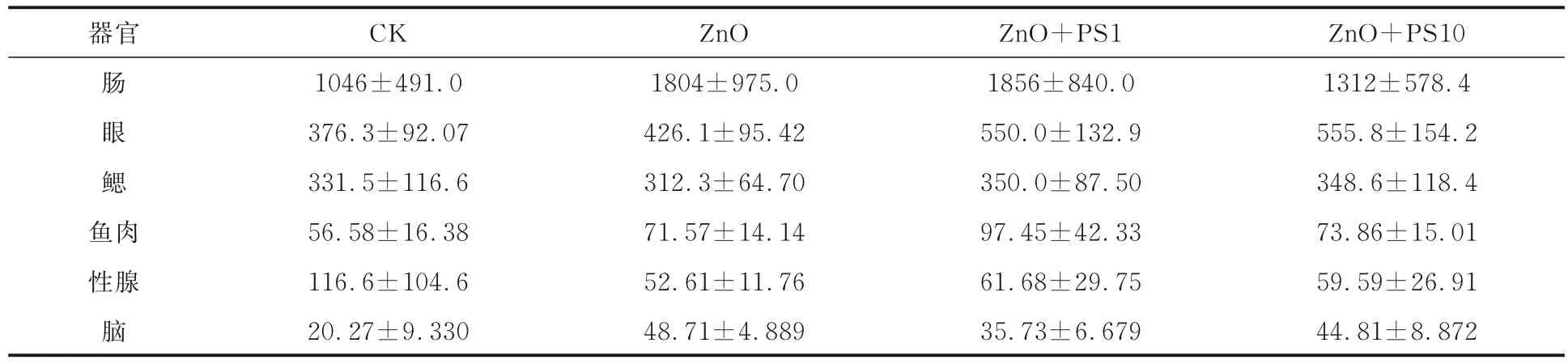
表2 锦鲫各器官Zn 的富集量(单位:mg·kg-1)Tab.2 Zn accumulation in different organs of Carassius auratus (unit: mg·kg-1)
2.6 肝脏组织的氧化损伤指标污染物对生物的毒性通常包括氧化损伤作用,具体表现为相关生物标志物含量产生变化.由图5 可知,相较空白组,各组SOD 活性和ROS 均未产生显著差异;ZnO NPs 和PS MPs 单一胁迫都未影响肝脏细胞MDA 含量,但1 mg·L-1PS MPs 复合后MDA 含量显著升高(p<0.05),而10 mg·L-1PS MPs 复合并无显著作用,说明两种污染物复合暴露可造成锦鲫膜脂过氧化损伤,PS MPs 浓度的差异会影响该作用.
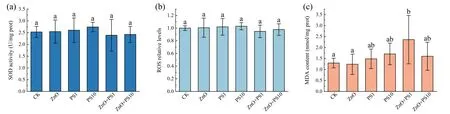
图5 肝脏组织中的氧化应激:(a) SOD;(b) ROS;(c) MDAFig.5 Oxidative stress indicators in liver: (a) SOD,(b) ROS,(c) MDA
3 讨论
ZnO NPs 粒径为(30±10)nm,水溶液中粒径可增大至439.8 nm,在水体中具有很强的团聚性,之前也有报道[19].而当其与PS MPs 复合后,粒径进一步增大,这可能与PS MPs 较强的吸附性有关.由于PS MPs 具有较强吸附颗粒态金属污染物的特性[8],它与ZnO NPs 复合后可在表面吸附更多的ZnO NPs,使得ZnO NPs 水合粒径由于被吸附聚集而增大.Tong et al[20]在0.1 μm PS MPs 对ZnO NPs 在水中溶解释放的影响研究中也出现类似的现象,PS MPs 与ZnO NPs 在光照条件下发生明显团聚现象,表现为更容易发生聚集沉淀.Li et al[21]的研究也报道PS MPs 可作为纳米银的载体,吸附水体中的纳米银颗粒.
纳米金属氧化物的离子释放被认为是致毒的重要原因[22],而MPs 的作用可影响Zn2+的溶解与释放.相较于ZnO NPs 单一胁迫和1 mg·L-1PS MPs 复合组,与10 mg·L-1PS MPs 复合后养殖水中Zn2+的含量显著下降.研究报道MPs 可通过物理吸附等作用吸附金属离子,从而降低它们在溶液中的丰度[23].同时随着与PS MPs 的复合与浓度增大,体系的稳定性增强,可能减少ZnO NPs的溶解与释放.
Zn 作为体内的微量元素,生物各组织Zn 富集量维持在一定水平.在本研究中ZnO NPs 和PS MPs 的单一与复合暴露并未造成肠道、鳃和鱼肉中Zn 含量显著增加,只有脑部例外.对于鱼类来说,口腔摄入是颗粒态污染物进入体内重要方式之一[24],肠道则是纳米颗粒在水生动物体内富集的主要器官[25].而PS MPs 的复合与浓度对肠道中Zn 的富集无明显影响,这或许与ZnO NPs强烈的聚集性相关.ZnO NPs 在水中发生明显聚集,而与微塑料复合后粒径进一步增大,从而影响肠道的吸收和富集.
在脑部,相较于单一胁迫组,ZnO NPs 与1 mg·L-1PS MPs 复合后Zn 含量下降,而与10 mg·L-1PS MPs 复合则无差异,较低浓度的PS MPs可减少Zn 在脑中的富集.由于血脑屏障的存在,较大的颗粒态纳米金属氧化物无法进入脑中,离子态是金属进入脑中的主要形式[26].1 mg·L-1PS MPs 复合组体系Zeta 电位绝对值更小,ZnO NPs稳定性差,Zn2+溶出率更高,从而提高脑中Zn 的含量.但也有研究发现浓度为0.76 mg·L-1的ZnO NPs 与PS MPs 复合后对脑中Zn 的富集并无显著影响[27],可能是由于颗粒物粒径与浓度的差异使得复合后并未能改变水体Zn2+含量与脑对Zn 的吸收富集.
SOD 可通过清除生物体内超氧阴离子而保护机体免受氧化损伤[28],是生物体内抗氧化系统重要酶系之一.实验中锦鲫暴露于污染物两周后,各组肝脏中SOD 含量十分接近,污染物的浓度和复合对肝脏SOD 活性无明显影响.同样在Meng et al[29]的研究中,0.8 mg·L-1ZnO NPs 胁迫下,PS MPs 的粒径大小与污染物的复合对SOD活性也未产生显著影响.本实验ZnO NPs 浓度为1 mg·L-1,可能未达到产生显著影响的阈值[30].
MDA 是膜脂过氧化损伤的产物,机体遭受氧化胁迫时往往会大量累积.本研究中除了ZnO NPs 与1 mg·L-1PS MPs 复合后肝脏细胞氧化损伤加剧,其余各组均无显著效应,表明较低浓度的PS MPs 与ZnO NPs 复合暴露可造成氧化损伤.另外与通常认知不同的是,低浓度复合组MDA含量增大,却未观察到生物体内的强氧化剂ROS含量发生明显变化,推测这可能是锦鲫体内的抗氧化酶作用以消除ROS 产生的氧化损伤,使得产生的ROS 很快被生物体清除.
4 结论
ZnO NPs 在水体中与PS MPs 复合后,两者的相互作用可增强ZnO NPs 团聚性,使团聚体粒径增大,体系稳定性提高,且高浓度(10 mg·L-1)PS MPs 复合可能通过吸附作用降低了水体中游离Zn2+的含量.在复合实验中,PS MPs 的浓度对不同组织的Zn 富集表现出不同的效应,高浓度复合促进了Zn 在眼部的富集,而低浓度复合减少了脑部Zn 的富集,PS MPs 可通过影响ZnO NPs 在体系中的稳定性及Zn2+溶出改变组织对Zn 的富集;两者在低浓度下的复合增加了对肝脏的膜脂过氧化损伤,提高了生物毒性.
