非洲猪瘟病毒P30蛋白的表达及抗体液相芯片检测方法的建立
2023-10-29张芳源杨大为仇德洋姜国骞李桂梅
张芳源,杨大为,仇德洋,姜国骞,李桂梅,2,3*,单 虎,2,3
(1.青岛农业大学动物医学院,青岛 266109;2.山东省新兽药创制协同创新中心,青岛 266109;3.山东省兽药诊断试剂工程技术研究中心,青岛 266109)
非洲猪瘟 (African swine fever, ASF) 又称疣猪疫,是由非洲猪瘟病毒(African swine fever virus, ASFV)引起的一种急性、出血性且具有严重危害的传染病,其临床症状和病理变化与急性猪瘟相类似,病程短,死亡率高达100%[1-2],世界动物卫生组织将其列为必须报告的动物疫病,我国将该病列为一类动物疫病。1921年,在非洲地区首次发现非洲猪瘟病毒,一直仅限于非洲地区流行;到1957年,在欧洲的葡萄牙被发现,开始了在欧洲地区的流行;2007年该病在高加索地区暴发,并很快侵入俄罗斯[2-4]。直至2018年,我国首例非洲猪瘟在辽宁省出现[5-6],随后在全国多个省份蔓延,给我国养猪业乃至整个社会经济造成了巨大的损失。非洲猪瘟病毒传播迅速,传播途径广,目前尚没有研制出对应的疫苗,只有及时的诊断,才能遏制此病毒的传播。
ASFV是非洲猪瘟病毒科非洲猪瘟病毒属的唯一成员,是一种以双链DNA为遗传物质的虫媒病毒[7]。非洲猪瘟病毒粒子直径为250~300 nm,基因组长为170~194 kb,病毒粒子基因组和核蛋白形成病毒核心部分[8-9]。成熟的病毒粒子能够表达50种以上的结构蛋白,P30蛋白是ASFV的内囊膜蛋白之一,也是最具抗原性的蛋白之一,由CP204L基因编码,常在感染后的2~4 h表达,12 h后合成减少,能诱导中和抗体的产生,在整个感染期都能检测到,是ASFV重要的结构蛋白[10]。
为更好地防控非洲猪瘟,开展非洲猪瘟相关检测技术尤为重要。目前针对非洲猪瘟病毒最常用的血清学检测手段是酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA),如张锦等[11]、徐黎晖等[12]和于学祥等[13]用P30蛋白作为抗原建立了间接ELISA检测方法,但ELISA不能同时大量检测多种病原, 难以满足高通量检疫的要求。液相芯片技术[multi-analyte profiling solve for unknown x (xMAP) technology]作为一种新型的检测技术,具有高通量、多靶标、灵敏度高、特异性好等诸多优势,该技术操作简单、应用灵活,可以同时对不同的指标进行检测,迄今为止,全球已有数百套液相芯片技术用于蛋白质、核酸等检测[14-15]。
本研究将P30蛋白作为抗原,建立并优化了ASFV液相芯片检测方法,以期用于ASFV的血清学检测及评估机体感染后体内的抗体水平。
1 材料与方法
1.1 菌株、载体和血清
大肠杆菌BL21(DE3)感受态细胞,购自天根生化科技有限公司;大肠杆菌DH5α感受态细胞,购自TaKaRa生物技术有限公司;原核表达载体pET-28a由本实验室保存并提供;非洲猪瘟标准阳性血清购自中国兽医微生物菌种保藏中心;32份无特定病原体(specific pathogen free,SPF)猪血清由哈尔滨兽医研究所馈赠;塞内卡病毒(Seneca virus A,SVA)阳性血清、口蹄疫病毒(foot and mouth disease virus,FMDV)阳性血清、20份非洲猪瘟阴性血清由本实验室保存;92份未知猪血清来自山东各养殖场送检样本;猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)阳性血清、猪瘟病毒(classical swine fever virus,CSFV)阳性血清、水泡性口炎病毒(vesicular stomatitis virus,VSV)阳性血清和猪传染性胃肠炎病毒(transmissible gastroenteritis virus,TGEV)阳性血清由云南海关馈赠。
1.2 主要试剂和试剂盒
质粒小提试剂盒、琼脂糖凝胶DNA回收试剂盒均购自天根生化科技(北京)有限公司;IPTG购自上海蓝季科技发展有限公司;BCA蛋白浓度测定试剂盒和His标签蛋白纯化试剂盒(包涵体)购自北京康为世纪生物科技有限公司;T4 DNA连接酶、BamHⅠ限制性内切酶、XhoⅠ限制性内切酶均购自TaKaRa生物技术有限公司;绿色荧光核酸染料、尿素和生物素标记的羊抗猪IgG均购自北京索莱宝科技有限公司;Omni-EasyTM一步法 PAGE凝胶快速制备试剂盒(12.5%)购自上海雅酶生物医药科技有限公司;Goat Anti-Pig IgG H&L(HRP)购自艾博抗(上海)贸易有限公司;生物素化的抗His的抗体(6X-His Tag Monoclonal Antibody, Biotin)购自美国Invitrogen公司;Bio-Plex偶联试剂盒、Bio-Plex羧基磁珠、Bio-Plex检测反应试剂盒、多肽氨基偶联试剂盒均购自伯乐生命医学产品(上海)有限公司;非洲猪瘟病毒ELISA抗体检测试剂盒(P30)购自哈尔滨国生生物科技股份有限公司。
1.3 目的基因的筛选和设计
根据GenBank发表的African swine fever virus isolate Pig/HLJ/2018(MK333 180.1)基因中的CP204L基因序列,进行序列分析和密码子优化,由中美泰和生物有限公司合成和测序,构建pCold-TF-p30重组载体。
1.4 P30基因克隆及重组质粒的构建与鉴定
根据所合成的基因序列用SnapGene软件设计引物进行PCR扩增,上游引物:5′-ATGGGTCGCG-GATCCGACTTTATCCT-3′(划线部分为BamHⅠ酶切位点);下游引物:5′-GTGGTGCTCGAGTT-TCTTCTTCAGCAG-3′(划线部分为XhoⅠ酶切位点),引物由生工生物工程(上海)股份有限公司合成。
取上、下游引物各2 μL、p30基因模板4 μL、ddH2O 17 μL、Taq酶25 μL,充分混匀,按以下程序进行PCR反应:94 ℃预变性2 min;94 ℃变性30 s、56 ℃退火30 s、72 ℃延伸1 min,共30个循环;72 ℃延伸2 min。PCR产物经1.0%琼脂糖凝胶电泳鉴定后用胶回收试剂盒回收p30基因片段。
用限制性内切酶BamHⅠ和XhoⅠ对回收的p30基因片段和pET-28a载体进行双酶切,经1.0%琼脂糖凝胶电泳鉴定后用胶回收试剂盒回收。用T4连接酶对回收的酶切产物连接过夜,连接产物转化到DH5α大肠杆菌感受态细胞中,经菌液PCR和双酶切鉴定后送至生工生物工程(上海)股份有限公司进行测序鉴定。
1.5 重组蛋白的诱导表达
将鉴定正确的pET-28a-p30重组质粒转化到大肠杆菌BL21(DE3)感受态细胞中,涂板过夜培养,取生长良好的单菌落接种于含有卡那霉素的LB液体培养基中,过夜培养,待OD600 nm值达0.6~0.8之间加入IPTG至终浓度为1 mmol·L-1,并设置不加诱导剂的空白对照,继续培养8 h后,4 ℃、12 000 r·min-1离心8 min,弃去上清,用1 mL PBS重悬菌体沉淀,离心、弃上清,1 mL PBS重悬菌体后再离心,最后用1 mL PBS重悬菌体沉淀。取一管重组载体诱导后的菌液在冰浴条件下进行超声破碎,离心10 min取上清和沉淀,对所有样品进行SDS-PAGE分析。
1.6 重组蛋白诱导表达的条件优化
1.6.1 IPTG诱导浓度的优化 将空载体菌液和重组菌液37 ℃、220 r·min-1培养至OD600 nm值达到0.6~0.8之间,不同摇菌管中加入IPTG的终浓度分别为0.2、0.4、0.6、0.8、1.0、1.2 mmol·L-1,在37 ℃条件下,诱导表达8 h后,将样品进行离心和重悬,进行SDS-PAGE鉴定分析。
1.6.2 诱导表达时间优化 将空载体菌液和重组菌液37 ℃、220 r·min-1培养至OD600 nm值达到0.6~0.8之间,在37 ℃条件下,加入相同终浓度的IPTG(1.0 mmol·L-1),在诱导表达3、6、9、12、22及24 h时间段分别拿出一管进行离心和重悬,将样品进行SDS-PAGE鉴定分析。
1.7 重组蛋白的大量表达、纯化及复性
取保种的菌液按1%的比例接入含有卡那霉素的液体培养基进行过夜复苏,复苏后按3%比例接入含有卡那霉素的液体培养基,培养至OD600 nm值达到0.6~0.8之间,在最佳诱导条件下进行大量表达,对表达后的菌液进行离心、重悬和超声破碎,破碎后离心15 min,收集沉淀。将沉淀重悬于Binding Buffer(按照His蛋白纯化试剂盒中的说明书配制)中,尽量混匀使包涵体充分溶解,4 ℃、12 000 r·min-1离心20 min收集上清。按照BCA蛋白浓度测定试剂盒中的说明书测定浓度,以梯度洗脱的方式按照His标签蛋白纯化试剂盒中的说明书纯化P30蛋白。收集流穿液、洗杂液和洗脱液,取样并进行SDS-PAGE鉴定分析。
配制浓度分别为6、5、4、3、2、1、0 mol·L-1的尿素溶液,调pH至7.5并加入10%的甘油。将纯化后的蛋白装入透析袋,并将透析袋放入装有尿素溶液的烧杯中,置于磁力搅拌器上,在4 ℃条件下从6 mol·L-1的浓度进行梯度透析,每隔2 h进行一次换液。透析结束后,将蛋白溶液取出4 ℃、12 000 r·min-1离心10 min收集上清并进行SDS-PAGE鉴定分析和蛋白浓度测定。
1.8 重组蛋白Western blot分析
将透析后的重组P30蛋白和空载体诱导后的样品经SDS-PAGE后转移到PVDF膜上,转膜后用1×TBST洗膜,泡入5%脱脂奶粉中封闭过夜;洗膜,用ASFV标准阳性血清作为一抗,按1∶1 000比例稀释,4 ℃孵育过夜;洗膜,以Goat Anti-Pig IgG H&L(HRP)抗体作为二抗,按1∶10 000比例稀释,室温孵育1 h;洗膜,用ECL发光液进行显色,用凝胶扫描成像系统观察结果。
1.9 微球的活化及偶联
将Bio-Plex偶联试剂盒取出恢复室温,将多肽氨基偶联试剂盒取出室温干燥1 h。取100 μL 54号微球(约1.25×106个)于包裹锡箔纸的偶联反应管中。将装有微球的偶联反应管漩涡混匀,置于磁力架上静置1 min,弃掉上清;加入100 μL微球清洗液,漩涡混匀30 s,置于磁力架上静置1 min,弃掉上清;加入80 μL微球活化液,加入10 μL 50 mg·mL-1的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC),然后迅速加入10 μL 50 mg·mL-1的N-羟基硫代琥珀酰亚胺(sulfo-NHS),室温旋转混合20 min。孵育完用PBS清洗两遍微球,加入适量P30蛋白,用PBS定容至500 μL,4 ℃过夜孵育。次日,用PBS清洗一遍,加入100 μL微球封闭液,室温旋转混合30 min,将微球重悬于150 μL微球储存液中,用细胞计数板计数,置于4 ℃保存。
1.10 偶联效率验证
取两个包裹好锡箔纸的离心管分别加入10 000个上一步活化并偶联后的微球,待测管加入50 μL稀释好的生物素化抗His的抗体,阴性对照管加入50 μL抗体稀释液,室温旋转混合30 min;置于磁力架上静置1 min,弃掉上清,测试管加入50 μL稀释好的藻红蛋白(phycoerythrin,PE)标记的链霉亲和素(streptavidin-PE,SA-PE),阴性管加入50 μL的分析缓冲液,室温避光孵育10 min。置于磁力架上静置1 min,弃掉上清,用125 μL的储存缓冲液重悬,加入96孔板上,上机检测。
1.11 ASFV液相芯片检测方法的建立
每孔加入5 000个偶联成功的微球,用微球清洗液清洗后每孔加入50 μL稀释好的阴、阳性血清,设置空白对照孔并做3组重复孔,室温避光振荡孵育1 h。将96孔板置于磁力架上静置1 min弃掉上清,清洗微球后每孔加入50 μL稀释好的生物素标记的羊抗猪IgG抗体,振荡孵育30 min。弃掉上清、清洗微球,每孔加入50 μL稀释好的SA-PE,振荡孵育10 min。弃掉上清、清洗微球,每孔加入125 μL分析缓冲液,上机检测。
1.12 最佳检测条件优化
1.12.1 蛋白最佳偶联浓度的确定 按照“1.9”的方法,每孔分别加入6、8、10、12 μg的蛋白与微球偶联。按照“1.10”的方法,对偶联的微球进行效率验证,按照平均中值荧光强度(median fluorescence intensity,MFI)值高低确定蛋白最佳偶联浓度。
1.12.2 最佳血清稀释度和最佳二抗稀释度的确定 按照1.10的方法,加入最佳蛋白浓度偶联的微球,利用棋盘法检测在不同血清稀释度(1∶100、1∶200、1∶400和1∶800)和不同二抗浓度(0.5、1.0、2.0、4.0 μg·mL-1)下的MFI值,每孔做三组重复,用阳性孔平均MFI值(P)/阴性孔平均MFI值(N)的计算方法得出最佳血清稀释度和最佳二抗稀释度。
1.13 阈值的确定
阈值也称为截止值,定义为阴性平均值加3倍的方差(SD)。为了确定ASFV抗体液相芯片检测方法的阈值,对32份SPF猪血清和20份ASFV阴性血清按照最佳检测条件进行测定,每孔做3组重复。
1.14 灵敏性试验
对ASFV阳性血清和阴性血清,从1∶100到1∶25 600进行倍比稀释,用已建立的ASFV抗体液相芯片检测方法进行检测,每孔做3组重复,通过测定的MFI值与阈值比较,判断该方法的灵敏性。
1.15 特异性试验
用已建立起来的ASFV抗体液相芯片检测方法分别检测ASFV阳性血清、SVA阳性血清、FMDV阳性血清、TGEV阳性血清、CSFV阳性血清、VSV阳性血清以及PRRSV阳性血清,判断该方法的特异性。
1.16 重复性试验
为确定该方法的可重复性,用已建立起来的ASFV抗体液相芯片检测方法分别检测两份ASFV阳性血清和3份ASFV阴性血清,分别做3次批间和3次批内试验。
1.17 符合率试验
利用本试验建立的ASFV抗体液相芯片检测方法和购买的ASFV酶联免疫分析试剂盒对实验室保存的92份未知血清进行检测,进行对比,计算符合率。
2 结 果
2.1 重组质粒的构建和鉴定
用限制性内切酶BamHⅠ和XhoⅠ对回收的p30基因片段和pET-28a载体进行双酶切,用T4连接酶对回收的酶切产物连接过夜,连接产物转化到DH5α大肠杆菌感受态细胞中,经菌液PCR和双酶切鉴定后送至生工生物工程(上海)股份有限公司进行测序鉴定。双酶切结果显示,载体片段为5 335 bp、目的片段大小为579 bp(图1),符合预期结果,证明重组质粒pET-28a-p30构建成功。

M. DL10000 DNA相对分子质量标准; 1. pET-28a空载体; 2. pET-28a-p30M. DL10000 DNA marker; 1. pET-28a empty vector; 2. pET-28a-p30图1 重组质粒pET-28a-p30的双酶切鉴定结果Fig.1 Restriction digestion of recombinant plasmid pET-28a-p30
2.2 ASFV 重组P30蛋白的诱导表达及可溶性分析
将鉴定正确的pET-28a-p30重组质粒转化到大肠杆菌BL21(DE3)感受态细胞中,经IPTG诱导表达之后,对诱导前后的空载体菌液、重组载体菌液以及超声破碎后的上清和沉淀取样进行SDS-PAGE鉴定分析。结果显示,重组载体菌液泳道约在30 ku处有一条差异性条带(图2),与ASFV 重组P30蛋白大小相符,证明ASFV P30蛋白初步表达成功;目的蛋白在沉淀中大量表达,说明蛋白为包涵体表达。

M. 蛋白质分子质量标准;1. 未诱导表达的空载体;2. 诱导表达的空载体;3. 未诱导表达的重组菌;4. 诱导表达的重组菌;5. 诱导表达的重组菌超声上清;6. 诱导表达的重组菌超声沉淀M. Protein molecular weight standard; 1. Empty vector without induced expression; 2. Empty vector with induced expression; 3. Recombinant bacteria without induced expression; 4. Induced expressed recombinant bacteria supernatant; 5. Induced expressed recombinant bacteria with ultrasonic supernatant; 6. Induced expressed recombinant bacteria with ultrasonic precipitation图2 重组菌诱导表达及可溶性分析Fig.2 Recombinant bacteria expression and solubility
2.3 ASFV 重组P30蛋白最佳诱导表达条件的优化
将空载体菌液和重组菌液培养至对数生长期,不同摇菌管中加入IPTG的终浓度分别为0.2、0.4、0.6、0.8、1.0、1.2 mmol·L-1,诱导表达8 h。结果显示,IPTG浓度在1.0 mmol·L-1时表达量最高。
将空载体菌液和重组菌液培养至对数生长期,加入相同终浓度的IPTG(1.0 mmol·L-1),诱导表达3、6、9、12、22及24 h。结果显示,诱导表达12、22和24 h蛋白表达量较高,选择22 h作为最佳诱导时间。
2.4 ASFV 重组P30蛋白的纯化及复性
以梯度洗脱的方式,按照His标签蛋白纯化试剂盒中的说明书纯化P30蛋白,收集流穿液、洗杂液和洗脱液,取样并进行SDS-PAGE鉴定分析。结果显示,蛋白在流穿液里损失较少,在洗脱液里大量收集,并有较好的纯化效果(图3A、B)。将蛋白用透析袋按梯度复性后,取样进行SDS-PAGE鉴定分析。结果显示,蛋白成功复性(图4)。

M. 蛋白质相对分子质量标准;1.流穿液1;2. 流穿液2;3. 洗杂液;4~5. 咪唑浓度为50 mmol·L-1的洗脱液1和2;6~7. 咪唑浓度为100 mmol·L-1的洗脱液1和2;8~9. 咪唑浓度为150 mmol·L-1的洗脱液1和2;10~11. 咪唑浓度为200 mmol·L-1的洗脱液1和2;12~13. 咪唑浓度为250 mmol·L-1的洗脱液1和2;14~15. 咪唑浓度为400 mmol·L-1的洗脱液1和2;16. 纯化前的蛋白溶液M. Protein molecular weight standard; 1. Flow through liquid 1; 2. Flow through liquid 2; 3. Wash fluid; 4-5. Eluents 1 and 2 with imidazole concentration of 50 mmol·L-1; 6-7. Eluents 1 and 2 with imidazole concentration of 100 mmol·L-1; 8-9. Eluent 1 and 2 with imidazole concentration of 150 mmol·L-1; 10-11. Eluent 1 and 2 with imidazole concentration of 200 mmol·L-1; 12-13. Eluent 1 and 2 with imidazole concentration of 250 mmol·L-1; 14-15. Eluents 1 and 2 with imidazole concentration of 400 mmol·L-1; 16. Protein solution before purification图3 重组P30蛋白的纯化Fig.3 Purification of recombinant P30 protein

M. 蛋白质相对分子质量标准;1.复性前;2. 透析液;3. 复性后M. Protein molecular weight standard; 1. Before renaturation; 2. Dialysate; 3. After renaturation图4 重组P30蛋白复性Fig.4 Renaturation of recombinant P30 protein
2.5 ASFV 重组P30蛋白免疫反应性鉴定
用透析后的重组P30蛋白和空载体诱导表达后的样品进行Western blot试验,ASFV标准阳性血清作为一抗,Goat Anti-Pig IgG H&L(HRP)抗体作为二抗,判定透析后的重组P30蛋白的反应原性。结果显示,透析后的重组P30蛋白与ASFV标准阳性血清特异性结合,空载体诱导表达后未出现特异性条带(图5),证明纯化后的重组P30蛋白有良好的反应原性。
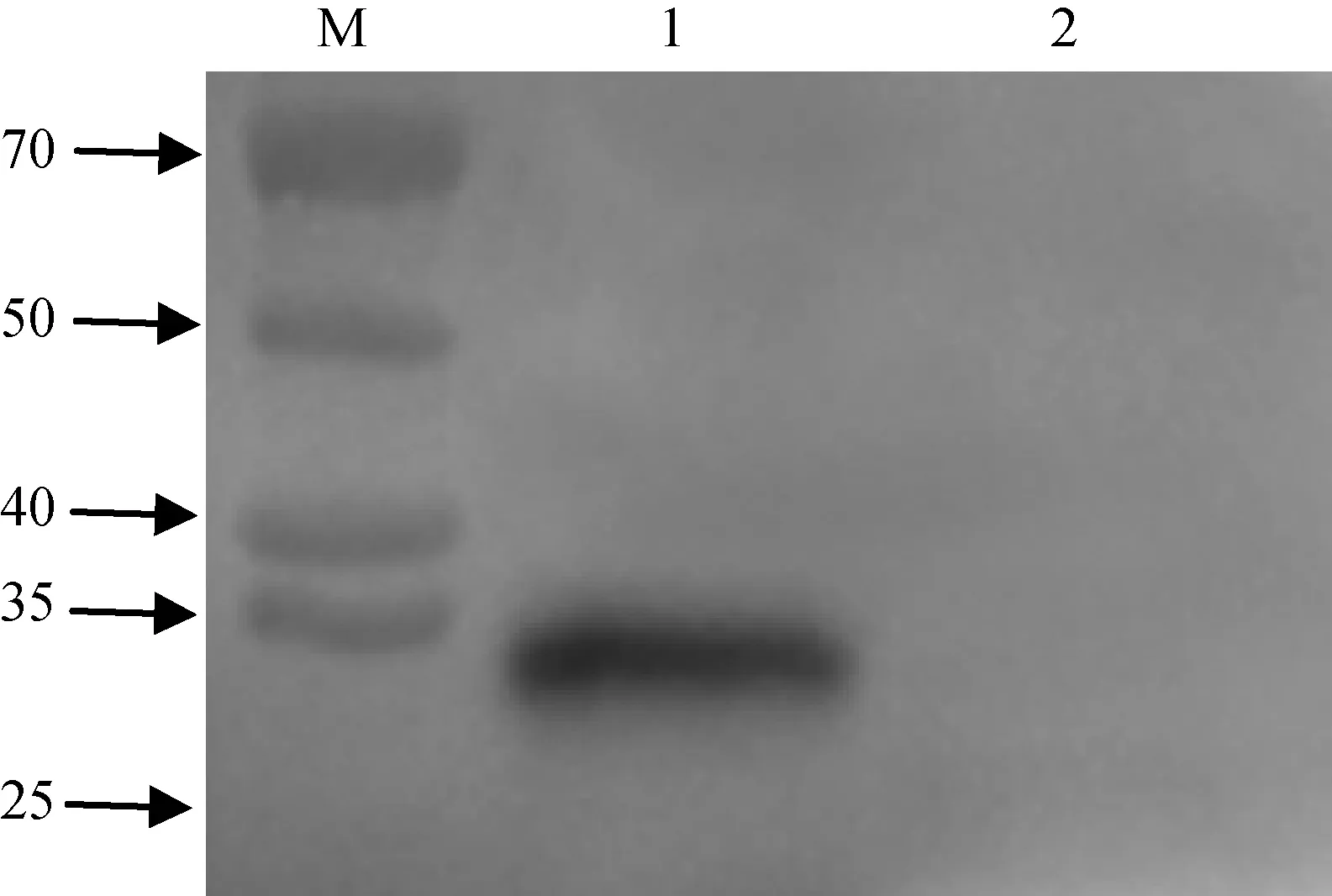
M. 蛋白质相对分子质量标准;1. 透析后的重组P30蛋白;2. 诱导表达后的空载体M. Protein molecular weight standard; 1. Dialyzed recombinant P30 protein; 2. Empty vector with induced expression图5 重组P30蛋白的Western blot鉴定Fig.5 Western blot analysis of recombinant P30 protein
2.6 偶联效率验证
对重组P30蛋白和54号微球的偶联进行验证。结果显示,偶联微球的MFI值为4 968,阴性对照孔的MFI值为36(根据说明书上所述,偶联MFI值大于2 000、阴性孔小于100判定为成功),证明重组P30蛋白与54号微球偶联成功。
2.7 ASFV液相芯片检测方法的建立
用偶联成功的微球检测ASFV标准阴、阳性血清,每孔做三组重复,上机检测。结果显示,阳性孔平均MFI值为11 381.3,阴性孔平均MFI值为84.7(图6),证明ASFV液相芯片检测方法建立成功。

ASFV. 稀释的ASFV阳性血清;NC. 稀释的ASFV阴性血清ASFV. Diluted ASFV positive serum; NC. Diluted ASFV negative serum图6 阳性血清和阴性血清中值荧光强度检测Fig.6 Detection of the median fluorescence intensity (MFI) of positive and negative sera
2.8 最佳检测条件优化
分别用6、8、10、12 μg的蛋白与微球偶联。对偶联的微球进行效率验证,结果显示,偶联蛋白浓度为每1.25×106个微球6 μg偶联效果最佳(图7)。利用棋盘法检测在不同血清稀释度和不同二抗浓度下的MFI值,用阳性孔平均MFI值(P)/阴性孔平均MFI值(N)的计算方法得出最佳血清稀释度和最佳二抗浓度。结果显示,血清稀释度在1∶600、二抗稀释度至1 μg·mL-1时为最佳(表1)。
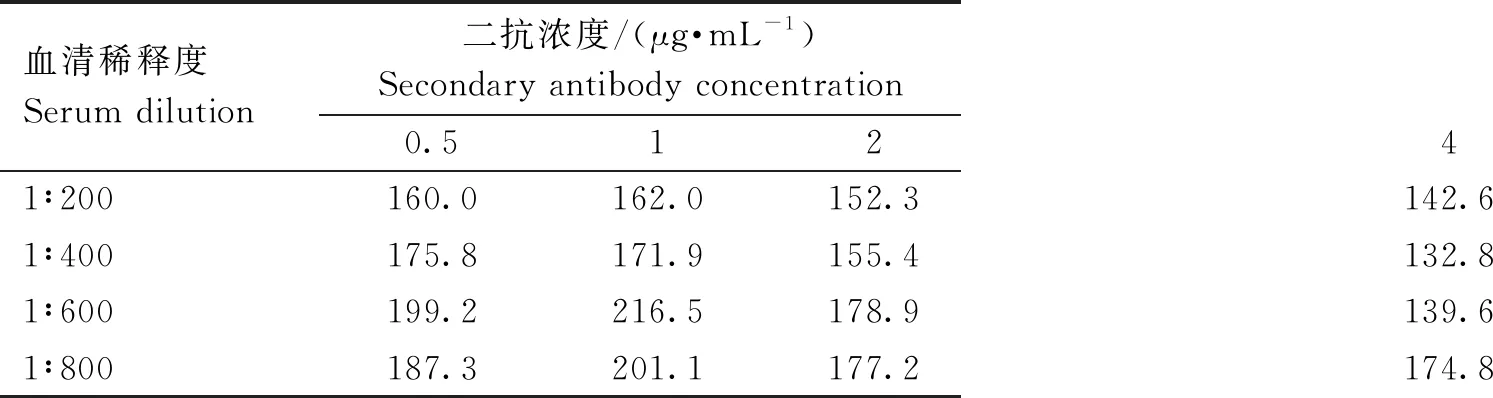
表1 不同血清稀释度和二抗浓度下P/N的值
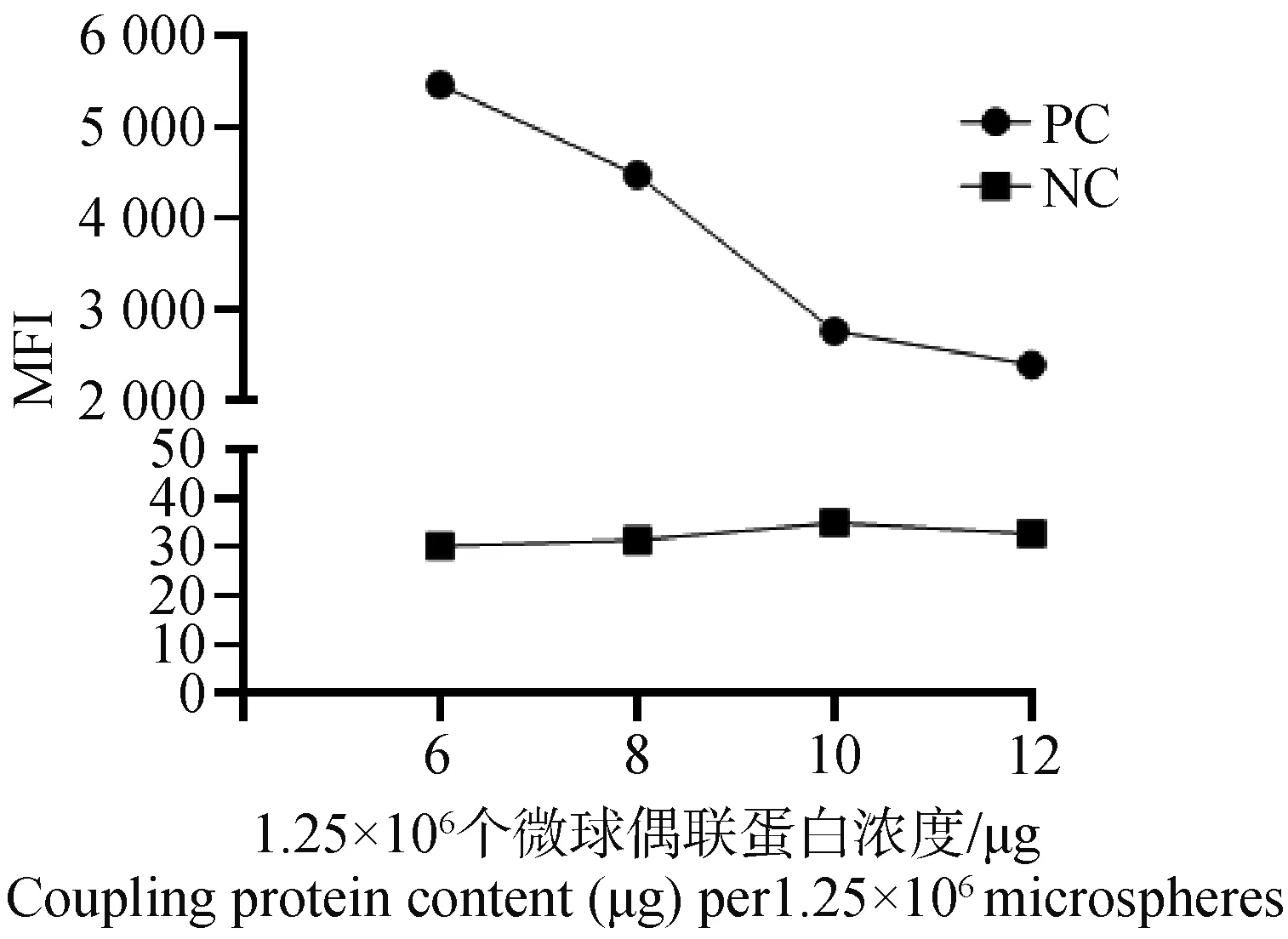
PC. 阳性对照孔;NC. 阴性对照孔PC. Positive control hole; NC. Negative control hole 图7 不同偶联蛋白浓度的MFI值Fig.7 MFI values of different coupling protein concentrations
2.9 阈值的确定
为了确定ASFV抗体液相芯片检测方法的阈值,对32份SPF猪血清和20份ASFV阴性血清按照最佳检测条件进行测定(图8)。通过计算得出,平均MFI值为418.9,方差为385.6,则ASFV检测的阈值为1 575.7,大于此值为阳性,小于此值为阴性。

图8 32份SPF猪血清和20份ASFV阴性血清的MFI值Fig.8 MFI values of 32 SPF pig sera and 20 ASFV negative sera
2.10 灵敏性试验
对ASFV阳性血清和阴性血清倍比稀释,用已建立的ASFV抗体液相芯片检测方法进行检测,通过测定的MFI值与阈值比较。结果显示,当阳性样品稀释度为1∶25 600时检测仍为阳性(图9),证明该方法具有良好的灵敏性。
2.11 特异性试验
用已建立起来的ASFV抗体液相芯片检测方法分别检测ASFV阳性血清、SVA阳性血清、FMDV阳性血清、TGEV阳性血清、CSFV阳性血清、VSV阳性血清以及PRRSV阳性血清。结果显示,ASFV血清检测为阳性,其他血清检测均为阴性,且荧光值差异较大(图10),证明该方法具有良好的特异性。

图10 特异性试验Fig.10 Specificity test
2.12 重复性试验
为确定该方法的可重复性,用已建立起来的ASFV抗体液相芯片检测方法分别检测两份ASFV阳性血清和三份ASFV阴性血清,分别做3次批间和3次批内试验。结果显示,批内和批间的变异系数均小于10%(表2),证明该方法具有良好的重复性。

PC. 阳性对照;NC. 阴性对照PC. Positive control; NC. Negative control 图9 血清不同稀释度下的检测结果Fig.9 Detection results of sera at different dilutions
2.13 符合率试验
利用本试验建立的ASFV抗体液相芯片检测方法和购买的ASFV酶联免疫分析试剂盒对实验室保存的92份未知血清进行检测。两种方法的相对灵敏度为100%(15/15),相对特异性为90.9%(70/77),总符合率为92.39%[(15+70)/92](表3)。
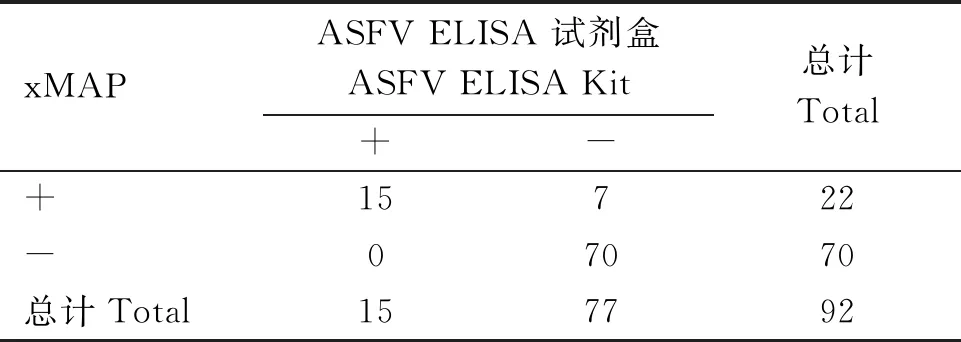
表3 符合率试验
3 讨 论
非洲猪瘟自1921年被发现以来,对全世界养猪业造成了严重的经济损失,虽然近年来对于ASFV的防控已经有所成效,但在商品化的疫苗研制出之前,对于ASFV的防控大多都是增强机体免疫力、加强饲养管理、强化猪场生物安全建设以及早期发现及时屠宰等措施[16],所以对ASFV及时诊断的研究显得尤为重要。
液相芯片技术又称悬浮芯片技术,是将荧光编码微球技术、激光分析技术、流式细胞技术、高速数字信号处理技术及计算机运算法则等多项最新科技成果有机整合到一起的高通量检测技术[17]。区别于常用的固相载体反应方法,液相芯片技术采用更接近生物系统的液相反应体系,并且利用不同荧光编码的微球,达到对一个样品的多重检测和分析,具有高通量、反应快、灵敏度高、特异性强、样本用量少、费用较低等优点[17-19]。在医学领域,液相芯片受到广泛使用,Kuriakose等[20]建立了可同时快速检测所有禽流感病毒(AIV)以及H5、H7、N1和N2亚型的液相芯片检测技术;Akhras等[21]设计了区分10种人乳头瘤病毒基因型的模型试验,结果显示与扩增子焦磷酸检序对比,所建立的方法敏感性更强,可以检测两个附加的共感染;在肿瘤标志物的科学研究和临床诊断方面也有应用[22]。现如今,在动物疫病的诊断与研究方面,液相芯片技的应用也愈加成熟[23-24]。Karanikola等[25]建立了牛粪杆菌和肝片吸虫的抗体液相芯片检测技术,显示了较高的灵敏性和特异性;Wang等[26]对蓝舌病病毒(bluetongue virus,BTV)、流行性出血热病毒(epizootic hemorrhagic disease virus,EHDV)、西尼罗病毒(West Nile virus,WNV)等十种虫媒病原体建立了液相芯片检测技术;李云峰等[27]针对基孔肯雅热(Chikungunya fever,CHIKF)、克里米亚-刚果出血热病毒(Crimea Congo hemorrhagic fever virus,CCHFV)和裂谷热病毒(Rift Valley fever virus,RVFV)建立多重液相芯片检测技术,其灵敏度是传统RT-PCR技术的十倍以上。
本研究利用大肠杆菌原核表达系统成功表达得到ASFV 重组P30蛋白,大肠杆菌原核表达系统有操作简单、表达量高等优点,尽管本试验中重组P30蛋白以包涵体的形式表达,但经过纯化、复性等步骤,使得杂蛋白含量大大减少,得到纯度较好的重组P30蛋白。将P30蛋白与微球偶联,成功构建了ASFV抗体液相芯片检测方法,并针对蛋白偶联浓度、血清稀释度和二抗浓度等条件进行优化,更加完善了该方法。本研究建立的方法在标准阳性血清稀释25 600倍下,仍能检测出阳性,具有极高的灵敏性,远远高于建立的ASFV抗体ELISA检测方法[11-12]。在与商品化ELISA试剂盒的符合率对比试验中,总符合率可以达到92.39%,检出的阳性样本数高于商品化ELISA试剂盒所检出的数目,这可能与该方法极高的灵敏性有关。目前,针对ASFV疫情的防控主要依赖于及时的诊断和无害化处理,本研究建立的ASFV抗体液相芯片检测方法,利用P30蛋白作为抗原,能够在感染早期作出及时诊断,有利于ASFV的及时防控;并且,液相芯片具有高通量的特点,能够一次检测出单一样本中的多种病原体,这使得动物体疾病的检测更加高效、便捷。
4 结 论
本研究利用原核表达系统成功表达重组P30蛋白,基于Luminex 200液相芯片检测平台,建立了ASFV抗体液相芯片检测方法,具有良好的灵敏性、特异性和重复性,与商品化试剂盒对比,具有较高的符合率,可用于ASFV临床样品的检测,为非洲猪瘟的防控技术提供了借鉴,也为今后多种猪病的液相芯片检测技术的研究奠定了基础。
