一株猪圆环病毒2d基因型毒株的全基因组序列及其衣壳蛋白的小鼠免疫原性分析
2023-10-29杨克礼刘泽文袁芳艳宋浩菲田永祥周丹娜
李 畅,周 平,温 平,4,杨克礼,刘 威,郭 锐,刘泽文,袁芳艳,高 婷,宋浩菲,田永祥,周丹娜*
(1.湖北省农业科学院畜牧兽医研究所农业农村部畜禽细菌病防治制剂创制重点实验室,武汉 430064;2.湖北省农业科学院畜牧兽医研究所畜禽病原微生物学湖北省重点实验室,武汉 430064;3.湖北省兽药监察所,武汉430070;4.华中农业大学生猪健康养殖协同创新中心,武汉 430070)
猪圆环病毒(porcine circovirus, PCV)为圆环病毒属成员,是目前已知最小的动物病毒,病毒粒子直径为15~20 nm,基因组为1 759~2 000 bp的单股环状DNA[1]。目前已知的PCV共有4种,其中PCV1被认为是细胞污染物,对猪和人类无致病性;PCV3首次发现于2016年美国某皮炎和肾病综合征(porcine dermatitis and nephropathy syndrome, PDNS)猪的组织样品中;PCV4首次发现于我国湖南省某猪场的断奶仔猪多系统衰竭综合征(post-weaning multisystemic wasting syndrome, PMWS)样品中,但PCV3和PCV4的致病性仍有待进一步确定[2-3]。自20世纪90年代,PCV2就被公认是导致4~16周龄猪发生PMWS、PDNS、先天性震颤、繁殖障碍、间质性肺炎和肉芽肿型肠炎等疾病的主要病原,能破坏猪的淋巴系统,导致猪免疫功能抑制和炎症反应紊乱,从而易引起继发感染[4],给全球养猪业带来巨大的经济损失。
PCV2的基因组长度为1 766~1 768 nt,目前已知含有11个开放阅读框(ORF)[5],其中ORF1长度为945 bp,编码病毒的复制相关蛋白rep(35.7 ku)和rep′(20 ku)[6];ORF2长度为702~705 bp,编码病毒的衣壳蛋白(Cap)(27.8 ku)。Cap是PCV2的免疫原性蛋白,可诱导猪产生中和抗体[7]。ORF3编码一种非结构蛋白(11.9 ku),在诱导细胞凋亡和调控病毒毒力方面发挥作用[8]。根据目前可信度最高的PCV2基因分型标准[1],即:基因型内p值最大为13%(根据ORF2基因计算)、相应内部节点的bootstrap值高于70%、具有至少15个可用序列,可将其分成PCV2a~PCV2i等9个基因亚型,其中2a、2b、2d在世界范围内均流行,2c仅在巴西和丹麦出现,2e主要在亚洲和美国发生,2f和2g主要在亚洲和欧洲流行,2h仅在亚洲流行[9],2i在美国流行[10]。PCV2基因型在我国的流行变化趋势与世界范围内变化趋势基本一致,2002年之前为PCV2a,2002—2008年为PCV2b,2009年之后为PCV2d[1,11]。由于PCV2易发生基因突变,因此,持续监测PCV2流行情况对于疫病防控和疫苗更新具有重要指导意义。
对于PCV2在我国猪场中的广泛感染,接种疫苗能有效降低其流行率,并预防相关疾病发生。针对不同基因型疫苗株保护效果的研究发现,多数情况下,PCV2a和PCV2b为基础的疫苗仍能针对其他基因型毒株的感染产生保护力[11-12]。但是,PCV2d毒株感染可导致比其他基因型毒株更严重的淋巴系统损伤和病毒血症,更易造成继发感染和猪群发病[13-14]。持续分离流行毒株,研究其致病力和Cap蛋白的免疫原性,对于指导临床用苗和研究PCV2致病机理具有重要参考价值。
本研究从湖北省某规模化猪场采集发病仔猪组织样品,经PCR检测证明为PCV2阳性;利用组织匀浆液接种PK-15细胞分离病毒,使用间接免疫荧光测定其生长特性;通过全基因组克隆、测序和序列分析,研究其遗传进化特点;使用生物信息比对、蛋白表达和免疫血清中和病毒试验,分析和评价其Cap蛋白的抗原表位差异和免疫原性,评价Cap蛋白免疫血清的抗PCV2感染效果,为研究湖北省的PCV2流行特点提供参考,为研究PCV2致病机制提供材料和理论基础。
1 材料与方法
1.1 材料
1.1.1 临床样品、细胞和动物 淋巴结、肺和肾样品采自湖北省某规模化猪场疑似PMWS仔猪;BL21(DE3)化学感受态细胞购自南京诺唯赞生物科技有限公司;DH5α化学感受态细胞、PK-15细胞由湖北省农业科学院畜牧兽医研究所兽医室保存;SPF级别BALB/c小鼠购自湖北省实验动物中心。
1.1.2 主要试剂和仪器 DNA提取试剂盒购自爱思进生物技术有限公司;2×Phanta Max Master Mix、Taq Pro HS Universal Probe Master Mix、FastPure Gel DNA Extraction Mini Kit等购自诺唯赞生物科技有限公司;pMD-18 T载体和pET-28a载体购自宝日医生物技术有限公司;S1000TM Thermal Cycler(PCR仪)购自Bio-Rad公司;ViiATM7实时荧光定量PCR仪购自ABI公司;磷酸二氢钾、磷酸氢二钠、TSA、TSB、琼脂糖等购自国药集团化学制药有限公司;胎牛血清(FBS)、DMEM培养基、胰酶购自Gibco公司;HisSep Ni-NTA Agarose Resin 6FF(His标签蛋白琼脂糖高速纯化树脂)购自翌圣生物科技股份有限公司;PCV2猪多克隆抗体(货号:210-70-PCRV)购自VMRD公司;6×His tag抗体(货号:GTX115045)、HRP标记山羊抗兔IgG抗体(货号:GTX213110-01)和FITC标记兔抗猪IgG抗体(货号:GTX26773)购自GeneTex公司。
1.1.3 引物设计和合成 参考PCV2基因组序列和限制性内切酶位点,设计全基因组扩增引物和检测引物;根据PCV2 Cap的核定位序列和抗原表位,设计Cap蛋白的扩增引物;参考GB/T 35901—2018设计PCV2定量PCR引物和探针,由武汉擎科生物有限公司合成,引物序列见表1。

表1 本研究所用的引物和探针
1.2 方法
1.2.1 临床样品的处理 淋巴结、肺和肾样品各200 mg,在冰上剪碎,按照体积比1∶3加入磷酸盐缓冲液(PBS),用组织破碎仪破碎10 min,-80 ℃反复冻融3次,4 ℃ 12 000 r·min-1离心15 min,取上清用于病原检测和分离培养,其余于-80 ℃保存。
1.2.2 PCR 根据DNA提取试剂盒说明书提取样品DNA,使用表1中相应引物和高保真DNA聚合酶扩增PCV2全基因组、检测区域和Cap蛋白抗原表位区域。PCR反应体系:DNA 100 ng、引物F/R各2 μL、2×Phanta Max Master Mix (Dye Plus) 25 μL,加无酶ddH2O至50 μL。PCR反应条件:95 ℃ 3 min;(95 ℃ 15 s、Tm值温度 15 s、72 ℃ 30 s·kb-1)35个循环;72 ℃ 5 min。
定量PCR(qPCR):使用表1中PCV2定量检测引物和Taq Pro HS Universal Probe Master Mix,依据说明书推荐反应体系定量检测PCV2,反应条件:95 ℃ 30 s;95 ℃ 10 s、60 ℃ 30 s,45个循环。
1.2.3 全基因组测序 使用琼脂糖凝胶电泳分离PCV2全基因组扩增产物,回收相应条带,经加尾反应后连接pMD-18 T载体,转化到DH5α化学感受态细胞,经抗生素筛选和PCR鉴定后挑选阳性菌落,送至武汉擎科生物有限公司测序,使用SnapGene进行基因注释。
1.2.4 序列分析 根据文献报道[15],从GenBank下载PCV2各基因型毒株的全基因组参考序列;使用MEGAX Clustal W算法比对测序结果和参考序列;使用MEGAX neighbor-joiningmethod算法绘制基于全基因组和ORF2序列的系统发育树[16];使用RDP5.0分析基因重组事件[17];使用DNASTAR MegAlign分析序列相似性;使用TMHMM预测Cap跨膜区域;使用SignalP 5.0预测Cap信号肽;获取Cap抗原表位信息[18],使用在线工具(www.novopro.cn/tools/color_align_prop.html)比对Cap抗原表位差异。
1.2.5 病毒分离和毒价测定 病毒分离:取“1.2.1”的上清液,经孔径0.22 μm的滤器过滤后,按体积比1∶4同步接种PK-15细胞悬液,培养至细胞长成单层;使用300 mmol·L-1D-氨基葡萄糖孵育30 min,换2% FBS DMEM,继续培养48~72 h,-80 ℃反复冻融3次后,4 ℃ 12 000 r·min-1离心15 min,取上清即为病毒液。
毒价测定:将病毒液作连续10倍稀释(10-1~10-10);按照每孔100 μL加到96孔细胞培养板,每个稀释度作一纵列;每孔加100 μL PK-15细胞悬液,使细胞量达到2×105~3×105个·mL-1;正常细胞对照作两纵列(100 μL 10% FBS DMEM+100 μL细胞悬液);37 ℃ 5% CO2培养至细胞长成单层,使用300 mmol·L-1D-氨基葡萄糖溶液孵育30 min,换用2% FBS DMEM继续培养48~72 h,使用间接免疫荧光试验(IFA)确定阳性孔(未保护)和阴性孔的数量(保护);按Reed-Muench法计算50%细胞感染量(TCID50)。lgTCID50=高于50%感染率的血清稀释度的对数+距离比例×稀释度对数的差,距离比例=(高于50%的感染率-50%)/(高于50%的感染率-低于50%的感染率)。
1.2.6 间接免疫荧光试验(IFA) 取病毒液同步接种PK-15细胞,培养至细胞长至单层,使用300 mmol·L-1D-氨基葡萄糖孵育30 min,换用2% FBS DMEM继续培养48 h;吸弃培养基,用PBS洗2次;加入100 μL·孔-1的预冷无水乙醇,-20 ℃静置30 min,弃去固定液,PBS洗3次,5 min·次-1;加入100 μL·孔-11∶500稀释的PCV2猪多克隆抗体,37 ℃孵育1 h,PBS洗3次,5 min·次-1;加入100 μL·孔-11∶200稀释的FITC标记兔抗猪IgG抗体,37 ℃孵育1 h,PBS洗3次,5 min·次-1;加入50~100 μL·孔-1PBS,使用倒置荧光显微镜观察荧光信号。
1.2.7 Cap蛋白表达 回收BamHⅠ-2Cap127/HindⅢ-2Cap663Cap引物的扩增产物,连接pMD-18 T载体,转化到DH5α化学感受态细胞,经抗生素筛选和PCR鉴定挑选阳性菌落;扩大培养后,提取质粒pMD-18 T-2Cap;使用BamHⅠ和HindⅢ酶切质粒pMD-18 T-2Cap和pET-28a;使用T4 DNA连接酶连接2Cap和pET-28a;转化到BL21(DE3)化学感受态细胞,经抗生素筛选、PCR鉴定和基因测序挑选阳性菌落。将阳性菌接种于LB液体培养基,培养至OD值0.5左右,加入1.0 mmol·L-1IPTG,37 ℃诱导4 h,10 000 r·min-130 min收集菌体,经高压破碎,收集包涵体和破碎上清,使用His标签蛋白琼脂糖高速纯化树脂纯化Cap蛋白,使用SDS-PAGE和Western blot检测Cap蛋白表达情况。
1.2.8 小鼠免疫试验 将100 μg Cap和弗氏完全佐剂等体积乳化混匀,经皮下注射到小鼠颈背部;3周后,将100 μg Cap和弗氏不完全佐剂等体积混匀乳化后,经皮下注射到小鼠颈背部;每周通过尾静脉采集小鼠的血液并分离血清。
1.2.9 血清中和病毒试验 固定病毒-稀释血清法(使用IFA评价):将病毒原液稀释成含200 TCID50·0.1 mL-1;将血清56 ℃灭活30 min,在96孔板中作连续2倍稀释(50 μL血清+50 μL 10% FBS DMEM),每个稀释度作4孔;再加50 μL病毒液,混匀,37 ℃孵育60 min;同时设待检血清毒性对照,阴、阳性血清对照,病毒对照和正常细胞对照;每孔加入100 μL PK-15细胞悬液,培养至细胞长成单层,使用300 mmol·L-1D-氨基葡萄糖溶液孵育30 min,换用2% FBS DMEM,继续培养48 h,使用IFA确定阳性孔(未保护)和阴性孔的数量(保护);按Reed-Muench两氏法计算中和效价(PD50)。lgPD50=高于50%保护率的血清稀释度的对数+距离比例×稀释度对数的差,距离比例=(高于50%的保护率-50%)/(高于50%的保护率-低于50%的保护率)。
血清抑制PCV2试验(使用qPCR评价):将100 μL 1/8稀释的血清与100 μL PCV2(200 TCID50)混合,37 ℃孵育60 min;同时设待阴性血清对照,病毒对照和正常细胞对照;每孔加入100 μL PK-15细胞悬液,培养至细胞长成单层,使用300 mmol·L-1D-氨基葡萄糖溶液孵育30 min,换用2%FBS DMEM,继续培养48 h,使用qPCR检测各组细胞中的PCV2载量。
2 结 果
2.1 临床样品中PCV2的PCR检测
以病猪的淋巴结、肺和肾DNA为模板,使用基因片段检测引物494-F/494-R和全基因组检测引物SacⅡ-PCV2-F/SacⅡ-PCV2-R进行PCR扩增,结果表明,在约494处和1 767 bp处均出现特异性条带,证明病猪组织存在PCV2感染。将该柱PCV2命名为PCV2 XY2022,GenBank登录号为OM249 965.1。
2.2 PCV2 XY2022毒株的分离和鉴定
将阳性组织混合、匀浆、冻融、离心和过滤除菌后,取上清液接种PK-15细胞,并连续传代培养。提取传代培养物DNA,使用引物SacⅡ-PCV2-F/SacⅡ-PCV2-R进行PCR扩增,均能扩增到1 767 bp左右的特异性条带(图1a),说明XY2022毒株能在PK-15细胞上稳定传代。

a. PCV2 XY2022传代的PCR鉴定[M.DL2000 DNA相对分子质量标准;N1~N3. 阴性对照(PBS、DMEM、未感染的PK-15细胞);P. 阳性对照-PCV2WH;1~6. 第3、6、9、12、15、18代XY2022病毒液];b. PCV2 XY2022的间接免疫荧光检测a. PCR results of PCV2 XY2022 strain in different generations (M. DL2000 DNA marker; N1-N3. Negative control (PBS, DMEM, non-infected PK-15 cells); P. Positive control-PCV2WH; 1-6. The 3rd, 6th, 9th, 12th, 15th and 18th generations of PCV2XY2022); b. IFA results of PK-15 cells infected with PCV2 XY2022 strain图1 PCV2 XY2022毒株的PCR和IFA鉴定Fig.1 PCR and IFA detection of PCV2 XY2022 strain
将第12代病毒液接种PK-15细胞,在第60小时使用IFA检测感染情况,发现XY2022和阳性对照毒株PCV2WH均产生特异性荧光,而未接种病毒的细胞无特异性荧光,说明XY2022毒株在PK-15细胞上有效增殖(图1b)。经IFA测定,XY2022的毒价为105.70TCID50·mL-1。
2.3 XY2022的基因组序列比对和遗传进化分析
全基因组测序结果显示,XY2022全基因组长度为1 767 nt,ORF2基因长度为705 nt。基于全基因组和ORF2的进化分析结果均表明,XY2022属于PCV2d基因亚型毒株,与广西毒株(GenBank号:FJ426398.1)的亲缘关系最近(图2)。

图2 PCV2 XY2022毒株的进化分析Fig.2 Phylogenetic analysis of PCV2 XY2022 strain
基于全基因组的核苷酸序列同源性分析显示,XY2022和参考毒株的相似性为94.3%~99.8%,与广西毒株(GenBank号:FJ426 398.1)的相似性最高,达到99.8%。基于ORF2的核苷酸序列同源性分析显示,XY2022和参考毒株的相似性为89.2%~99.6%,与广西毒株(GenBank号:FJ426398.1)和黑龙江毒株(GenBank号:HM038031.1)的相似性最高,均为99.6%。
基于RDP5.0多种算法(RDP、P≤1.121×10-27;GENECONV,P≤2.441×10-25;Maxchi,P≤1.125×10-13;Chimaera,P≤5.111×10-15;SiSscan,P≤2.409×10-16;3Seq,P≤1.374×10-35)的基因重组分析结果显示,XY2022与参考毒株不存在基因重组事件。
2.4 XY2022 Cap氨基酸序列比对和抗原表位分析
根据文献报道[18],Cap蛋白的第65-77、113-139、169-183和193-207位aa是其线性免疫优势区,第47-63、165-200和230-233位aa是其构象中和表位,第156-162、175-192、195-202和231-233位aa是其线性中和表位,第110、191位aa是PCV2毒力调节关键位点。XY2022 Cap和参考毒株Cap的氨基酸序列比对结果表明,XY2022 Cap氨基酸序列存在多个变异度较高的区域,分别是47-78、130-136和185-210位aa;线性免疫优势区的68位aa由A突变为N、134位aa由T突变为N,构象中和表位的63位aa由S突变为R。此外,相比于PCV2a和PCV2b,PCV2d、PCV2c和部分PCV2e的Cap羧基端多1个K残基(图3)。
2.5 XY2022 Cap蛋白的表达和纯化
表达XY2022 Cap和PCV2b(WH)Cap的高变区和抗原表位突变位点所在区域,SDS-PAGE结果表明,该蛋白大小约26 ku,在细菌包涵体和破碎上清中均可稳定表达(图4a)。使用His标签蛋白琼脂糖高速纯化树脂纯化Cap蛋白,获得单一条带的XY2022 Cap(图4b)和WH Cap(图4c)。进一步Western blot检测发现,纯化的蛋白与His抗体以及PCV2 Cap蛋白抗体均可特异性结合,表明纯化的蛋白具有良好的生物学活性(图4d)。

a. SDS-PAGE检测Cap蛋白的表达(M. 蛋白质相对分子质量标准;1. 包涵体中的XY2022 Cap蛋白;2. 细菌破碎上清中的XY2022 Cap蛋白;3. 包涵体中的WH Cap蛋白;4. 细菌破碎上清中的WH Cap蛋白);b. SDS-PAGE检测纯化的XY2022 Cap蛋白(M. 蛋白质相对分子质量标准;1~3. Ni填料结合后洗脱的XY2022 Cap蛋白);c. SDS-PAGE检测纯化的WH Cap蛋白(M. 蛋白质相对分子质量标准;1~3. Ni填料结合后洗脱的WH Cap蛋白);d. Western blot检测纯化的XY2022 Cap蛋白和WH Cap蛋白(1. XY2022 Cap蛋白;2. WH Cap蛋白)a. Detection of Cap protein expression by SDS-PAGE (M. Protein marker; 1. XY2022 Cap protein in inclusion bodies; 2. XY2022 Cap protein in bacterial lysis supernatant; 3. WH Cap protein in inclusion bodies; 4. WH Cap protein in bacterial lysis supernatant); b. Detection of the purified XY2022 Cap by SDS-PAGE (M. Protein marker; 1-3. XY2022 Cap protein elution after Ni-NTA binding); c. Detection of the purified WH Cap by SDS-PAGE (M. Protein marker; 1-3. WH Cap protein elution after Ni-NTA binding); d. Detection of the purified XY2022 Cap and purified WH Cap by Western blot (1. Purified XY2022 Cap; 2. Purified WH Cap)图4 XY2022 Cap和WH Cap的表达和纯化Fig.4 expression and purification of XY2022 Cap and WH Cap
2.6 XY2022 Cap的小鼠免疫原性评价
为了评价抗原表位差异对PCV2 Cap免疫原性的影响,分别使用PCV2b(WH)Cap和PCV2d(XY2022)Cap免疫小鼠,使用IFA测定小鼠血清中和效价。结果表明,中和抗体最早在免疫后第3周可被检测到,并逐周升高,在免疫后第6周达到最高,其中WH Cap和XY2022 Cap诱导的针对XY2022毒株的中和效价最高达到26.66和25.66(图5a),即:1/26.66稀释的WH Cap免疫血清可通过中和作用杀灭或抑制XY2022,保护50%的细胞免于被感染;1/25.66稀释的XY2022 Cap免疫血清可通过中和作用杀灭或抑制XY2022,保护50%细胞免于被感染。WH Cap和XY2022 Cap诱导的针对WH毒株的中和效价最高达到26.33和26.17(图5b)。免疫后第7周,WH Cap诱导的中和效价水平均显著降低,而XY2022 Cap诱导的中和抗体水平仍保持稳定,说明WH Cap和XY2022 Cap均能诱导动物机体产生中和抗体,但是XY2022 Cap诱导的中和抗体水平相对稳定。
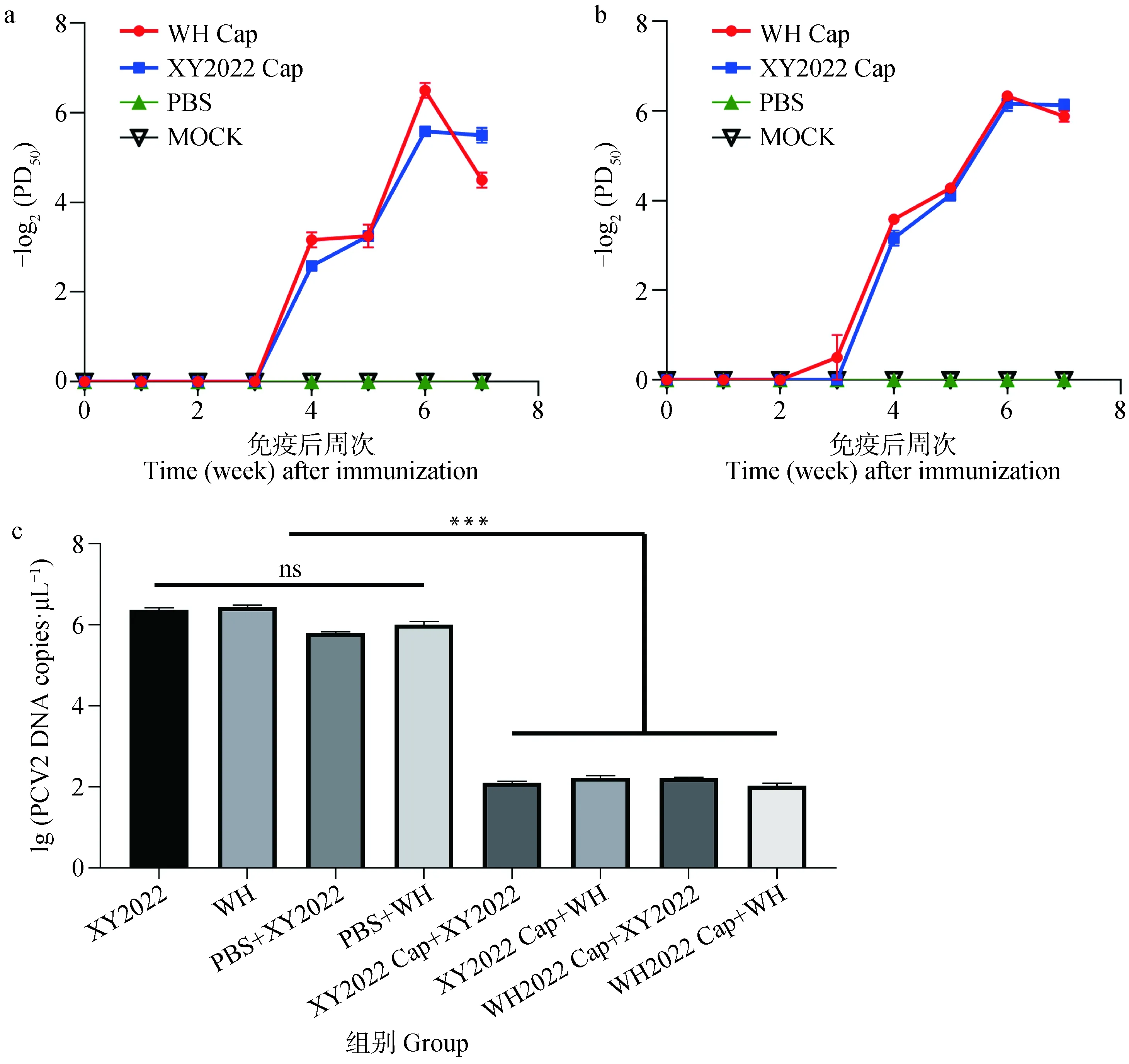
a. XY2022 Cap和WH Cap免疫小鼠血清针对XY2022的中和抗体水平;b. XY2022 Cap和WH Cap免疫小鼠血清针对PCV2WH的中和抗体水平;c. XY2022 Cap和WH Cap免疫小鼠血清抑制PCV2感染活性的qPCR检测结果,ns.P>0.05a. Levels of neutralizing antibodies against XY2022 strains in sera from XY2022 Cap immunized mice and WH Cap immunized mice; b. Levels of neutralizing antibodies against PCV2WH strains in sera from XY2022 Cap immunized mice and WH Cap immunized mice; c. qPCR results of anti-PCV2 activity in sera from XY2022 Cap immunized mice and WH Cap immunized mice,ns.P>0.05,***图5 PCV2b Cap和PCV2d Cap免疫小鼠血清的抗PCV2活性Fig.5 Anti-PCV2 activity in sera of mice immunized with PCV2b Cap and PCV2d Cap
另一方面,通过qPCR评价血清抑制PCV2感染的效果发现,相比于非处理组和PBS免疫小鼠血清组,WH Cap和XY2022 Cap免疫小鼠血清和PCV2共孵育再感染PK-15细胞,可显著降低细胞中PCV2的载量(图5c),表明两种血清中和抗体均能有效杀灭PCV2,抑制PCV2感染PK-15细胞。后续将继续分离新型PCV2毒株,评估其Cap蛋白的免疫原性,测定其中和抗体抑制不同基因型PCV2的效果。
3 讨 论
自1998年首次被报道以来[19],PCV2快速成为养猪业最流行的病原之一,造成巨大经济损失并持续威胁生猪产业健康发展[20]。作者团队以及其他相关研究表明,湖北省规模化猪场的PCV2检出率高居不下,近年来一直维持在38%以上[21-22]。本研究中,作者在湖北省某规模化猪场发现疑似PMWS的仔猪,通过PCR等技术检测其PCV2感染情况,结合猪场后续的用药治疗情况,证明导致该场仔猪发病的病原为PCV2。
PCV2基因组突变频率高,导致我国PCV2流行毒株经历了PCV2a向PCV2b,2009年后向PCV2d转变的快速过程[1,11,21]。因此,持续监测各个省份的PCV2流行情况并分离新型毒株对于相关疾病的防控具有重要意义。本研究中,作者发现引起湖北省某规模场仔猪发病的病原为PCV2,并通过基于全基因组和ORF2的进化分析证明其属于PCV2d基因亚型,这与国内近年来的流行病学报道以及作者团队监测结果[1,11]是相符的。该PCV2与各基因型参考毒株的全基因组相似性为94.3%~99.8%,ORF2基因相似性为89.2%~99.6%,与广西毒株(GenBank号:FJ426 398.1)和黑龙江毒株(GenBank号:HM038 031.1)的相似性最高,推测其可能源于各省之间的生猪流通和猪肉产品交易。作者进一步使用猪肾上皮细胞系PK-15分离出该PCV2d毒株,将其命名为XY2022,并将其序列上传GenBank获得登录号OM249965.1。PCR和IFA检测结果均证明,XY2022在PK-15细胞上具有稳定的增殖性能,毒价可达到105.70TCID50·mL-1,为后续的PCV2致病性研究和疫苗开发提供关键材料。
现阶段基于PCV2a和PCV2b的商品化疫苗以及基于Cap蛋白的亚单位疫苗仍能为猪群提供抗PCV2a、PCV2b和PCV2d毒株的保护力[11,23-25]。但是,不同基因型之间的保护力并不完全,PCV2d感染仔猪可导致更重的临床症状和更早的排毒现象[13-14]。本研究中,作者比较了XY2022和其他基因型毒株的Cap蛋白差异,发现不同基因型毒株的Cap蛋白氨基酸残基数目有所差异,其中PCV2a、PCV2b和PCV2c的氨基酸残基数量为233,PCV2d的氨基酸残基数为234,这与已报道结果一致[14]。另一方面,Cap蛋白有4个优势抗原表位,分别是65—87aa、113—139aa、169—183aa和少量的羧基端氨基酸残基,其中169—183位表位为诱饵表位,导致动物机体产生针对PCV2的非中和抗体[26-27]。PCV2d Cap相比于PCV2a Cap,有23个氨基酸残基突变,造成抗原表位构象改变,可能导致PCV2病毒粒子逃避宿主的免疫清除[28],但其并未通过体内试验证明该假设。在本研究中,作者比对了XY2022 Cap和PCV2b Cap之间的抗原表位差异,发现XY2022 Cap存在多个高变异度区域,分别是47—78、130—136和185—210位aa,并且线性免疫优势区的68位aa由A突变为N、134位aa由T突变为N,构象中和表位的63位aa由S突变为R,这些可能是造成不同基因型PCV2之间保护力差异的关键位点。因此,作者通过原核表达系统表达了含有差异位点的XY2022(2 d)Cap和WH(2b)Cap,并通过免疫小鼠制备相应阳性血清。通过IFA和qPCR试验评估血清的中和效价和抗病毒感染效果,发现2b和2d亚型PCV2的Cap均能有效刺激小鼠机体产生抗PCV2感染的中和抗体,但两者诱导中和抗体的水平稍有差异,XY2022 Cap诱导的中和抗体水平相对稳定,说明2b Cap和2 d Cap抗原表位的氨基酸差异并不能显著改变血清中和抗体水平,提示现有基于PCV2a和2b亚型的疫苗仍能有效抵抗PCV2流行毒株感染,但PCV2d疫苗具有更好的临床应用效果。持续分离流行毒株,研究其致病力和免疫原性,仍旧是未来防控PCV2相关疾病的关键。
4 结 论
本研究发现PCV2是导致湖北省某规模猪场PMWS的病原,并成功分离该毒株,将其命名为XY2022(GenBank登录号:OM249965.1);XY2022属于PCV2d,相较于其他基因型毒株,其Cap的线性免疫优势区、线性中和表位和构象中和表位均存在差异位点;XY2022 Cap和WH(2b) Cap均能诱导小鼠产生抗PCV2感染的中和抗体,且XY2022 Cap诱导的中和抗体水平更稳定。
