鸡胚心脏组织转录组数据鉴定雪域白鸡高原低氧适应性关键基因
2023-10-29陈雪娇刘会杰
陈雪娇,刘会杰,臧 蕾,冯 静,鹏 达*,张 浩*
(1.西藏自治区农牧科学院畜牧兽医研究所,拉萨 850009;2.中国农业大学动物科学技术学院,高原畜禽遗传资源研究中心,北京 100193))
雪域白鸡,原名拉萨白鸡,于2020年通过国家畜禽遗传资源委员会新品种审定,并正式命名为“雪域白鸡”。雪域白鸡是由白来航鸡和藏鸡杂交选育而来,兼具藏鸡的高原适应性和白来航的高产蛋性能,属于高海拔地区轻型良种蛋鸡品种[1],为西藏养鸡业带来了较高的经济效益。低氧适应研究一直深受人们的关注。有关低氧感应过程的研究成果获得了2019年的诺贝尔医学或生理学奖。低氧与人类的一些疾病紧密相关,例如心脑血管疾病、缺血性损伤、高原反应等[2-3],还是肿瘤微环境的重要指标[4]。世居青藏高原等高海拔地区的人类和动物,经过多年的自然选择和遗传变异,形成了独特的生理特征,能够耐受高寒、低氧、低压的环境[5-6]。
鸟类的生殖方式是卵生,胚胎体外发育,对氧气含量的变化非常敏感[7]。已有研究证明,胚胎期是低氧适应的关键时期[8]。雪域白鸡经过多年的选育,已经适应了高原低氧的环境,在海拔3 780 m的环境条件下受精蛋孵化率高达81.33%,而北京油鸡仅为1.00%[9]。心脏是鸡胚适应低氧环境的关键器官,低海拔鸡种在受到低氧刺激时,心脏发育异常,心室壁变薄,心室容积增大,不利于泵血,而青藏高原本土鸡种藏鸡的心脏发育正常[10-11]。本研究选取低海拔鸡种白来航鸡作为对照,将种蛋在高海拔地区(西藏拉萨)进行孵化,采集孵化第16天的鸡胚心脏组织进行转录组测序,鉴定雪域白鸡适应高原低氧环境的关键基因及其调控途径。
1 材料与方法
1.1 试验材料
白来航和雪域白鸡的种蛋均在西藏拉萨(平均海拔高度3 650 m)进行孵化,温度37.8 ℃,相对湿度55%,每天翻蛋12次。选取孵化第16天的白来航鸡胚10个(WL-D16, n=10)和雪域白鸡胚10个(XYW-D16, n=10),采集心脏组织,迅速放置于液氮速冻,然后置于-80 ℃冰箱进行保存。
1.2 总RNA提取及质控
取适量心脏组织,研磨棒研磨后,使用Trizol法提取鸡胚心脏总RNA,微量分光光度计NanoDrop 2000 (Thermo,美国)检测其OD260 nm/OD280 nm值鉴定RNA样品浓度。使用Agient2100/LabChip GX检测RNA的完整性。
1.3 文库构建及测序
样品检测合格后,进行文库构建,每组测序文库设3个生物学重复。用带有Oligo(dT)的磁珠富集mRNA;加入Fragmentation Buffer将mRNA进行随机打断;以mRNA为模板,合成第一条cDNA链及二链,并进行cDNA纯化;对纯化的双链cDNA进行末端修复、加A尾,并连接测序接头;然后用AMPure XP beads选择380 bp左右的片段;最后通过PCR得到cDNA测序文库。使用Qubit 3.0 荧光定量仪库对文库进行初步定量,浓度需达到1 ng·μL-1以上,随后用Qsep400高通量分析系统对文库的插入片段进行检测。文库质检合格后,使用Illumina Nova Seq6000测序平台进行PE150模式测序。
1.4 测序数据处理及差异表达基因筛选
对原始数据进行质控,去除含有接头和低质量的reads得到clean reads。使用HISAT2软件将clean reads与参考基因组进行快速精确的比对。利用Stringtie 对mapped reads进行组装和定量,采用FPKM (fragments per kilobase of transcript per Million fragments mapped)进行标准化[12],斯皮尔曼相关系数r (Spearman′s correlation coefficient)作为评估样本间基因表达重复性的指标。以白来航为对照组,采用DESeq2进行基因表达量差异分析[13],将Fold Change≥2且FDR<0.05 作为筛选标准。
1.5 差异表达基因的功能分析
对筛选到的DEGs进行功能富集分析,Gene Ontology(GO)在百迈克在线网站(https:∥international.biocloud.net/)完成,KEGG(Kyoto Encyclopedia of Genes and Genomes)通路分析使用KOBAS在线网站(http:∥bioinfo.org/kobas/)完成。使用R包ggplot2进行GO和KEGG富集分析可视化。
1.6 转录因子筛选和靶基因预测
在线网站AnimalTFDB(http:∥bioinfo.life.hust.edu.cn/AnimalTFDB4/#/)可下载鸡的转录因子(TF)列表,与筛选的DEGs进行对比,找到测序数据中差异表达的转录因子。在线网站JASPAR(https:∥jaspar.genereg.net/)下载转录因子的基序(motif),选定DEGs转录起始位点(transcription start site,TSS )上游5 000 bp为启动子序列,最后在MEME(https:∥meme-suite.org/meme/doc/meme.html)网站对基序和启动子序列进行靶向预测,建立TF-targets网络。
1.7 实时荧光定量PCR(qRT-PCR)验证
选取5个DEGs,肌动蛋白γ2(actin γ2,ACTG2)、钾钙激活通道亚家族 M α1(potassium calcium-activated channel subfamily M α1,KCNMA1)、叉头框P2(forkhead box P2,FOXP2)、同源框A2(homeobox A2,HOXA2)、肌动蛋白 α2 (actin α2,ACTA2),在NCBI网站设计引物(表1),引物由生工生物工程(上海)股份有限公司合成。选取GAPDH为内参基因,对白来航鸡和雪域白鸡样本进行qRT-PCR验证,以检测测序结果及数据分析的准确性。采用2-ΔΔCT法计算基因相对表达量。采用GraphPad Prism 9.5.1软件作图。

表1 qRT-PCR引物
2 结 果
2.1 转录组数据
白来航和雪域白鸡共6个样品的转录组测序数据经过质量控制,共得到38.53 Gb clean data,每个样品的clean data 均达到了5.97 Gb及以上,Q30碱基百分比在92.85%及以上。将clean reads与鸡参考基因组CRCg7b进行比对,比对率在92.01%到93.64%之间(表2)。在白来航和雪域白鸡胚胎心脏组织中共鉴定20 291个阳性表达基因,其中共同表达的基因18 258个。
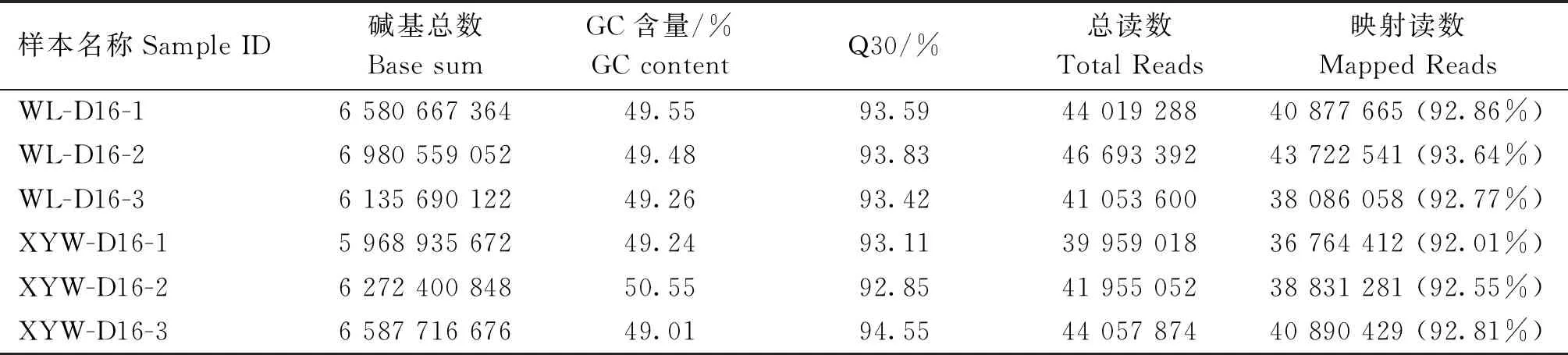
表2 测序样品与参考基因组的序列比对
2.2 差异表达基因及功能分析
白来航与雪域白鸡胚胎心肌组织中筛选到253个DEGs,其中在雪域白鸡中122个基因显著上调,131个基因显著下调(图1)。差异表达的253个基因主要富集于心肌组织发育调节、心肌细胞增殖、

灰色是表达差异不显著的基因;红色是表达上调的基因;蓝色是表达下调的基因Non-differentially expressed genes are showed in grey color; red show upregulated genes; blue show downregulated genes图1 差异表达基因的火山图Fig.1 Volcanic map of differentially expressed genes
心肌组织生长、肌原纤维、细胞外基质、苹果酸脱氢酶(脱羧)(NADP+)活性、MAP激酶磷酸酶活性、钙释放通道活性和钙离子结合等GO 条目(图2)。
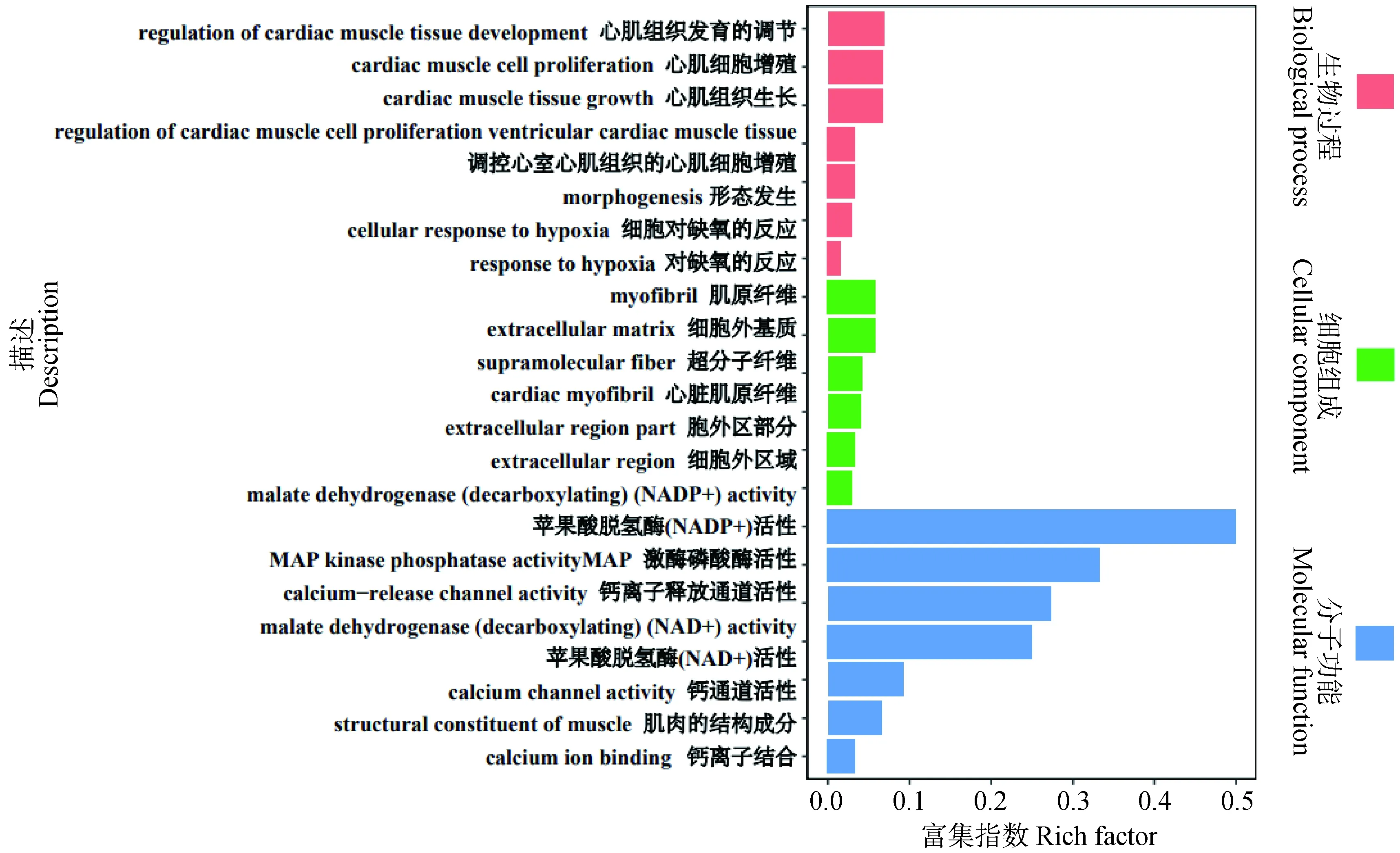
图2 差异表达基因的GO功能注释Fig.2 GO functional annotation of differentially expressed genes
利用KOBAS数据库分析DEGs功能,发现它们(TENM2、NOG、SMOC1、CCBE1、END2、ACTG2、和MMP2等)主要参与血管平滑肌收缩、MAPK信号通路、血管内皮生长因子信号通路和心肌收缩等途径,这些途径可能参与心脏形态发生和功能。此外DUSP5、UPB1、LPIN2、PLA2G4A和PDGFC等差异表达基因还参与多种代谢途径,包括淀粉和蔗糖代谢、泛酸和辅酶A的生物合成以及甘油磷脂代谢等(图3),这些能量代谢途径可能为机体生存和心脏起搏提供能量。

图3 差异表达基因的KEGG通路富集分析Fig.3 KEGG pathway enrichment analysis of differentially expressed genes
2.3 转录因子筛选和靶基因网络构建
经过筛选,差异表达基因中含有2个转录因子,分别是FOXP2和HOXA2。由于motif的每个位点碱基分布频率不同,转录因子和靶基因可能存在一个或多个结合位点(表3)。通过将motif与启动子序列比对,构建了转录因子与靶基因网络(图4),值得注意的是,其中一些靶基因(MMP2、ACTA2、ACTG2和KCNMA1等)的功能富集在血管内皮生长因子信号通路、应对低氧和血管生成等途径,提示与心脏发育和功能有关(图5)。

红色三角形代表转录因子;蓝色方形代表靶基因(差异表达基因)The red triangles represent transcription factors; The blue squares represent target genes (DEGs)图4 转录因子-靶基因预测网络Fig.4 Transcription factor-target gene prediction network

蓝色圆形代表转录因子;绿色三角形代表靶基因(差异表达基因);橙色方形代表通路Blue circles represent transcription factors; Green triangles represent target genes (DEGs); The orange squares represent the pathways图5 转录因子与部分靶基因及通路预测网络Fig.5 Transcription factors and partial target genes and pathways prediction network
2.4 差异表达基因验证
选取5个差异表达基因,取白来航和雪域白鸡样品进行 qRT-PCR 分析,通过 log2(fold change)对差异倍数进行转换。结果如图6所示,qRT-PCR结果与RNA-seq测序结果表达趋势一致,表明转录组测序结果的真实性和准确性。

图6 qRT-PCR基因表达量结果Fig.6 qRT-PCR gene expression results
3 讨 论
氧气是决定胚胎正常发育的关键因素之一,包括心脏发生[14]。心脏发生是一个复杂而精妙的过程,很容易受到自身基因表达变化和外界环境因素的影响而发育异常[15-16]。有研究指出,胎儿在母体子宫内的异常缺氧会对心脏发育产生不利影响,改变心肌结构,导致心功能下降[17]。长期暴露于高海拔地区提高了牦牛对低氧的生理反应,较大的心脏有利于它们适应低氧环境[18]。低氧孵化第16天的藏鸡胚胎心脏组织表达谱显示,藏鸡与低地鸡种差异表达基因主要为FGFR1、CTGF、ADAM9、JPH2、SATB1、BMP4和HYAL1等,这些基因可能参与心肺系统发育[19]。本研究对高海拔孵化第16天的白来航鸡和雪域白鸡胚胎心脏组织进行基因表达谱分析,鉴定出的差异表达基因主要为TENM2、NOG、SMOC1、CCBE1、END2、ACTG2、和MMP2等,这些基因富集在心脏发育和血管发育等通路。这些结果表明,鉴定到的差异基因可能参与鸡胚心血管发育和功能,是研究雪域白鸡适应低氧环境的候选基因。
氧气与能量代谢有紧密的关系,机体生存和运动都离不开ATP供能,而ATP的产生依赖于氧气参与的氧化磷酸化[20]。因此当机体处于低氧环境时,能量代谢也会受到影响。先前的研究将高海拔地区的代谢适应归因于肌肉氧化能力的降低,其中乳酸脱氢酶(LDH)是厌氧糖酵解的关键酶,催化丙酮酸和乳酸之间的转化,在能量代谢过程中起关键作用[21]。高原牦牛背最长肌中的LDH活性较高,能利用有限的氧气促进碳水化合物的利用从而释放能量[18]。还原性辅酶NADH在生化代谢反应中发挥重要作用,例如糖酵解和三羧酸循环等[22]。本研究鉴定的差异表达基因(DUSP5、UPB1、LPIN2、PLA2G4A和PDGFC等)也在能量代谢途径有富集,包括苹果酸脱氢酶(NAD+)活性和丙酮酸代谢等。表明能量代谢方面的差异可能是雪域白鸡适应低氧环境的原因。
转录因子指能够以序列特异性方式结合DNA并且调节转录的蛋白质[23]。转录因子与特异性DNA结合通常概括为“基序”(motif),可用于扫描较长序列(例如启动子)以鉴定潜在的结合位点,转录因子在基因的启动子区有一个或多个结合位点[24]。转录因子与启动子结合,招募RNA聚合酶或其他因子,促进或者抑制基因的转录,从而调控生物功能[25]。低氧研究的明星基因HIF-1α,作为转录因子激活调控的靶基因表达[26-28]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是HIF的靶基因,具有促进血管通透性增加、细胞外基质变性、血管内皮细胞迁移、增殖和血管形成等作用,缺氧条件下HIF-1可以调节VEGF的表达[29-30]。本研究鉴定了2个重要的转录因子FOXP2 和HOXA2,可以靶向调控KCNMA1、CACNG4、SCN4B、WNT2B、MMP2、CCBE1、ACTG2、ACTA2、PLA2G4A和TENM2等基因表达。其中MMP2属于基质金属蛋白酶家族,低氧可以刺激MMP2的表达上调[31],参与多种生物学功能过程,包括血管平滑肌生长、增殖、迁移、松弛、血管生成和细胞凋亡等,与心血管发育密切相关[32-34]。ACTA2基因编码 α-平滑肌肌动蛋白,通常在促进血管运动和收缩的血管平滑肌细胞中表达,参与血管收缩和血压稳态[35-36]。这些基因的功能均与心血管发育相关,参与心脏发育和功能相关通路。因此,本研究认为在低氧适应过程中,这些转录因子可能通过调控靶基因的转录表达而发挥作用,保证雪域白鸡胚胎期心脏正常发育,泵血功能正常,从而适应低氧环境。
4 结 论
雪域白鸡是西藏自主培育的品种,本研究通过高海拔孵化的鸡胚心脏转录组测序,发现了差异表达基因富集在心脏发育、血管发育和能量代谢途径,鉴定了转录因子FOXP2 和HOXA2,它们可能通过调控靶基因的表达参与血管生成和心肌收缩等途径,为进一步研究鸡高原低氧适应分子机制提供了基础。
