猪巴氏杆菌和波氏杆菌双重PCR 检测方法的建立
2023-10-28徐翔飞黄盼崔雪梅黄叶娥季权安韦强李科宋厚辉鲍国连刘燕
徐翔飞, 黄盼, 崔雪梅, 黄叶娥, 季权安, 韦强, 李科, 宋厚辉, 鲍国连*, 刘燕*
(1.浙江农林大学 动物科技学院 动物医学院, 浙江 杭州 311300; 2.浙江省农业科学院 畜牧兽医研究所, 浙江 杭州 310021)
猪多杀性巴氏杆菌 (Pasteurellamultocida,Pm) 属于革兰氏阴性菌, 大小约为0.3 μm ×0.2 μm。猪感染后可导致猪肺疫, 是猪常见的传染性呼吸道疾病, 传播途径为机械性传播, 可引起出血性败血症, 发病后无症状, 迅速死亡。Pm 易被杀死, 在消毒剂或太阳下迅速死亡, 一般情况下, Pm 寄生于呼吸道黏膜和尿道黏膜, 并不会致病, 在宿主免疫力降低时, Pm 就可以感染并致病[1-3]。波 氏 杆 菌 (Bordetellabrcmchiseptica, Bb)又称支气管败血性巴氏杆菌, 是造成猪萎缩性鼻炎(atrophic rhinitis of swine, AR) 的主要细菌, 是一种革兰氏阴性菌, 无芽孢、鞭毛, 需氧菌, 大小为0.5 μm×2 μm。波氏杆菌的主要毒力因子为丝状血凝素 (filamentous hemagglutinin, FHA)、百日咳杆菌黏附素 (pertactin)、菌毛 (fimbriae) 等。根据Bb 的抗原性, 生长特性等可将其分为3 种菌相。传播途径为空气、接触、排泄物等传播。Bb 可存在于呼吸道黏膜, 一般不发病, 在免疫力降低时会导致发病, 在上呼吸道和肺脏感染, 引起出血性败血症, 感 染 后 鼻 出 血 不 止、呼 吸 困 难、打 鼾等[4-6]。巴氏杆菌和波氏杆菌均属呼吸道感染常见病原菌, 且二者常混合感染, 病症相似, 严重影响我国养猪业的发展, 而常用的检测方法速度慢, 灵敏度低, 贻误疾病的治疗与防疫, 因此, 建立巴氏杆菌和波氏杆菌和2 者混合感染的检测方法具有重要意义。
本文根据巴氏杆菌和波氏杆菌保守序列16S rRNA 基因为靶基因设计了2 对引物, 建立了快速诊断巴氏杆菌、波氏杆菌和混合感染的双重PCR诊断方法。
1 材料与方法
1.1 实验菌株
实验所用链球菌、大肠埃希菌、沙门氏菌、巴氏杆菌及副猪嗜血杆菌从中国兽医微生物菌种保藏管 理 中 心 ( China Veterinary Culture Collection Center, CVCC) 购买, 胸膜肺炎放线球菌、波氏杆菌为本实验室保存菌株。
1.2 主要试剂
DL 2 000 DNA Marker 购自宝日医生物技术(北京) 有限公司; GreenTapMix 酶购自南京诺唯赞生物科技股份有限公司; 胰蛋白胨大豆琼脂(tryptic soy agar, TSA)、胰 蛋 白 胨 大 豆 肉 汤(tryptic soy broth, TSB) 等培养基购自赛默飞公司。犊牛血清购自浙江天杭生物科技有限公司。烟酰胺腺嘌呤二核苷酸 (NAD) 购自北京索莱宝科技有限公司。
1.3 引物的设计与合成
在NCBI 上分别下载巴氏杆菌和波氏杆菌保守序列16S 基因, 应用Primer 3.0 Plus 软件在线设计2 对引物, 巴氏杆菌引物核苷酸序列为: P1, 5′-ACGGGTGAGTAATGCTTGGG-3′; P2, 5′-GCAGGC TTGGTAGGCCTTTA-3′, 扩增片段大小为172 bp;波氏杆菌引物核苷酸序列为: P3, 5′-CGGGGGATAACTACGCGAAA-3′; P4, 5′-ACACAC TCTAGCCCGGTAGT-3′, 扩增片段大小为519 bp,引物由苏州金唯智生物科技有限公司合成。
1.4 模板的制备
将保存的菌株复苏, 37 ℃培养过夜的菌液,取1 mL 和400 μL 裂解液和蛋白酶K 8 μL 混合,金属浴56 ℃ 40 min, 再将温度调到100 ℃, 温度达到100 ℃时, 再持续10 min, 待温度降到室温取出, 放4 ℃保存。作为模板, 将巴氏杆菌和波氏杆菌菌液混合培养作为双重PCR 模板[7]。
1.5 PCR 扩增
设计引物时的退火温度, 初步建立分别扩增巴氏杆菌和波氏杆菌的反应程序: 95 ℃ 5 min;95 ℃ 30 s, 72 ℃ 30 s, 30 个循环, 72 ℃ 10 min,扩增产物保存于4 ℃。采用50 μL 扩增体系。PCR扩增结束后, 1%琼脂糖凝胶电泳, 在紫外发光凝胶成像系统下观察结果。
1.6 PCR 扩增产物的测序和比对
分别将巴氏杆菌和波氏杆菌PCR 扩增产物纯化后送浙江尚亚生物有限公司进行测序, 并对测序结果再次进行BLAST 比对。
1.7 PCR 条件优化
根据1.5 节中的扩增条件为基础, 保持单一变量, 进行PCR 的扩增, 退火温度设为50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70 ℃; 引物 浓度设为0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 μL; 退火时间设为10、20、30、40、50、60、90 s, 筛选2 个PCR 的最佳扩增条件和反应程序。
1.8 巴氏杆菌和波氏杆菌PCR 的特异性检验
根据1.7 节中优化后的条件, 分别扩增巴氏杆菌、波氏杆菌、大肠埃希菌、沙门氏菌、产气荚膜梭菌、链球菌、胸膜肺炎放线球菌以检验单一PCR 的特异性。
1.9 巴氏杆菌和波氏杆菌双重PCR 条件优化
以1.8 节中优化后的PCR 为基础, 建立巴氏杆菌和波氏杆菌的双重PCR, 保持单一变量对,双重PCR 条件进行优化, Pm+Bb 引物浓度设为:1 μL+1 μL、1.5 μL+1.5 μL、1 μL+1.5 μL、1.5 μL+1 μL, 退火温度设置梯度50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70 ℃, 延伸时间: 10、20、30、40、50、60 s。筛选双重PCR 的最佳扩增条件和反应程序。
1.10 巴氏杆菌和波氏杆菌双重PCR 特异性检验
根据上述1.9 节中优化后的双重PCR, 用巴氏杆菌和波氏杆菌的双重PCR 检验巴氏杆菌和波氏杆菌混合物、副猪嗜血杆菌、产气荚膜梭菌、大肠埃希菌、沙门氏菌、链球菌以检验双重PCR 的特异性。
1.11 巴氏杆菌和波氏杆菌双重PCR 产物测序及比对
将巴氏杆菌和波氏杆菌双重PCR 产物送至浙江尚亚生物有限公司测序, 测序结果进行BLAST比对。
1.12 巴氏杆菌和波氏杆菌双重PCR 重复性实验
用同一模板扩增3 次, 以此验证巴氏杆菌和波氏杆菌双重PCR 的重复性效果。
1.13 巴氏杆菌和波氏杆菌双重PCR 方法的临床应用
采集来自浙江不同猪场送检的病料, 对63 例呼吸道症状的病猪的鼻拭子和肺脏进行细菌分离鉴定, 并用建立的巴氏杆菌和波氏杆菌双重PCR 检测方法和PCR 引物同时进行扩增, 统计检测结果,比较2 种检测方法的一致性。
2 结果与分析
2.1 PCR 扩增结果
分别用对应引物扩增巴氏杆菌和波氏杆菌, 扩增产物经1.5%琼脂糖凝胶电泳后, 利用紫外发光凝胶成像系统记录结果, 结果如图1 所示, 实验结果与预期相同。

图1 巴氏杆菌和波氏杆菌PCR 扩增结果
2.2 PCR 扩增产物的测序和比对
分别将巴氏杆菌和波氏杆菌PCR 扩增产物纯化后送浙江尚亚生物有限公司进行测序, 并对测序结果再次进行BLAST 比对, 结果如表1 所示。
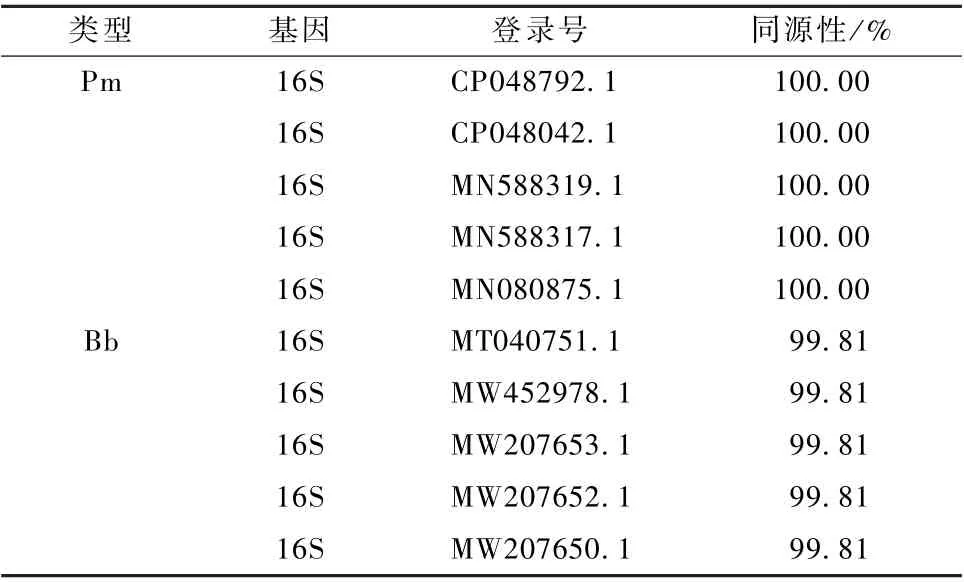
表1 PCR 扩增结果在NCBI 比对结果
2.3 PCR 反应的最佳条件
通过单一变量的原则, 分别进行PCR 扩增,Pm-PCR 退火温度控制在50~66 ℃, 退火时间设在20~60 s, 引物浓度添加量在1.0~2.0 μL 均能扩出目标条带 (图2 中A、B、C); Bb-PCR 退火温度控制在50~67 ℃, 退火时间设在20~60 s, 引物浓度添加量在0.6~2.0 μL 均能扩出目标条带(图3 中A、B、C)。
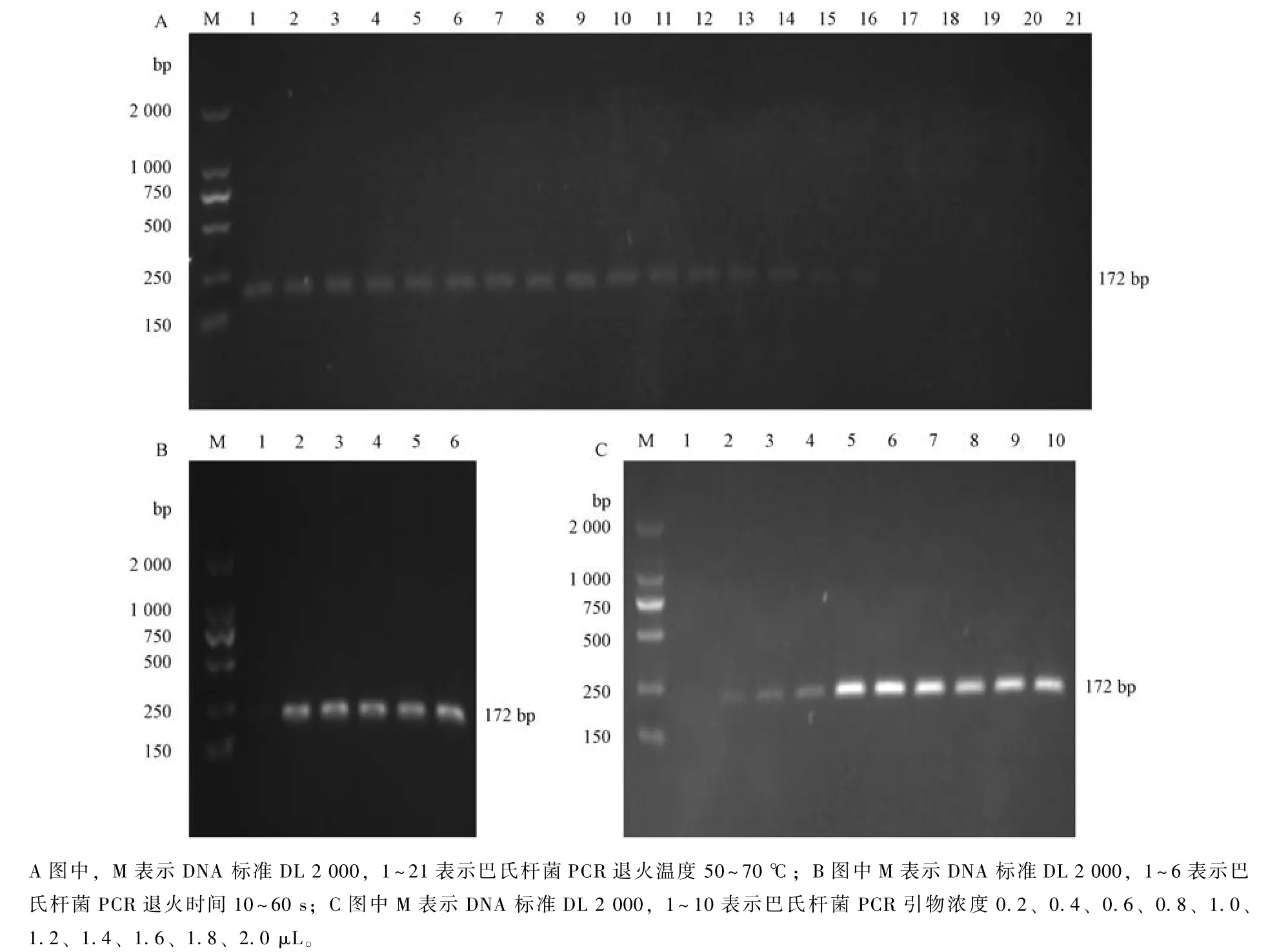
图2 巴氏杆菌PCR 扩增条件优化

图3 波氏杆菌PCR 扩增条件优化
2.4 巴氏杆菌和波氏杆菌PCR 的特异性检验
用优化后的巴氏杆菌和波氏杆菌PCR 分别扩增巴氏杆菌、波氏杆菌、大肠埃希菌、沙门氏菌、副猪嗜血杆菌、产气荚膜梭菌、链球菌, 以此分别检验巴氏杆菌和波氏杆菌PCR 的特异性。除所需检验的目标片段能扩出特异性条带, 其他菌检测结果均为阴性 (图4)。
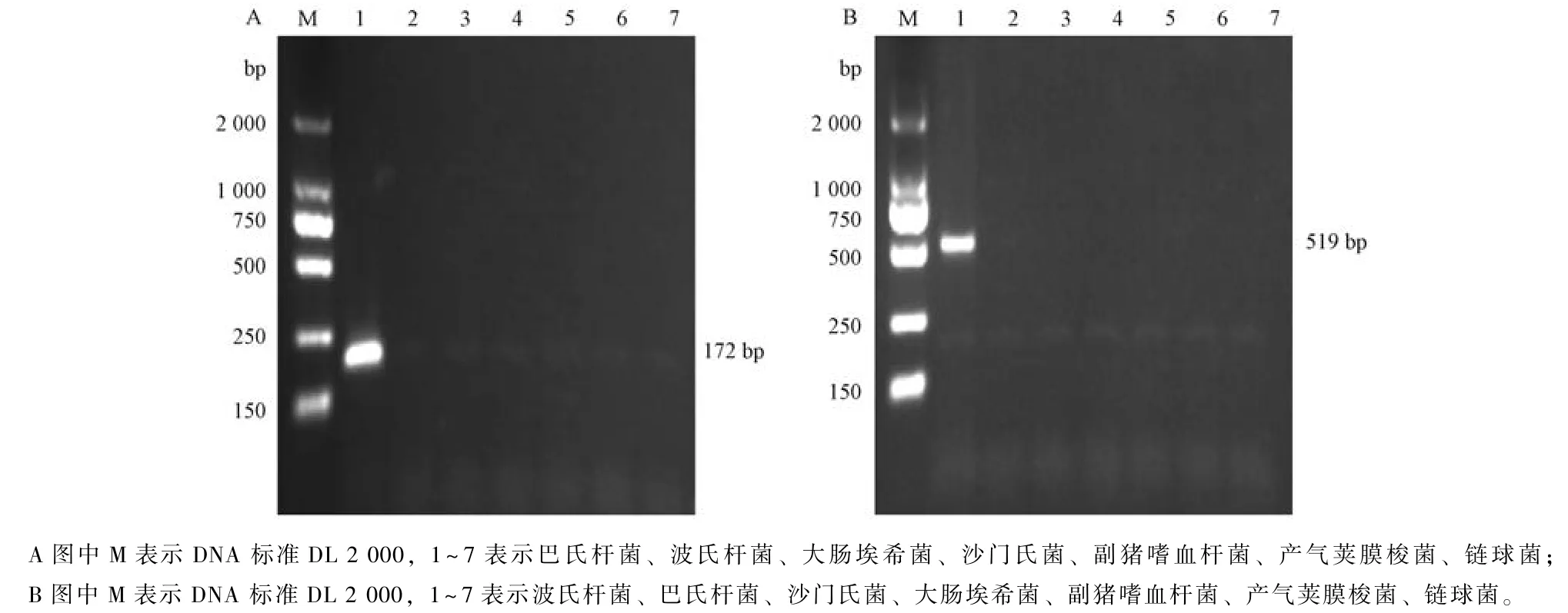
图4 巴氏杆菌和波氏杆菌PCR 特异性检验
2.5 巴氏杆菌和波氏杆菌双重PCR 条件优化
以2.4 节中优化后的PCR 为基础, 建立巴氏杆菌和波氏杆菌的双重PCR, 保持单一变量对, 双重PCR 条件进行优化, 结果显示, 退火温度控制在50~64 ℃时, 双重PCR 2 条目标条带均能扩出,65~67 ℃时仅波氏杆菌可以扩出条带, 退火时间设在10~60 s 均能扩出2 条清晰条带, 引物浓度添加量在1 μL+1 μL、1.5 μL+1.5 μL、1 μL+1.5 μL、1.5 μL+1 μL 均能扩出2 条目标条带(图5)。
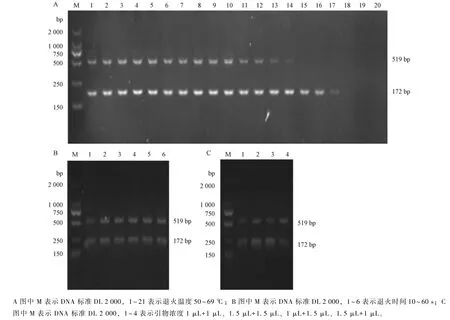
图5 巴氏杆菌+波氏杆菌双重PCR 条件优化
2.6 巴氏杆菌和波氏杆菌双重PCR 特异性检验
用2.5 节中优化后的巴氏杆菌和波氏杆菌的双重PCR 检验巴氏杆菌和波氏杆菌混合物、巴氏杆菌、波氏杆菌、副猪嗜血杆菌、产气荚膜梭菌、大肠埃希菌、沙门氏菌、链球菌以检验双重PCR 的特异性。结果与预期相同 (图6)
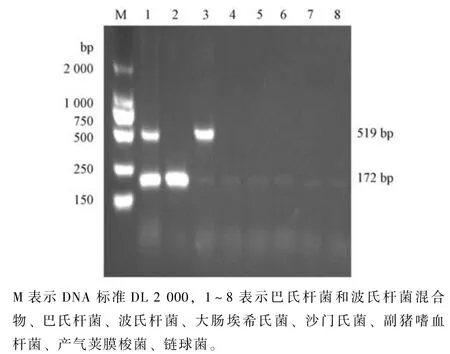
图6 巴氏杆菌+波氏杆菌双重PCR 特异性检验
2.7 巴氏杆菌和波氏杆菌双重PCR 产物测序及比对
将巴氏杆菌和波氏杆菌双重PCR 扩增产物送至浙江尚亚生物有限公司测序, 将测序结果进行BLAST 比对, 与相应基因进行比对, 结果显示与原基因相似度高 (表2)。
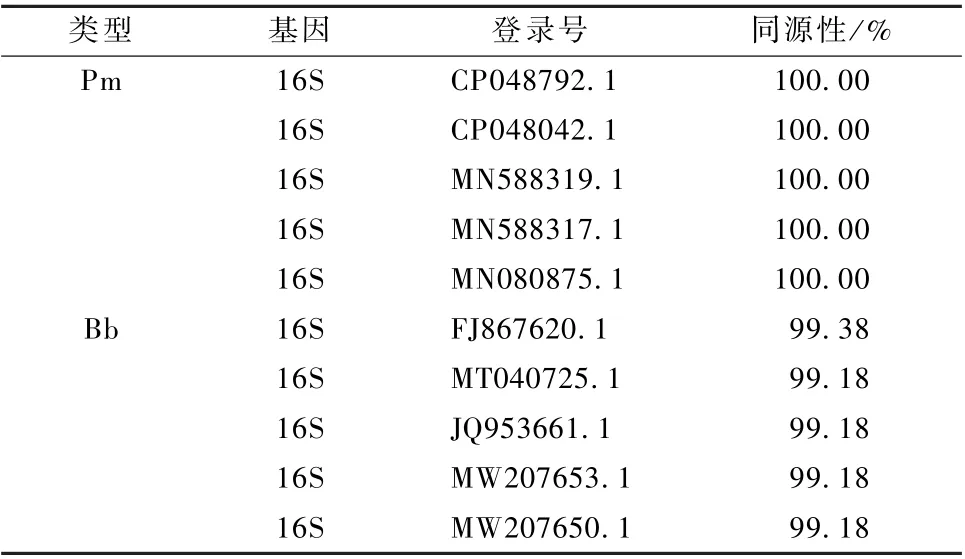
表2 双重PCR 扩增结果在NCBI 比对结果
2.8 巴氏杆菌和波氏杆菌双重PCR 重复性实验
用同一模板扩增3 次, 以此验证巴氏杆菌和波氏杆菌双重PCR 的重复性效果, 结果表明, 该方法重复性较好 (图7)。
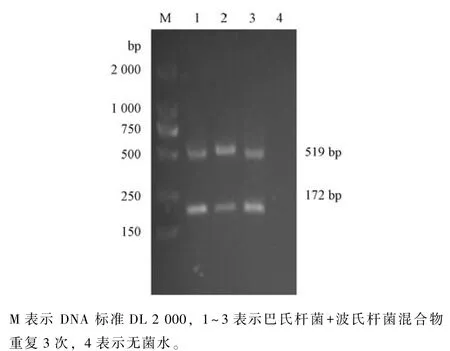
图7 巴氏杆菌+波氏杆菌双重PCR 重复性实验
2.9 巴氏杆菌和波氏杆菌双重PCR 方法的临床应用
对63 例呼吸道症状的病猪的鼻拭子和肺脏进行细菌分离, 其中10 份样品检测出巴氏杆菌, 8份样品检测出波氏杆菌, 2 份为巴氏杆菌和波氏杆菌混合感染。用Lichtensteiger 等[8]和Hozbor 等[9]建立的PCR 检测方法同样检测出10 份样品为巴氏杆菌, 8 份样品为波氏杆菌, 2 份为巴氏杆菌和波氏杆菌混合感染, 与其符合率为100% (图8)。
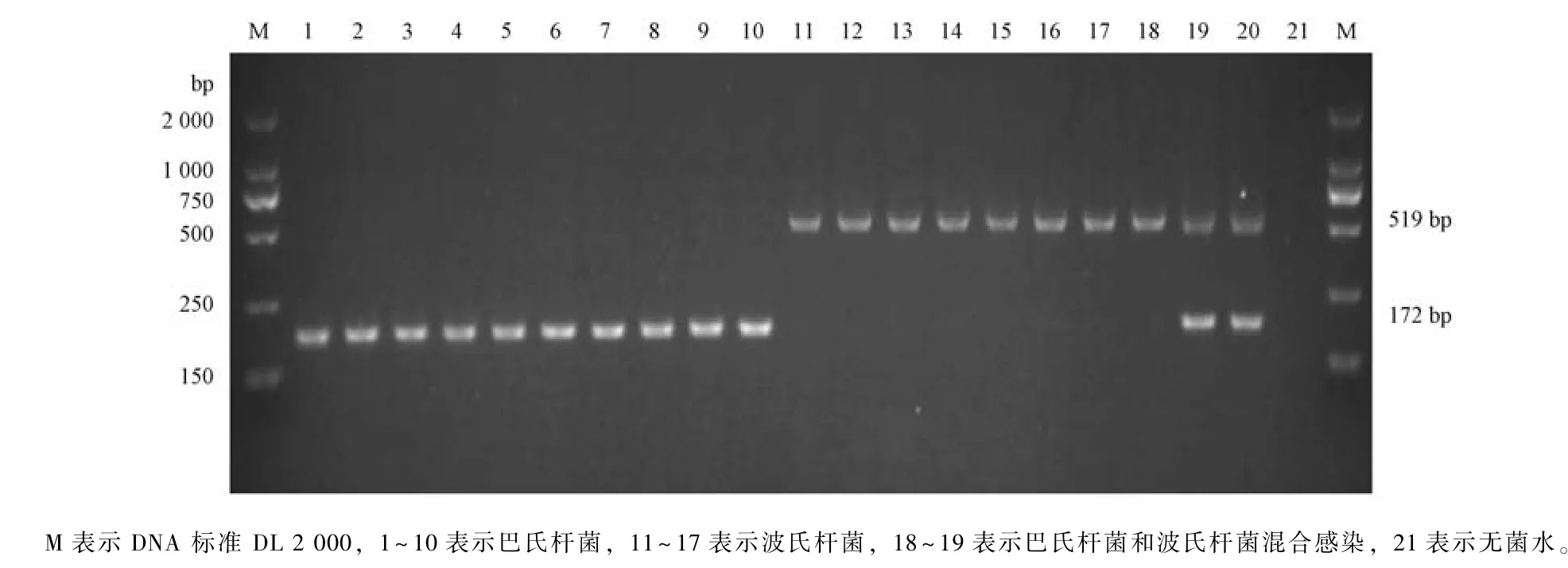
图8 巴氏杆菌和波氏杆菌双重PCR 的临床应用
3 讨论
巴氏杆菌和波氏杆菌均为引起猪呼吸道病综合征 (PRDC) 的细菌性病原, 均可引发其他呼吸道病原菌的原发性或继发性感染, 同时二者常混合感染, 不仅增加了病原菌的危害程度, 也给疾病的检测和诊断工作增加了难度[10-11]。巴氏杆菌和波氏杆菌检测方法中细菌分离为最常用的检测方法, 准确率高, 是指导临床用药的重要手段, 但该方法实验周期长, 培养过程易污染, 故该方法不适用于检测初期[1,12]。随着免疫学的发展, 血清学诊断方法理论上特异性好, 检测速度快, 如依靠抗原抗体之间的特异性反应的酶联免疫吸附 (ELISA) 检测方法, 该方法的检测时间短, 灵敏度高, 特异性好。但该方法只能检测体内抗体水平, 并不能判断为野生毒株感染, 同时抗体一般在野生毒株感染一段时间以后才会产生[13-14]。故该方法在检测巴氏杆菌和波氏杆菌感染方面具有局限性。PCR (聚合酶链式反应) 检测方法作为细菌检测最常用的手段,重复循环高温变性、低温退火、中温延伸3 过程,每个循环需1~4 min, 目标基因指数增加, 1~2 h便可将目的片段扩大几百万倍, 故该方法速度快,灵敏度高[15]。
本文根据巴氏杆菌和波氏杆菌保守序列16S rRNA 基因为靶基因, 应用 Primer 3.0 Plus 软件设计了2 对引物, 并进行BLAST 分析引物特异性,巴氏杆菌引物可扩出172 bp 的目标片段, 波氏杆菌引物可扩出519 bp 的目标片段。对巴氏杆菌和波氏杆菌PCR 条件进行优化, 并将单一PCR 扩增产物送测序, 测序结果进行BLAST 比对, 结果显示单一PCR 与原基因相似度很高。对单一PCR 进行特异性检验, 结果显示, 仅所需检测的目标菌株呈阳性, 其他菌株扩增均呈阴性, 说明单一PCR的特异性较好。将两个单一PCR 合并为巴氏杆菌和波氏杆菌双重PCR, 对双重PCR 扩增条件和反应程序进行优化, 将双重PCR 产物送测序, 结果显示, 双重PCR 产物序列与原基因相似度很高。对双重PCR 进行特异性检验, 巴氏杆菌和波氏杆菌混合菌株、巴氏杆菌、波氏杆菌均呈阳性, 副猪嗜血杆菌、产气荚膜梭菌、大肠埃希菌、沙门氏菌、链球菌均为阴性, 说明双重PCR 特异性较好。将该结果与已报道的PCR 方法比较, 符合率为100%, 表明本方法准确率较高, 有良好的临床应用价值, 期望该方法有利于巴氏杆菌和波氏杆菌病发生时进行快速诊断和流行病学调查。
