经微生物发酵前处理的灵芝活性成分提取工艺研究
2023-10-28吴雨来徐甄费思瑜卢媛田可欣杨梓豪刘赟霄刘兵李加友
吴雨来, 徐甄, 费思瑜, 卢媛, 田可欣, 杨梓豪, 刘赟霄, 刘兵, 李加友
(1.嘉兴学院 生物与化学工程学院, 浙江 嘉兴 314001; 2.海东市农业农村局, 青海 海东 810600)
灵芝(Ganodermalucidum), 又称莎草, 是真菌门担子菌亚门多孔菌目灵芝菌科灵芝属药食两用真菌[1]。研究表明, 灵芝中含有多糖、三萜、生物碱、氨基酸及有机锗等多种活性成分, 具有抗氧化、抗肿瘤、免疫调节、保肝护肝等生物学功效[2-5]。但是, 灵芝子实体结构致密, 外层菌丝中充满树脂,导致活性物质释放困难[6]。因此, 灵芝活性成分的提取方法成为国内外研究的热点。溶剂浸煮法[7-8]只能使细胞胞质皱缩, 细胞壁没有破损, 活性成分难以释放, 提取率低; 超声波辅助提取法[9-10]和微波辅助提取法[11-12], 使细胞壁出现微小孔洞, 提取率较溶剂浸提法略有提高, 但设备要求高、不利于生产; 超微粉碎技术辅助提取法[13-15]对提取率的提升作用最为显著, 但超微粉碎技术需要专用设备、处理成本高, 不适合大规模生产。
微生物发酵提取法[16-20]是利用微生物在生长过程中代谢产生具有破壁功能的复合生物酶系分解植物细胞壁, 从而使活性成分高效释出, 提高活性成分提取率。本论文选用特定微生物发酵对灵芝进行发酵前处理, 然后再通过溶剂浸煮法提取灵芝中多糖和三萜, 并对提取工艺进行了优化, 得到微生物发酵灵芝总多糖及三萜最佳提取工艺。用该最佳工艺条件提取同批次、同产地未经微生物发酵前处理的灵芝, 比较微生物发酵前处理对灵芝活性成分提取率的影响。
1 材料与仪器
1.1 材料
灵芝由青海雪芝隆生物科技有限公司提供, 试剂: 无水葡萄糖和齐墩果酸对照品购于阿拉丁试剂公司, 其余试剂均为市售分析纯或化学纯。
1.2 实验仪器
高压蒸汽灭菌锅 (上海申安医疗器械厂,LDZH-150KBS), 恒温水浴锅 (常州迈科诺仪器有限公司, WB-6), 恒温培养箱 (宁国沙鹰科学仪器有限公司, LRH-150), 鼓风干燥箱 (上海森信实验仪器有限公司, DGG-9150G), 紫外-可见分光光度计 (上海美谱达仪器有限公司, UV-1100 型),移液枪 (大龙兴创实验仪器 (北京) 股份公司,YE209AT0043015), 粉碎机 (带筛网) (北京中兴伟业仪器有限公司, FE220), 循环水式真空泵(巩义市予华仪器有限责任公司, SHZ-DⅢ)。
1.3 培养基
PDA 培养基: 土豆汁20 g (鲜土豆), 葡萄糖2 g, pH 值自然, 水100 mL。
2 实验方法
2.1 灵芝生物发酵
将康宁木霉LZ51 (Trichodermakoningii) 接种于液体PDA 培养基中, 于摇床中30 ℃振荡培养48 h。取灵芝粉末加水至含水量为50%, 于126 ℃高压蒸汽灭菌锅灭菌2 h, 取出放凉后加入10%上述菌液, 于恒温培养箱中28 ℃恒温培养108 h。发酵结束后, 平摊于不锈钢盘上, 烘箱60 ℃干燥24 h, 得到发酵灵芝。
2.2 发酵灵芝总多糖提取工艺考察
取2.1 节中所得发酵灵芝, 以水为提取剂, 以灵芝总多糖提取率为指标, 采用L9(34) 正交表进行试验, 考察提取时间、提取温度、提取剂用量对灵芝总多糖提取率的影响。各因素水平设计如表1。

表1 发酵灵芝总多糖提取工艺正交试验因素与水平
2.3 发酵灵芝三萜提取工艺考察
取2.1 节中所得发酵灵芝, 以无水乙醇为提取剂, 以灵芝三萜提取率为指标, 采用L9(34) 正交表进行试验, 考察提取时间、提取温度、提取剂用量对灵芝三萜提取率的影响。各因素水平设计如表2。

表2 发酵灵芝三萜提取工艺正交试验因素与水平
2.4 总多糖含量测定
2.4.1 标准曲线绘制
取无水葡萄糖对照品加水制成1 mL 含0.12 mg 的溶液, 为对照品溶液。分别取对照品溶液0.20、0.40、0.60、0.80、1.00、1.20 mL 置于10 mL 具塞试管中, 加水至2.00 mL, 迅速精密加入硫酸蒽酮溶液 (精密称定蒽酮0.10 g, 加浓硫酸100 mL, 使溶解, 摇匀) 6.00 mL, 立即摇匀, 放置15 min 后, 立即置于冰水浴中冷却15 min, 依次得浓度为0.003、0.006、0.009、0.012、0.015、0.018 mg·mL-1的对照品待测液。取2.00 mL 水加入6.00 mL 硫酸蒽酮溶液为空白溶液, 用紫外-可见分光光度计在625 nm 波长处测定吸光度, 以吸光度为纵坐标 (Y), 浓度为横坐标 (X) 绘制标准曲线。计算回归方程为Y= 0.681X+0.051,R2=0.999, 线性范围0.003~0.018 mg·mL-1, 线性关系良好。
2.4.2 样品总多糖提取
从图2来看,沙湾特色旅游小镇的自我就业者的收入与经营情况可观,收入挺好维持现状的商家高达79.17%,另外还有6.25%的商家还打算扩大经营,由此可见特色小镇的发展给了自我就业者就业的机会和较大的收益。但由6.25%的另谋职业的与8.33%的放弃回家去别的地方寻机会的自我就业者可知,获益群体仅仅针对本地的自我就业者。究其一个原因是62.5%的商家是拥有相关的技术自我就业的,如自家制作当地美食“姜埋奶”、当地人制作的手工艺品,相反,当地非技术类型商家收入并不多甚至想另谋机会。
取2.1 节中发酵灵芝, 置于带温度计及回流冷凝管的三颈瓶中, 在一定温度下, 加入一定量水,提取一段时间, 冷却至室温, 过滤, 得到发酵灵芝总多糖提取液。
2.4.3 样品总多糖提取率计算
取上述提取液2.00 mL, 按2.4.1 节中对照品溶液的测定方法在625 nm 波长处测定吸光度, 根据标准曲线计算得到该提取液中总多糖浓度X1(mg·mL-1)。
式中:V—总多糖提取液总体积;m—提取总多糖时灵芝粉末用量。
2.5 三萜含量测定
三萜含量依照药典[1]采用齐墩果酸对照法测定。
2.5.1 对照品溶液的制备
精密称取齐墩果酸对照品加甲醇制成每1 mL含0.2 mg 的溶液, 为对照品溶液。精密量取对照品溶液0.1、0.2、0.3、0.4、0.5 mL, 分别置于15 mL 具塞试管中, 挥干, 放冷, 精密加入新配制的香草醛冰醋酸溶液0.2 mL (精密称取香草醛0.5 g, 加冰醋酸溶解成10 mL, 即得)、高氯酸0.8 mL, 摇匀, 在70 ℃水浴中加热15 min, 立即置于冰浴中冷却5 min, 取出, 精密加入乙酸乙酯4.0 mL, 摇 匀, 依 次 得 浓 度 为 0.004、0.008、0.012、0.016、0.020 mg·mL-1的待测对照品溶液。以相应试剂为空白, 用紫外-可见分光光度计在546 nm 波长处测定吸光度, 以吸光度为纵坐标(Y′), 浓度为横坐标 (X′) 绘制标准曲线。计算回归方程为Y′= 2.415 1X′-0.011 3,R2= 0.997,线性范围0.004~0.020 mg·mL-1, 线性关系良好。
2.5.2 样品三萜提取
取2.1 节中发酵灵芝, 置于带温度计及回流冷凝管的三颈瓶中, 在一定温度下, 加入一定量无水乙醇, 提取一段时间, 冷却至室温, 过滤, 得发酵灵芝三萜提取液。
2.5.3 样品三萜提取率计算
取上述提取液0.2 mL, 置于15 mL 具塞试管中, 照标准曲线制备项下的方法, 自挥干起, 同法操作, 在546 nm 波长处测定吸光度, 根据标准曲线计算得到该提取液中三萜浓度X′1(mg·mL-1)。
式中:V′—三萜提取液总体积;m′—提取三萜时灵芝粉末用量。
3 结果与讨论
3.1 发酵灵芝总多糖提取工艺考察结果
以水为提取剂, 以灵芝总多糖提取率为指标,采用L9(34) 正交表进行试验, 考察提取时间、提取温度、提取剂用量对灵芝总多糖提取率的影响, 结果见表3。
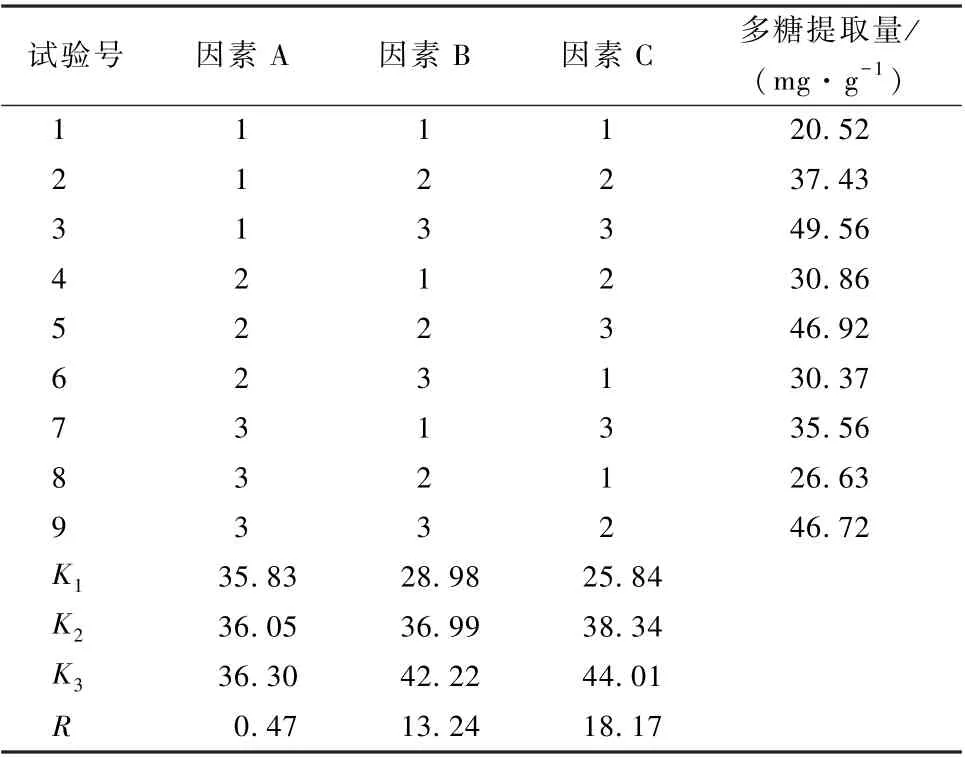
表3 发酵灵芝总多糖提取正交试验结果
由表3 可以看出, 最优总多糖提取工艺为A1B3C3, 且C3>B3>A1。溶剂用量对总多糖提取率影响不大,R=0.47, 溶剂用量为10 mL·g-1或50 mL·g-1, 多糖提取率相差不大, 结合灵芝粉末完全浸没所需溶剂用量及操作便利性, 确定最佳溶剂用量为10 mL·g-1。影响最大的是温度,R=18.17, 温度越高提取率越高, 但溶剂水的沸点为100 ℃, 已达极限。时间影响其次,R=13.24, 随时间增长, 提取率增加。该正交试验表未能得到最佳提取时间, 需进一步进行单因素试验考察。
3.2 发酵灵芝总多糖提取单因素试验
根据正交试验结果, 选取溶剂用量10 mL·g-1, 提取温度为100 ℃, 考察提取时间对总多糖提取率的影响, 结果见表4。结果表明, 随着提取时间的增加提取率也升高, 当提取时间达到3.5 h,提取率趋于稳定, 不再随着提取时间的增加而增加, 综合考虑能耗、效率等因素, 确定3.5 h 是发酵灵芝总多糖最佳提取时间。
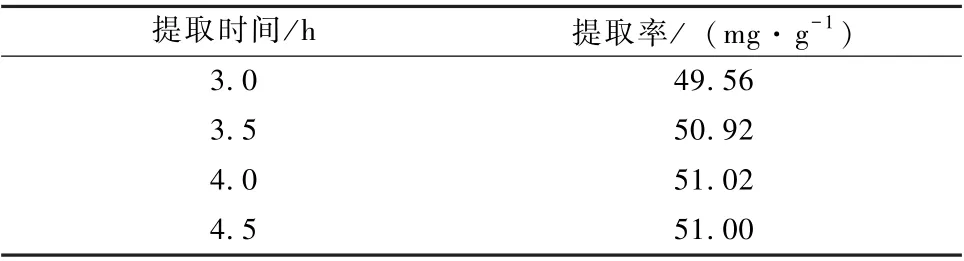
表4 提取时间对发酵灵芝总多糖提取率的影响
3.3 发酵灵芝三萜提取工艺优化
以无水乙醇为提取剂, 以灵芝三萜提取率为指标, 采用L9(34) 正交表进行试验, 考察提取时间、提取温度、提取剂用量对灵芝三萜提取率的影响, 结果见表5。

表5 发酵灵芝三萜提取正交试验结果
由表5 可以看出, 最优三萜提取工艺为A1B2C2, 且A1>B2>C2。其中溶剂用量对三萜提取率影响最大,R=4.28, 随着溶剂用量增加, 三萜提取率明显下降, 但若继续减少溶剂用量, 样品便无法完全浸没于溶剂中, 也不利于后续的过滤等操作, 故确定最佳提取剂用量为10 mL·g-1。提取时间影响其次,R=3.99, 随着提取时间增加, 三萜提取率先增加后降低, 最优提取时间为2 h。温度对提取率影响最小,R= 2.18, 随着温度升高,提取率先上升后下降, 最优提取温度为50 ℃。
3.4 灵芝发酵前后总多糖和三萜提取率对比
为考察微生物发酵前处理对灵芝总多糖提取率的影响, 取同批次未经过微生物发酵前处理的灵芝, 以水为提取剂, 提取剂用量为10 mL·g-1, 在100 ℃下提取3.5 h, 冷却至室温, 过滤, 得未发酵灵芝总多糖提取液。取该提取液2.00 mL 按2.4.2 节的操作测定总多糖提取率为34.02 mg·g-1, 明显低于同批次、同条件下微生物发酵前处理灵芝总多糖提取率50.92 mg·g-1, 结果见图1。由此可见, 微生物发酵前处理可显著提高灵芝总多糖提取率。

图1 发酵灵芝和未发酵灵芝总多糖提取率比较
为考察微生物发酵前处理对灵芝三萜提取率的影响, 取同批次未经过微生物发酵前处理的灵芝,以无水乙醇为提取剂, 提取剂用量为10 mL·g-1,在50 ℃下提取2 h, 冷却至室温得未发酵灵芝三萜提取液。取该提取液0.2 mL 按2.5.2 节的操作测定三萜提取率为10.67 mg·g-1, 明显低于同批次、同条件下微生物发酵前处理灵芝三萜提取率13.06 mg·g-1, 结果见图2。由此可见, 微生物发酵前处理可显著提高灵芝三萜提取率。

图2 发酵灵芝和未发酵灵芝三萜提取率比较
4 结论
经康宁木霉LZ51 (Trichodermakoningii) 发酵处理得到的发酵灵芝, 灵芝总多糖最佳提取工艺为: 以水为提取剂、用量为10 mL·g-1、100 ℃下浸提3.5 h, 在该最佳提取工艺条件下总多糖提取率可达50.92 mg·g-1; 灵芝三萜最佳提取工艺为:以无水乙醇为提取剂、用量为10 mL·g-1、50 ℃下浸提2 h, 在该最佳提取工艺条件下灵芝三萜提取率可达13.06 mg·g-1。而同产地、同批次未经发酵前处理的灵芝粉末在相同提取条件下总多糖提取 率 仅 34.02 mg ·g-1, 灵 芝 三 萜 提 取 率 为10.67 mg·g-1, 均 明 显 低 于 经 康 宁 木 霉 LZ51(Trichodermakoningii) 发酵处理得到的发酵灵芝。由此可见, 微生物发酵前处理可显著提高灵芝总多糖和三萜提取率。
