超声处理对羊肉冷藏期间色泽稳定性和货架期品质的影响
2023-10-28朱彬唐宏刚张晋赵珂陆清萍李欢欢
朱彬, 唐宏刚, 张晋, 赵珂, 陆清萍, 李欢欢
(1.龙游耀农农业科技有限公司, 浙江 衢州 324400; 2.浙江省农业科学院 食品科学研究所, 浙江 杭州 310021;3.浙江农艺师学院, 浙江 杭州 310021)
冷鲜肉是指家畜屠宰后, 严格按照检验检疫制度对胴体进行快速冷却处理, 使胴体温度在24 h内降到0~4 ℃的肉类, 在后续加工、配送和销售过程中, 冷鲜肉的储存温度保持在这个范围内[1]。冷鲜肉因其具有鲜嫩、美味、安全、卫生等特点而深受消费者喜爱[2]。羊肉肉质细嫩、营养全面,营养成分易被人体吸收, 近年来越来越受到消费者的欢迎。但羊肉从屠宰到销售等环节会出现微生物污染, 蛋白质及脂肪氧化, 色泽劣变等问题, 导致其货架期较短[3], 严重影响羊肉的销售。因此,延长冷鲜羊肉可食用周期, 成为近年来的研究热点[4]。
超声波技术属于非热加工技术, 超声频率在20~100 kHz, 强度超过1 W·cm-2的高强度低频超声可以有效改善肉品品质, 提高加工效率, 目前在肉品加工领域得到了广泛的研究[5]。研究[6]表明, 低频率高强度超声波处理 (20~47 kHz, 2 s~30 min) 可以有效抑制畜禽肉及其制品中各种腐败或致病菌, 提升产品安全, 延长产品货架期。超声波的杀菌能力归因于其产生的空化作用, 空化作用可引起微生物细胞壁变薄甚至裂解, 从而导致微生物细胞抵抗外界胁迫能力下降, 微生物细胞受到周期性变化而产生共振, 引起细胞壁穿孔甚至破裂,胞内基质泄漏, 从而加快菌体死亡[7]。Caraveo研究表明, 高强度超声 (40 kHz, 11 W·cm-2) 显著减少了牛肉半腱肌4℃冷藏条件下的大肠菌群、嗜中温菌群和嗜冷菌数量, 保持了肉的理化特性, 延长了冷鲜牛肉的货架期。肉的色泽是消费者用以判断鲜肉货架期和可接受性的一个非常重要的指标, 在冷鲜肉有氧冷藏过程中维持肉色稳定尤为重要[9]。近年来, 超声波技术在保持肉类色泽的作用引起了人们的兴趣, 有研究证实, 超声波对冷鲜肉色泽有积极作用, 但也有研究证明, 其有相反作用或无效果[10], 当前的研究主要是针对牛肉, 针对羊肉等其他肉类的研究较少。
国内利用超声波处理提高肉品质方面的研究目前多集中于改善嫩度[11], 而在冷鲜肉保鲜方面的研究还较少, 尤其对冷鲜肉冷藏期间色泽稳定性的影响还未见报道。本研究拟以羊肉为研究对象, 通过研究超声处理对羊肉冷藏期间的色泽稳定性、蛋白质氧化、持水力、质构和微生物生长等品质方面的影响, 探究超声波技术在羊肉保鲜方面的潜力,为超声波在冷鲜肉保鲜领域的应用提供一定的理论和技术支撑。
1 材料与方法
1.1 材料与试剂
羊后腿肉购于浙江省农业科学院农贸市场; 磷酸缓冲液、硼酸、硫酸、碳酸钾、阿拉伯胶、甘油、甲基红指示剂、溴甲酚绿指示剂、无水乙醇均为分析纯, 购于杭州诺扬生物科技有限公司; 菌落计数平板培养基 (PCA)、结晶紫中性胆盐琼脂(VRBA) 培养基、MRS 琼脂培养基均购于杭州诺扬生物科技有限公司。
1.2 仪器与设备
超声波设备 (JY92-IIN), 宁波新芝生物科技股份有限公司; 拍击式均质器 (Scientz-04), 宁波新芝生物科技股份有限公司; 紫外分光光度计(UV-3100), 上海元析仪器有限公司; 质构仪(RapidTA+), 上海腾拔仪器科技有限公司; 恒温培养箱 (HWS-250Y), 上海精宏实验设备有限公司; 色差仪 (3NH), 深圳市三恩时科技有限公司; pH 计 (Testo 205), 深圳德图科技有限公司。
1.3 试验方法
1.3.1 超声波处理羊后腿肉及冷藏试验
将羊后腿肉切成大小一致的100 g 肉块, 分别放入保鲜袋封口备用。准备300 mL 冰水混合物作为超声介质, 通过添加冰块的方式, 使超声处理时的介质温度维持在4 ℃以下。基于预试验结果, 本次 试 验 共 有 4 个 处 理 组 ( 300、500、700、900 W), 处理时间均为10 min, 频率为24 kHz,超声探头直径为15 mm, 无超声处理组为对照组。超声处理时将保鲜袋包装的肉样品置于1 000 mL烧杯底部, 超声探头于水面下4 cm 进行工作5 s、间歇5 s 的不同功率超声处理。处理之后将羊肉样品置于4 ℃冰箱冷藏, 分别于0、1、3、5、7 d 进行取样, 对其进行色泽、肌红蛋白含量、氧合肌红蛋白含量、高铁肌红蛋白含量、蛋白质羰基和巯基含量、持水力、质构、菌落总数、乳酸菌、大肠菌群、挥发性盐基氮等指标的测定, 每个处理进行3次重复。
1.3.2 色泽的测定
使用色差仪采用国际标准CIE 颜色系统分别测定0、1、3、5、7 d 的 亮 度 值 (L*)、红 绿 值(a*)、黄蓝值 (b*), 每块肉取3 个点进行测定,参考高海燕等[12]的方法计算总色差 (ΔE)。
1.3.3 肌红蛋白总量及其相关色泽含量的测定
肌红蛋白总量的测定参考高海燕等[12]的方法略有修改。称取羊肉样品2 g, 用绞肉机搅碎, 加入20 mL 0.04 mol·L-1的磷酸缓冲液 (pH 值7.0) 进行高速 (10 000 r·min-1) 匀浆1 min, 匀浆液置于冰浴放置1 h, 随后再高速离心(10 000 r·15 ℃) 30 min, 取上清液, 同种缓冲液定容至25 mL, 0.25 μm 滤纸过滤, 取滤液分别测定其在525、545、565、572 nm 波长处的吸光度值。计算肌红蛋白总量、氧合肌红蛋白和高铁肌红蛋白含量。
1.3.4 蛋白质羰基和巯基含量
被氧化的蛋白质羰基可与2, 4-二硝基苯肼(DNPH) 反应生成棕色沉淀2, 4-二硝基苯腙, 用盐酸胍溶解沉淀后于370 nm 下检测, 可得到蛋白质羰基含量。本试验采用蛋白质羰基含量测定试剂盒 (RXWB0078-96, 泉州市睿信生物科技有限公司, 中国) 测定羊肉蛋白质羰基值。蛋白质总巯基值测定采用总巯基含量检测试剂盒 (AKAO010 M, 北京盒子生工科技有限公司, 中国) 测定。
1.3.5 肌肉持水性的测定
随机取样置于底部垫有纱布的50 mL 离心管中, 在2 000 r·min-14 ℃下离心20 min 后记录质量, 之后将离心后的样品置于烘箱中, 在105 ℃下干燥至质量恒定, 记录质量。持水力的测定参考高海燕的方法。
1.3.6 质构的测定
将羊肉切成1.0 cm×1.0 cm×0.5 cm 的样品,采用Rapid TA+质构仪P35 探头, 测定不同时期羊肉的硬度、弹性、咀嚼性、内聚性等指标, 每组样品测试3 个平行样, 取平均值。设定参数: 速度1.0 mm·s-1, 压缩比30%。
1.3.7 微生物生长
参考GB 4789.2—2010, 取样品10 g 并用灭菌剪刀剪碎, 放入装有90 mL 的无菌生理盐水中采用拍击式均质机均质3 min, 取0.2 mL 上清液进行10 倍递增稀释, 合适的梯度用0.1 mL 涂布平板。菌落总数采用菌落计数平板涂布, 37 ℃恒温培养48 h 计数; 大肠菌群采用结晶紫中性胆盐琼脂(VRBA) 培养基, 37 ℃厌氧培养48 h 计数; 乳酸菌采用MRS 琼脂培养基, 37 ℃厌氧培养48 h 计数。
1.3.8 挥发性盐基氮
挥发性盐基氮含量参考国家标准 GB 5009.228—2016 中的微量扩散法进行测定。
1.3.9 数据分析
数据采用SPSS 进行单因素方差分析, 采用Duncan′s 检验判定显著性差异,P<0.05 为显著。所有数据作图均使用Origin 9.0 进行。
2 结果与分析
2.1 不同超声处理后的羊肉在冷藏期间的色泽稳定性
超声波处理对羊肉色泽的影响见图1。不同处理组之间的L*值随冷藏时间延长呈下降趋势, 0、1、3 d 对照组的L*值与超声波处理组差异不明显,从5 d 开始, 对照组的L*值低于超声波组。冷鲜肉的a*值被认为与肌红蛋白或氧合肌红蛋白浓度有关, 超声波处理显著提高了冷藏期冷鲜羊肉的a*值。0~7 d, 对照组冷鲜肉的a*值从8.29 减少至5.61, 显著低于同时期的超声波组。300 W 超声处理组的a*值从0 d 的8.72 减少到7 d 的6.37,低于其他功率处理组。从3 d 开始, 对照组的b*值高于同时期超声处理组, 900 W 超声处理的b*值在1 和3 d 明显低于其他超声处理组。为了评估冷藏期间冷鲜肉的颜色偏差, 我们使用色差值(ΔE) 来评估冷鲜肉的颜色稳定性, 计算可以准确地建立视觉评估和仪器测量的色差之间的一致性[10]。不同处理组0 d 的ΔE值在0~1.5, 属于肉眼分辨不出来的颜色差异, 1 d 的ΔE值在5.8~10.0, 色差较为明显, 3 d 之后不同处理组的ΔE值在24.0~54.6, 与初始对照组冷鲜肉的色泽差异较大, 其中L*值对不同组ΔE值的影响最明显。

图1 不同超声处理对羊肉冷藏期间色泽的影响
超声波处理对羊肉肌红蛋白含量及其组分的影响见表1, 不同处理组肌红蛋白总量随冷藏时间的延长而显著减少, 其中500 和700 W 的超声处理可提高羊肉冷藏期间的肌红蛋白总量, 300 和900 W处理组的肌红蛋白总量与对照组差异不是很明显;500 和700 W 的MbO2分别在22.9% ~ 43.2%和25.6%~42.6%; 其高铁肌红蛋白分别在34.2%~62.7%和34.7%~67.2%, 从1 d 开始显著低于其他各处理组。综上所述, 500 和700 W 的超声处理可促进冷鲜肉的色泽稳定性, 其中700 W 超声处理在保持肌红蛋白总量和提高MbO2含量方面效果优于500 W 超声处理。
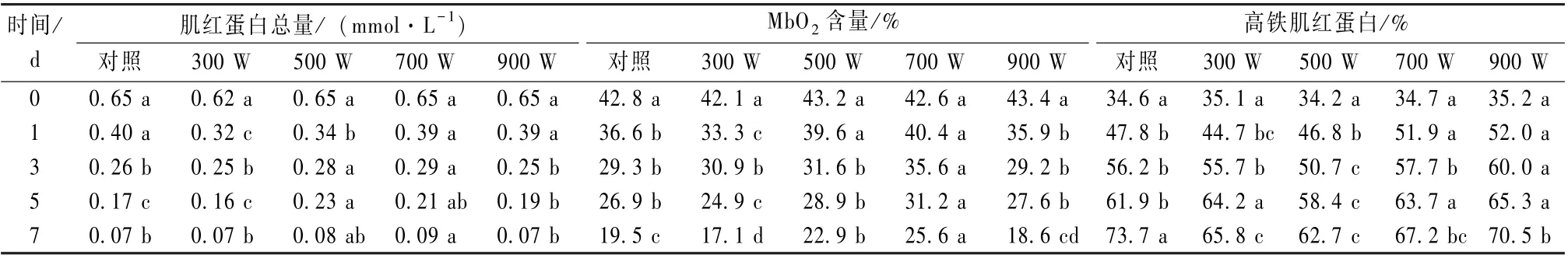
表1 不同功率的超声处理对羊肉冷藏期肌红蛋白及其组分的影响
2.2 不同超声处理后的羊肉冷藏期间蛋白质羰基和巯基含量的变化
蛋白质羰基含量的高低表征着蛋白质氧化损伤程度的大小, 是衡量蛋白质氧化损伤的主要指标,其值越大, 蛋白质氧化程度越高[13]。由图2 中A可知, 从1 d 开始, 700 和900 W 超声处理可以显著减少贮藏期间羊肉的羰基含量。300 和500 W 超声处理从3 d 开始可显著减少羊肉的羰基含量。蛋白质氧化会造成巯基含量减少, 因此, 巯基含量可作为检测蛋白质氧化程度的一个指标[13]。图2 中B 表明, 从1 d 开始, 500、700 和900 W 超声处理可显著减少冷藏期间羊肉蛋白质的巯基含量, 其中900 W 减少巯基含量的效果不如500 和700 W。结合蛋白质羰基和巯基含量的变化, 可知700 W 超声处理在减少冷藏期间羊肉蛋白质损伤方面的效果较好。

图2 不同功率的超声处理对羊肉冷藏期间蛋白质羰基含量和巯基含量的影响
2.3 不同超声处理后的羊肉冷藏期间持水力的变化
持水力是影响肉品品质 (如多汁性) 的一个重要因素[14]。不同功率的超声处理对冷鲜羊肉贮藏期持水力的影响见表2, 超声处理可以显著提高羊肉贮藏期间的持水力, 且持水力随超声功率的增大而加大。不同处理组的羊肉持水力随冷藏时间的延长而缓慢下降, 到7 d 时, 不同处理组的羊肉持水力下降14.3%~22.0%。

表2 不同功率的超声处理对羊肉冷藏期间持水力的影响
2.4 不同超声处理后的冷鲜肉在冷藏期的质构变化
由表3 可知, 在0 d, 300、500 W 的超声处理后可显著提高冷鲜肉的硬度。而在冷藏1 d 后, 与对照组相比, 超声处理后的羊肉硬度降低, 并在5 d 差异达到最大, 其中700 W 的嫩化效果最好。
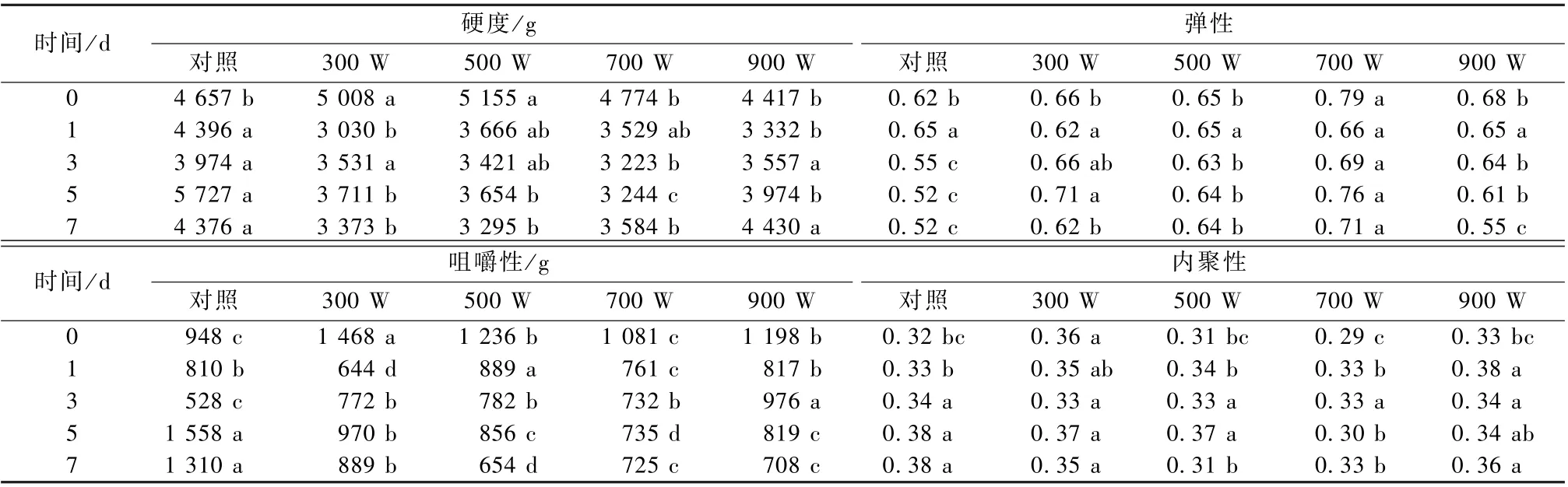
表3 不同功率的超声处理对羊肉冷藏期间质构的影响
超声处理后的羊肉弹性在冷藏3 d 之后与对照组差异显著, 其中700 W 处理的羊肉弹性最好。超声波处理可显著改变冷藏3 d 后的羊肉咀嚼性,其中3 d 羊肉咀嚼性显著提高, 5、7 d 咀嚼性显著降低。超声波处理组与对照组在羊肉内聚性上的差异不大, 其中700 W 超声处理的羊肉内聚性在5、7 d 显著减少。
2.5 不同超声处理后的羊肉在冷藏期间的微生物生长情况
微生物的生长繁殖是导致冷鲜肉腐败变质的主要诱因。如图3 中A 所示, 不同处理组的菌落总数随冷藏时间延长呈增加趋势, 其中对照组的菌落总数从3.18 lg (CFU·g-1) 增加到5.91 lg (CFU·g-1), 7 d 时对照组已属于变质肉。菌落总数随超声功率的增加而下降, 其中900 W 超声处理组的菌落总数由3.16 lg (CFU·g-1) 增加到4.82 lg (CFU·g-1), 700 W 超声处理组的菌落总数由3.16 lg(CFU·g-1) 增加到4.92 lg (CFU·g-1), 除3 和5 d 外, 700 与900 W 超声处理组的菌落总数差异不明显。大肠菌群(图3 中B) 与菌落总数趋势相似,对照组大肠菌群数量由2.59 lg (CFU·g-1) 增加到4.88 lg (CFU·g-1)。超声处理可以不同程度地减少羊肉冷藏期间的大肠菌群数量, 其中900 W 的超声处理减少羊肉大肠菌群数的效果最好, 其数值由2.09 lg (CFU·g-1) 增加到4.44 lg (CFU·g-1)。300、500 和700 W 超声处理7 d 的大肠菌群数量与对照组差异不明显。冷藏期冷鲜肉的乳酸菌数见图2 中C, 900 W 超声处理的冷鲜肉乳酸菌数显著低于其他处理组(除7 d)。与对照组相比, 300、500 和700 W 超声处理冷鲜肉中的乳酸菌数影响不明显。

图3 不同超声处理对羊肉冷藏期间菌落总数 (A)、大肠菌群 (B)、乳酸菌 (C) 的影响
2.6 不同超声处理后的羊肉在冷藏期间的挥发性盐基氮
肉中蛋白质在酶和细菌的作用下分解产生氨以及胺类碱性含氮物质[14]。挥发性盐基氮含量是判断肉新鲜程度的一个重要指标[15]。对照组的挥发性盐基氮含量从65.3 mg·kg-1增加到238.0 mg·kg-1, 3 和5 d 属于二级鲜度。超声处理可显著减少羊肉挥发性盐基氮的产生, 其中500、700 和900 W 超声处理效果明显, 900 W 超声处理组挥发性盐基氮含量从65.3 mg·kg-1增加到152.0 mg·kg-1, 较对照组降低, 增加超声功率可显著减少羊肉冷藏期间的挥发性盐基氮含量 (图4)。
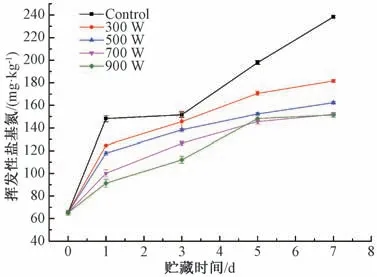
图4 不同超声处理对羊肉冷藏期间挥发性盐基氮的影响
3 讨论
肉的颜色主要由肌红蛋白的浓度决定, 肌红蛋白是一种肌原纤维蛋白, 能够结合氧, 其主要功能是在肌肉组织中形成氧气储备, 在暂时缺氧时消耗氧气。肌红蛋白与氧结合形成氧合肌红蛋白(MbO2) 而使羊肉呈现亮粉色, 与此同时, 血红素中的铁从Fe2+转化为Fe3+会导致肌肉组织失去亮粉色而形成深棕色的高铁肌红蛋白[16]。目前超声波处理在保持肉类色泽稳定性方面的研究结果多有矛盾之处[17-18]。Krasulya 等[10]研究了浸入式和流动式盐水结合超声技术在猪肉颜色稳定中的作用, 结果显示, 该方法可促进猪肉颜色稳定, 这可能与超声结合盐水产生较多的自由电子激活高铁肌红蛋白, 降低肉的活性有关。本研究结果证实, 适宜的超声功率对羊肉的色泽稳定有促进作用, 相关机制研究还有待进一步深入。
肉品质构是衡量其品质的重要感官指标, 它与肉的嫩度、可食性、口感以及加工出品率等有着重要的关联[11]。从技术上来讲, 超声波对于肉的组织有2 种主要影响形式: 一种是打破细胞的完整性, 一种是促进酶的反应。陈丽艳等[11]的研究证实, 超声波处理时间越长, 鹅肉肌纤维束、超微结构中的A 带、I 带、Z 带和M 线等破坏越严重; 蛋白二级结构分析显示, 超声波处理能加快α-螺旋向β-折叠和无规则卷曲方向转化的速度。Chen研究表明, 高功率超声使钙蛋白酶Ⅰ和calpain 酶活性显著升高, 可以改善肌纤维结构的破坏, 并通过触发细胞凋亡增加宰后鸡肉的蛋白质水解, 从而改善肉质嫩度。本研究结果证明, 300和500 W 超声处理可明显增加羊肉的硬度, 在冷藏1 d 后硬度才开始改善, 这与前人结果略有不同。由于超声处理的效果因超声波设备与参数、超声波产生的温度效应、研究对象以及处理方式的不同而不同, 因此, 适宜的超声波参数以及其作用机制是进一步探索的重点。
近年来, 食品蛋白质氧化产生的毒性作用引起了科学家的关注。据报道, 来自食物成分的氧化产物会促进炎症, 并与肠道致癌的发生有关[20]。蛋白质氧化最常见的产物是羰基。巯基具有很强的反应活性, 对于稳定肌原纤维蛋白质的空间结构及理化功能具有重要意义。巯基氧化成二硫键导致蛋白质分子之间发生交叉、联结等现象, 从而使肌原纤维蛋白空间结构发生变化[21]。本研究中, 超声波处理对羊肉蛋白质羰基含量的影响较显著, 对巯基值的影响差异较大, 超声功率对蛋白质氧化效果的影响差异较大。这与王安然[22]的结果略有不同,推测可能与原料和超声处理参数的差异有关。超声波处理对蛋白质氧化的影响机理还需要进一步深入研究。
超声波技术在杀菌方面的应用始于20 世纪20年代, 随后, 人们开始探索超声杀菌在食品中的应用潜力[23]。超声波的杀菌效力主要是基于超声波所产生的空化作用, 使微生物细胞内容物受到强烈的震荡, 从而达到对微生物的破坏作用。研究表明, 单独使用超声杀菌时其灭活效果并不理想, 因此, 将超声技术与其他灭菌方式结合是目前的一个研究热点。超声波的杀菌效果受超声强度 (功率、振幅、频率、外部压力)、处理介质 (黏度、体积、pH 值和初始微生物数量) 和微生物种类及状态 (革兰氏阳性菌/阴性菌、大小和形状、芽孢/营养细胞、生长期) 等因素的影响[24], 本研究中超声处理对羊肉的杀菌效果受功率影响较显著,900 W 的超声处理可以使羊肉菌落总数、大肠菌群和乳酸菌均减少, 但单独使用高强度超声的杀菌效果较有限, 这与前人[24]的研究结果一致。900 W超声尽管具有较优的杀菌效果, 但综合其他因素显示, 其保鲜效果不如700 W, 这可能与900 W 对冷鲜肉细胞结构破坏有关, 导致其组织状态劣变加剧。
