可溶解氧化铅的氧气传感器电解液性能研究
2023-10-28汪建德苏寒雨龚靖博刘海峰
汪建德 ,苏寒雨 ,龚靖博 ,刘海峰 *
1.四川久远智能消防设备有限责任公司,四川绵阳 622650;2.西南科技大学分析测试中心,四川绵阳 621010;3.四川久远智能&西南科大校企联合实验室,四川绵阳 622650
0 引言
液体电解质氧传感器灵敏度高、响应时间快[1-2],相较于固体电解质,氧传感器具有可在常温下使用的优势[3-4],且结构小巧,性能稳定,在医学界[5]和工业界的各种氧气测定仪上已有广泛使用[6-7]。这种氧传感器的工作原理类似于金属——空气电池[8],一般采用铅块作阳极,纳米贵金属材料作工作电极的催化剂,氧气通过毛细孔进入传感器内部,与工作电极接触后释放氢氧根离子,这些氢氧根离子又通过电解质达到阳极铅处,与铅发生氧化反应,生成氧化铅[9-10]。然而,产生的氧化铅会堆积在铅电极上令其钝化,使电化学反应速率减小甚至停止,导致传感器失效,缩短使用寿命[11-12]。因此,避免或减少氧化铅在阳极上的积累是延长电化学氧传感器寿命并保证传感器性能的有效方法之一。
EDTA 二钠(乙二胺四乙酸二钠)是一种十分常见的螯合剂,含有羧基、羟基氧原子官能团,能够与大多数金属离子络合形成易溶于水且结构稳定的配合物[13]。如罗建新等[14]采用两种阴离子表面活性剂和一种非离子表面活性剂与EDTA 二钠复配去除水中铅离子,发现阴离子表面活性剂的去除效率更高,且pH 值升高和铅离子初始浓度降低有助于铅离子的去除。已有研究证明,EDTA 对铅离子和氧化铅固体有很好的络合溶解效果,可以用作氧传感器氧化铅产物的螯合剂。李淋萍[15]的研究发现,当pH 值为5,溶液浓度为0.2 mol/L 时,氧化铅的溶解效率最高,可达96.33%。
目前,相关研究主要针对废水或废渣中的重金属处理,且多在酸性条件下与铅离子发生反应,对该络合剂在碱性电解液中直接络合固体氧化物的应用还很少见。
本文基于EDTA 二钠的强络合性能,在电解液中使用磷酸盐作为缓冲成分,稳固电解液在反应过程中产生的pH 值变化,探究电解液对氧化铅的溶解限度,并测定电解液的挥发性。由于EDTA 二钠也能与金属单质发生络合反应,本文还研究了电解液对铅电极的腐蚀情况。为明确电解液在溶解氧化铅后产生的性质变化是否会影响传感器性能,测试了氧化铅溶解前后电解液电阻值的变化。最后,用含络合剂的电解液组装成氧传感器,测试传感器的响应性能,与商业氧传感器进行对比,以验证电解液的实用性。
1 实验部分
1.1 实验试剂与仪器
氧化铅,分析纯,购自阿拉丁试剂公司;乙二胺四乙酸二钠(二水合物)和氢氧化钾,均为分析纯,购自成都市科隆化学品有限公司;磷酸氢二钾,分析纯,购自吉至试剂。用到的设备有:雷磁pHS 25 型pH 计,辰华CHI604E 恒电位仪。
1.2 实验方法
1.2.1 电解液配制方法
配制0.5 mol/L pH 值为13 的0.75 mol/L K2HPO4-KOH 缓冲液,然后取3 份该溶液,分别添加溶液质量50%、60%、70%的EDTA 二钠,在搅拌条件下用40% KOH 溶液缓慢将3 种溶液的pH 值调至8.50±0.01,EDTA 二钠在此过程中会逐渐溶解。以上3 种溶液分别标记为50、60、70。另配制如下溶液:以水的质量为基准,向水中加入50% EDTA 二钠,用40% KOH 溶液缓慢将溶液的pH 值调至8.50±0.02,此溶液标记为0。
在以上溶液与氧化铅反应达上限后,每种反应后的溶液取一部分,用规格为0.45 μm 的滤头进行过滤,密封保存。
1.2.2 溶解氧化铅过程中电解液的pH 值变化趋势
向1.2.1 所配制的溶液中边搅拌边加入氧化铅粉末,每加入0.5 g 氧化铅且氧化铅完全溶解后,记录溶液的pH 值,直至氧化铅达到溶解上限,最终得出电解液对氧化铅的溶解量。
1.2.3 电解液在空气中的挥发性测试
采用参考文献[16]的方法并稍作改动。取1.5 mL配制好的电解液于2 mL 离心管中,将离心管上盖打800 μm 孔后盖好上盖,称量装有电解液的离心管初始质量,后续每隔24 h 测量一次。根据电解液的质量变化情况判断其在空气中的挥发情况。
1.2.4 铅丝在电解液中的稳定性测试
称取约0.500 0 g 铅丝,用无水乙醇超声清洗10 min 并真空干燥,然后放置于5 mL 电解液中密封保存于25 ℃环境中,7 d 后取出铅丝,用超纯水冲洗干净,真空干燥后称量铅丝质量,与初始质量比较。
1.2.5 电解液的EIS 测试
采用恒电位仪对氧化铅溶解前后的各溶液进行交流阻抗测试,测试频率为0.01 ~100 000 Hz。读取交流阻抗谱中Z'值最小时的Z"值为电解液的阻值[17]。
1.2.6 组装的氧传感器响应性能测试
将1.2.1 中编号50 的电解液用于组装电化学氧气传感器,其内部主要结构如图1 所示[18]。
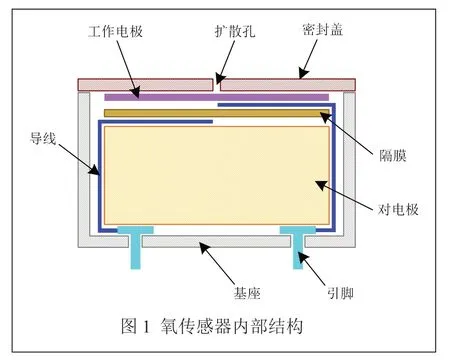
以铅块为传感器阳极,铂作为阴极催化剂,用恒电位仪测试传感器环境气氛从20.9% O2→100%N2→20.9% O2的响应性能,并与一款进口商业传感器比较。
2 结果与讨论
2.1 氧化铅溶解量对电解液pH 值的影响
图2 是各溶液随着氧化铅加入量增加pH 值的变化趋势。
根据实验结果,50%、60%和70% EDTA 二钠添加量的溶液(加入络合剂前溶液质量为10 g)氧化铅溶解量分别约为2.75 g、3.00 g 和3.50 g。随着氧化铅溶解量增加,所有溶液的pH 值都呈上升趋势,且最终pH 值均不超过14。EDTA 二钠的添加量越大,终点pH 值越小(50、60、70 的终点pH 值分别为13.88、13.86、13.70),并且整体的变化趋势也更为稳定。对比未使用磷酸氢二钾作为缓冲体系的溶液,磷酸氢二钾的加入可使溶液pH 值的变化幅度减缓,有助于提高传感器使用过程中的稳定性。

2.2 电解液常温下挥发情况
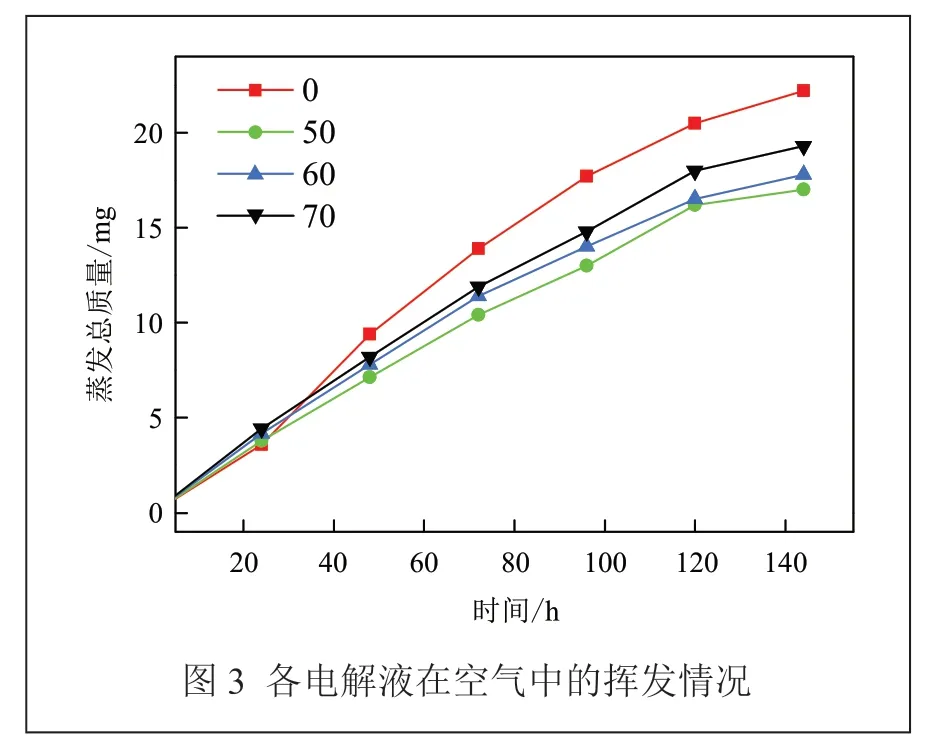
图3 是含不同浓度EDTA 二钠的电解液在常温下的挥发情况。
从图3 中可见,所有溶液在空气中均存在水分挥发情况,挥发速度随时间延长有减缓趋势。磷酸二氢钾的加入使电解液挥发速度更慢,144 h 内溶剂水的总挥发量小于20 mg。氧传感器的透气孔径在100 μm 以内,远小于实验所打的800 μm 孔,配合传感器使用的防水透气膜控制气流速度,在实际使用时,电解液的挥发程度更小。不同浓度磷酸氢二钾对电解液挥发量的影响差距不大,磷酸氢二钾添加量为50%的电解液表现为挥发量最小。
2.3 阳极铅丝在电解液中的稳定性
图4 展示了一定质量的铅丝在不同电解液中静置反应7 d 后的质量变化。

由图4 可见,铅丝在电解液中放置7 d 后,质量变化幅度极小,不超过2 mg,这表明,在碱性条件下,EDTA 二钠对铅单质的腐蚀程度非常有限,即铅单质在电解液中具有一定化学稳定性。
2.4 电解液溶解氧化铅前后的电阻值
溶解氧化铅前后各溶液的电阻值如表1 所示。
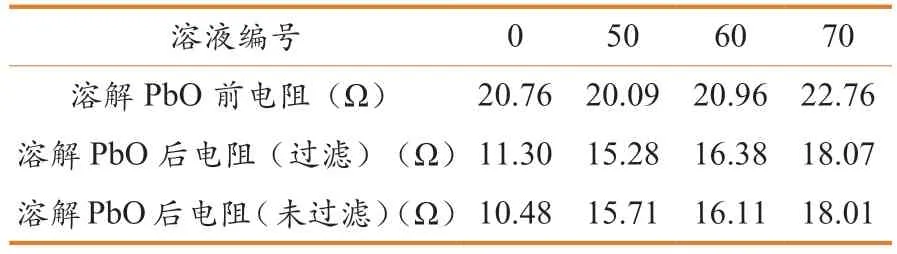
表1 电解液溶解氧化铅前后的电阻值
随着络合剂浓度增大,溶液电阻均有所增加,但增幅不大,这是因为EDTA 二钠的分子量偏大,其浓度增加会降低电荷传递效率。溶解氧化铅后,溶液电阻减小,可能是EDTA 二钠与氧化铅络合后,由于溶液中铅离子的引入,电荷数增加,因此溶液的导电能力有所增强,这有利于电解液的长期性能保持。对比过滤溶液中剩余氧化铅前后的测试结果,在未溶解的氧化铅沉积在容器底部后,溶液中剩余的少量固体对溶液的电阻有一定影响,但影响较小,推测在传感器的实际使用过程中,沉淀的沉积对电解液导电性能的影响可以忽略。
2.5 氧传感器响应性能表征
电化学氧传感器是一种极限电流型传感器[19],电解液性能与其响应速度密切相关[20]。图5 是用EDTA二钠添加量为50%的电解液组装的传感器在20.9%O2~100% N2气氛变换后的响应特性曲线与购入的商业传感器作对比。0 ~100 s 和500 ~600 s 为20.9%O2气氛,100 ~500 s 为100% N2气氛。
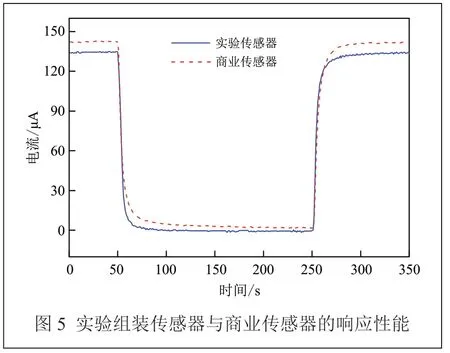
从图5 可以看出,在输出稳定性上,实验传感器表现良好,与商业传感器相当。实验传感器在20.9%O2下输出值变化幅度不超过1 μA,100% N2下变化幅度小于2 μA。
表2 为两种传感器在不同气氛下的输出电流值,测试时传感器负载为100 Ω。

表2 传感器在不同气氛下的输出电流
表中响应时间T90 表示传感器读数从100% N2下平衡信号值到20.9% O2下平衡信号值的90%所需的反应时间,恢复时间RT90 表示从20.9% O2下平衡信号值到100% N2下平衡信号值的10%所需的反应时间。由结果可知,实验传感器的响应性能已达到商业传感器水准。
3 结束语
本研究采用具有缓冲性质的磷酸氢二钾与络合剂EDTA 二钠复配,得到了具有氧化铅溶解性能的电化学氧传感器用碱性电解液。磷酸氢二钾的加入能够有效减小络合剂与氧化铅反应过程中电解液的pH 值变化程度,增强电解液的稳定性。复配的电解液在空气中放置144 h 后最大挥发量小于20 mg,且对氧传感器中的铅阳极无明显腐蚀反应。电解液在溶解氧化铅前后的溶液电阻值有减小,磷酸二氢钾的存在会削弱其减小幅度。用复配电解液组装的实验传感器能够延长传感器寿命,响应速度快,响应稳定性良好,与市售商业传感器性能相当,表明本研究开发的电解液具备一定的产业化前景。
