芒果苷对心肌细胞损伤的保护作用及对NFATc4表达的影响Δ
2023-10-28韦啟球高思冯艺萍裴世成刘雪萍广西科技大学医学部药学系广西柳州545005
韦啟球,高思,冯艺萍,裴世成,刘雪萍 (广西科技大学医学部药学系,广西 柳州 545005)
持续的病理性心脏肥大最终可导致心力衰竭,而病理性心脏肥大的发生和发展被认为是多种复杂因素综合作用的结果[1]。目前,临床尚缺乏有效手段来延缓或逆转心脏肥大向心力衰竭进展。研究发现,在慢性心力衰竭患者和心力衰竭动物模型中均存在高水平的氧化应激,且氧化应激与不良预后密切相关[2]。氧化应激损伤涉及多方面因素,过氧化物的堆积可直接造成细胞器损伤及多种功能紊乱,促进心肌重构和病理性心脏肥大的发展,并最终引发心力衰竭[3]。传统天然药物在抗肿瘤等领域表现出良好的抗氧化应激作用,然而其在心血管相关疾病中的价值尚有待发掘;同时,在心脏肥大机制和有效治疗方法研究领域中,揭示氧化应激在心脏肥大发展中的作用机制、寻找有效的天然药物等也备受学者关注。
芒果苷为双苯吡酮类化合物,主要从芒果叶中提取而得,具有显著的抗氧化、抗炎作用,且因具有良好的成药性而被广泛用于改善咳嗽、咳痰等呼吸系统症状[4—5]。研究指出,芒果苷可通过激活核转录因子红系2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)/抗氧化响应元件(antioxidant response element,ARE)通路、促进抗氧化酶表达等途径来改善多种原因造成的氧化应激损伤[6—7]。有研究指出,活化T细胞核因子c4(nuclear factor of activated T cells cytoplasmic 4,NFATc4)是促进心脏肥大的重要转录因子,其被激活后可结合到心房钠尿肽(atrial natriuretic factor,ANF)、B型利尿钠肽(B-type natriuretic peptide,BNP)的启动子上,从而促进肥大基因的表达[8]。同时多项研究证实,NFATc4在诱导氧化应激和促进细胞凋亡中也具有重要作用[9]。本研究拟以大鼠H9c2细胞为对象,以过氧化氢(H2O2)为诱导剂[10],通过检测凋亡相关蛋白、活性氧(reactive oxygen species,ROS)和抗氧化酶活性的变化,探讨芒果苷对H2O2致氧化应激的影响,并初步考察该作用是否与NFATc4有关,以期为证实芒果苷改善氧化应激的潜能提供依据,为心脏肥大的治疗挖掘新靶点、提供新思路。
1 材料
1.1 主要仪器
本研究所用主要仪器包括3111型细胞培养箱、Model-450型酶标仪、Multiskan MK3型酶标仪(美国Thermo Fisher Scientific公司),Power/Pac300型稳压稳流电泳仪、Trans-Blot SD型转膜仪(美国Bio-Rad公司),Image Quant 800型凝胶电泳成像分析系统(美国Cytiva公司)等。
1.2 主要药品及试剂
芒果苷原料药(批号20220203,纯度98%)购自南宁维康医药科技有限公司;DMEM培养基(批号8122609)购自美国Thermo Fisher Scientific公司;胎牛血清、CCK-8试剂、Lipo8000转染试剂、ROS检测试剂盒[含2,7-二氯荧光素二乙酸酯(DCFH-DA)探针]、兔源B细胞淋巴瘤2(B cell lymphoma 2,Bcl-2)多克隆抗体和辣根过氧化物酶(HRP)标记的羊抗鼠IgG二抗、羊抗兔IgG二抗(货号/批号分别为C0232、C0041、C0533、S0033S、AB112、A0192、A0239)均购自碧云天生物技术有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)检测试剂盒(批号分别为A001-1-2、A007-1-1、A003-1-2)均购自南京建成生物工程研究所;兔源Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、剪切的胱天蛋白酶3(cleaved caspase-3)多克隆抗体(批号分别为2772S、9661S)均购自美国CST公司;鼠源NFATc4多克隆抗体(批号sc-271597)购自美国Santa Cruz公司;鼠源微管蛋白(tubulin)单克隆抗体、兔源核纤层蛋白B1(lamin B1)多克隆抗体(批号分别为T6199、SAB2101352)均购自美国Sigma公司。
1.3 细胞株
大鼠心肌细胞H9c2细胞株购自中国科学院上海生科院细胞资源中心。
2 方法
2.1 细胞培养
取H9c2细胞,复苏后培养于含10%胎牛血清的DMEM培养基中,待融合至80%左右进行传代;将传代后的细胞继续培养于含10%胎牛血清的DMEM培养基中;待融合至80%左右时,将培养基替换为含2%胎牛血清的DMEM培养基,继续培养。
2.2 细胞相对存活率检测
取对数生长期的细胞,按6×103个/孔接种于96孔板中,培养过夜。待细胞贴壁后,将其分为空白组、H2O2组和芒果苷50、100、150 μmol/L组(浓度参考相关文献[11]和本课题组前期预实验结果设置),每组设3个复孔。各药物组经不同浓度芒果苷作用12 h后,再与H2O2组一同经H2O2(200 μmol/L,浓度参考相关文献[12]和本课题组前期预实验结果设置)刺激12 h;随后,每孔加入CCK-8试剂10 μL和DMEM培养基90 μL,继续培养1 h,使用酶标仪于450 nm波长处检测各孔的光密度(optical density,OD)值,并按下式计算各组细胞的相对存活率:相对存活率=实验组细胞OD值/空白组OD值×100%。
2.3 细胞上清液中SOD、CAT、MDA水平检测
取对数生长期的细胞,按5×103个/孔接种于96孔板中,设空白组、H2O2组和芒果苷50、100、150 μmol/L组,每组设4个复孔。各组细胞按“2.2”项下方法处理。收集各组细胞上清液,于4 ℃下以3 000 r/min离心10 min,使用酶标仪检测各组细胞上清液中SOD、CAT、MDA的水平。操作过程严格按照试剂盒说明书执行。
2.4 细胞ROS水平检测
取对数生长期的细胞,按5×103个/孔接种于96孔板中,设空白组、H2O2组和芒果苷50、100、150 μmol/L组,每组设4个复孔。各组细胞按“2.2”项下方法处理。收集细胞,在含10 μmol/L DCFH-DA探针的无血清DMEM培养基中孵育20 min,用磷酸盐缓冲液清洗3次,使用酶标仪于激发波长488 nm、发射波长525 nm下检测各孔的荧光强度,用以表示ROS水平(结果以空白组为标准作归一化处理)。
2.5 细胞凋亡相关蛋白和核蛋白NFATc4表达的检测
取对数生长期的细胞,按1×104个/孔接种于6孔板中,设空白组、H2O2组和芒果苷50、100、150 μmol/L组,每组设3个复孔。各组细胞按“2.2”项下方法处理。收集细胞,加入RIPA裂解液,提取总蛋白。测定蛋白浓度后,加入5×蛋白上样缓冲液,并在100 ℃下煮沸5 min变性。取变性后的蛋白样品适量,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后转膜、封闭;洗膜后,分别加入Bcl-2、Bax、cleaved caspase-3、NFATc4、tubulin、lamin B1一抗(稀释度均为1∶1 000),于4 ℃下孵育过夜;洗膜后,加入相应二抗(稀释度均为1∶5 000),于室温下孵育1 h;洗膜后,以ECL发光液显色并使用凝胶电泳成像分析系统成像。采用GraphPad Prism 5.0软件计算Bcl-2、Bax、cleaved caspase-3与内参tubulin以及核蛋白NFATc4与内参lamin B1的灰度值比值,用以表示上述蛋白的相对表达量(结果以空白组为标准作归一化处理)。
2.6 NFATc4对H9c2细胞氧化应激及凋亡相关指标的影响检测
本研究通过干扰NFATc4蛋白的表达并检测H9c2细胞中氧化应激指标和凋亡相关蛋白的变化来评价NFATc4蛋白对上述指标的影响。NFATc4干扰序列由上海吉玛制药技术有限公司设计,上、下游序列分别为5'-GGAGUCUGAACUUAAUGAATT-3'、5'-UUCAUUAAGUUCAGACUCCTT-3'。取对数生长期的细胞,设空白组、H2O2组、siNFATc4组、H2O2+siNFATc4组,每组设3个复孔。参照转染试剂使用说明书,将Lipo8000转染试剂4 μL、干扰序列100 pmol和无血清无抗生素的DMEM培养基125 μL混合,加入至siNFATc4组、H2O2+siNFATc4组细胞中,再用含2%胎牛血清的DMEM培养基补足至2 mL;其余组不加入干扰序列,处理方法同前。各组细胞培养36 h后,H2O2组和H2O2+siNFATc4组细胞用H2O2(200 μmol/L)刺激12 h。随后,收集空白组和siNFATc4组细胞,按“2.5”项下方法检测其核蛋白NFATc4的表达情况,以评价转染效果;收集各组上清液和细胞,分别按“2.3”~“2.5”项下方法检测SOD、CAT、MDA、ROS水平和Bcl-2、Bax、cleaved caspase-3蛋白的表达情况,以评价干扰NFATc4蛋白表达对上述指标的影响。
2.7 统计学方法
采用SPSS 17.0软件对数据进行统计分析。计量资料以±s表示,多组间比较采用方差分析,进一步两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 芒果苷对H9c2细胞相对存活率的影响
与空白组比较,H2O2组细胞的相对存活率显著降低(P<0.05);与H2O2组比较,芒果苷100、150 μmol/L组细胞的相对存活率均显著升高(P<0.05)。结果见表1。
表1 芒果苷对H9c2细胞相对存活率和氧化应激指标的影响(±s)
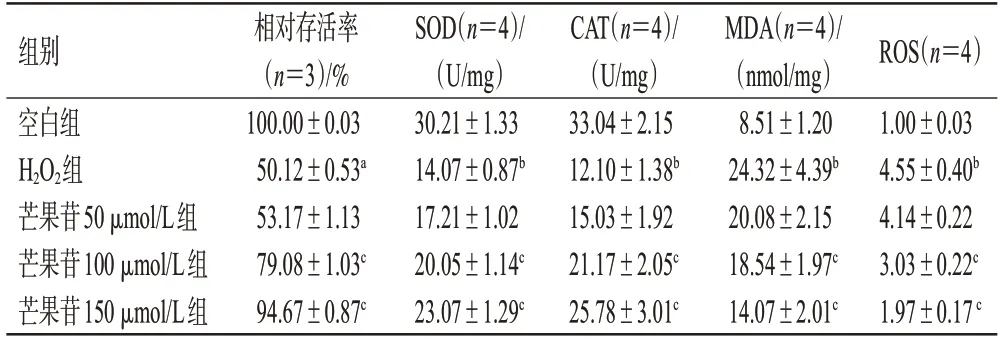
表1 芒果苷对H9c2细胞相对存活率和氧化应激指标的影响(±s)
a:与空白组比较,P<0.05;b:与空白组比较,P<0.01;c:与H2O2组比较,P<0.05。
组别空白组H2O2组芒果苷50 μmol/L组芒果苷100 μmol/L组芒果苷150 μmol/L组相对存活率(n=3)/%100.00±0.03 50.12±0.53a 53.17±1.13 79.08±1.03c 94.67±0.87c SOD(n=4)/(U/mg)30.21±1.33 14.07±0.87b 17.21±1.02 20.05±1.14c 23.07±1.29c CAT(n=4)/(U/mg)33.04±2.15 12.10±1.38b 15.03±1.92 21.17±2.05c 25.78±3.01c MDA(n=4)/(nmol/mg)8.51±1.20 24.32±4.39b 20.08±2.15 18.54±1.97c 14.07±2.01c ROS(n=4)1.00±0.03 4.55±0.40b 4.14±0.22 3.03±0.22c 1.97±0.17 c
3.2 芒果苷对H9c2细胞氧化应激指标的影响
与空白组比较,H2O2组细胞的SOD、CAT水平均显著降低,MDA、ROS水平均显著升高(P<0.01)。与H2O2组比较,芒果苷100、150 μmol/L组细胞的SOD、CAT水平均显著升高,MDA、ROS水平均显著降低(P<0.05)。结果见表1。
3.3 芒果苷对H9c2细胞凋亡相关蛋白和核蛋白NFATc4表达的影响
与空白组比较,H2O2组细胞中Bcl-2的相对表达量显著降低,Bax、cleaved caspase-3和核蛋白NFATc4的相对表达量均显著升高(P<0.05)。与H2O2组比较,芒果苷100、150 μmol/L组细胞中Bcl-2的相对表达量均显著升高,Bax、cleaved caspase-3和核蛋白NFATc4的相对表达量均显著降低(P<0.05)。结果见图1、表2。
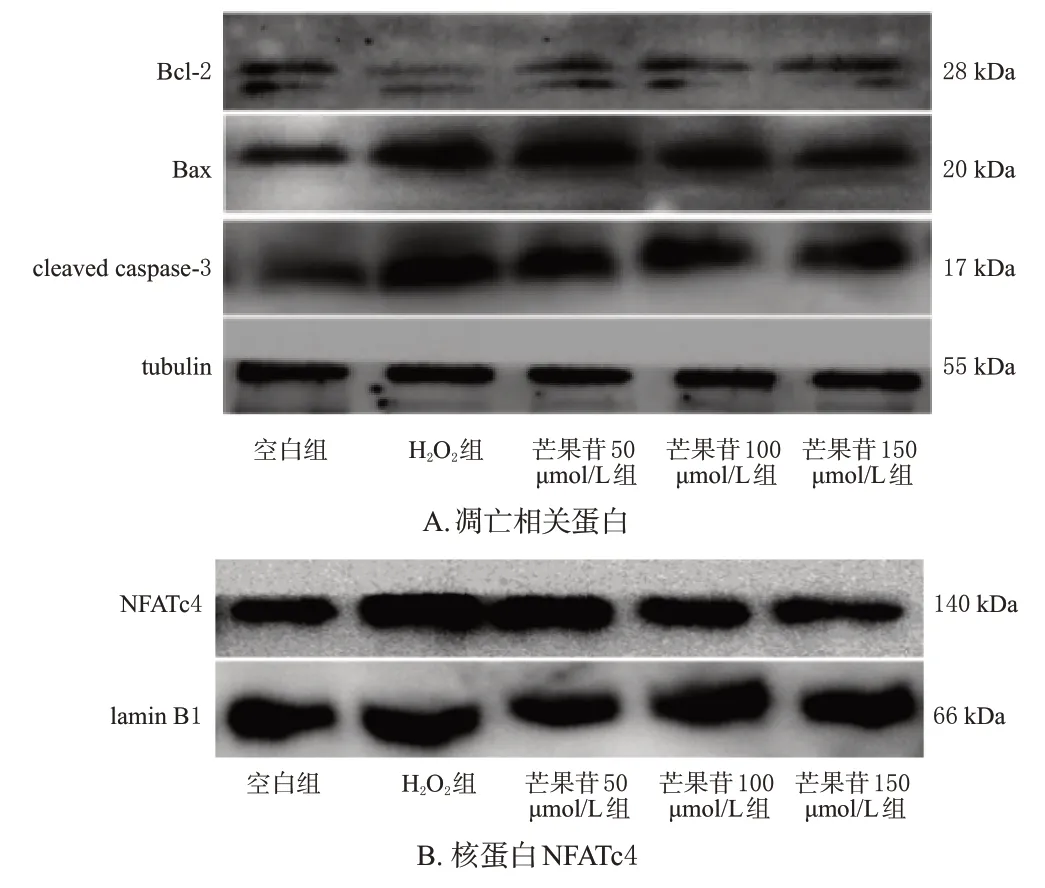
图1 芒果苷对H9c2细胞凋亡相关蛋白和核蛋白NFATc4表达影响的电泳图
表2 芒果苷对H9c2细胞凋亡相关蛋白和核蛋白NFATc4表达的影响(±s,n=3)
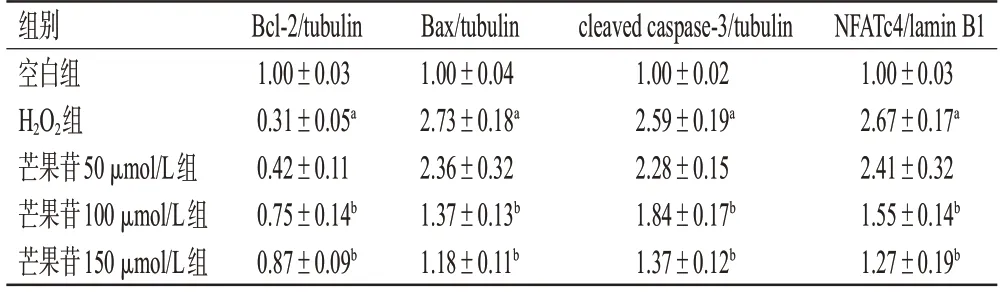
表2 芒果苷对H9c2细胞凋亡相关蛋白和核蛋白NFATc4表达的影响(±s,n=3)
a:与空白组比较,P<0.05;b:与H2O2组比较,P<0.05。
组别空白组H2O2组芒果苷50 μmol/L组芒果苷100 μmol/L组芒果苷150 μmol/L组NFATc4/lamin B1 1.00±0.03 2.67±0.17a 2.41±0.32 1.55±0.14b 1.27±0.19b Bcl-2/tubulin 1.00±0.03 0.31±0.05a 0.42±0.11 0.75±0.14b 0.87±0.09b Bax/tubulin 1.00±0.04 2.73±0.18a 2.36±0.32 1.37±0.13b 1.18±0.11b cleaved caspase-3/tubulin 1.00±0.02 2.59±0.19a 2.28±0.15 1.84±0.17b 1.37±0.12b
3.4 NFATc4对H9c2细胞氧化应激及凋亡相关指标的影响
3.4.1 细胞核蛋白NFATc4表达的变化
干扰核蛋白NFATc4的表达后,细胞核内该蛋白的表达显著下调(P<0.01)。结果见图2。

图2 干扰NFATc4后细胞核蛋白NFATc4表达水平变化
3.4.2 细胞氧化应激指标的变化
与空白组比较,H2O2组细胞SOD、CAT水平均显著降低,MDA、ROS水平均显著升高(P<0.05),而siNFATc4组细胞的上述指标均并无明显变化(P>0.05);与H2O2组比较,H2O2+siNFATc4组细胞SOD、CAT水平均显著升高,MDA、ROS水平均显著降低(P<0.05)。结果见表3。
表3 干扰核蛋白NFATc4表达对细胞氧化应激指标的影响(±s,n=3)

表3 干扰核蛋白NFATc4表达对细胞氧化应激指标的影响(±s,n=3)
a:与空白组比较,P<0.05;b:与H2O2组比较,P<0.05。
组别空白组H2O2组siNFATc4组H2O2+siNFATc4组ROS 1.00±0.03 4.54±0.27a 1.00±0.06 2.03±0.22b SOD/(U/mg)28.56±1.17 13.24±0.71a 27.39±1.23 20.05±1.14b CAT/(U/mg)35.18±2.37 13.29±1.16a 33.26±2.89 25.97±2.32b MDA/(nmol/mg)9.16±1.17 23.45±3.48a 22.52±2.19 16.63±1.11b
3.4.3 细胞凋亡相关蛋白表达的变化
与空白组比较,H2O2组细胞Bcl-2的相对表达量均显著降低,Bax、cleaved caspase-3的相对表达量均显著升高(P<0.05),siNFATc4组细胞的上述指标均并无明显变化(P>0.05);与H2O2组比较,H2O2+siNFATc4组细胞Bcl-2的相对表达量均显著升高,Bax、cleaved caspase-3的相对表达量均显著降低(P<0.05)。结果见图3、表4。
表4 干扰核蛋白NFATc4表达对细胞凋亡相关蛋白表达的影响(±s,n=3)
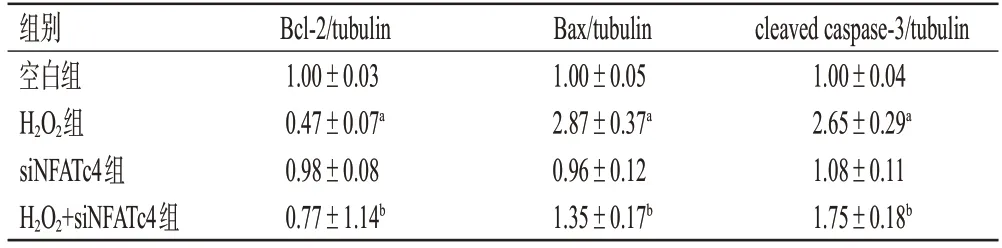
表4 干扰核蛋白NFATc4表达对细胞凋亡相关蛋白表达的影响(±s,n=3)
a:与空白组比较,P<0.05;b:与H2O2组比较,P<0.05。
组别空白组H2O2组siNFATc4组H2O2+siNFATc4组cleaved caspase-3/tubulin 1.00±0.04 2.65±0.29a 1.08±0.11 1.75±0.18b Bcl-2/tubulin 1.00±0.03 0.47±0.07a 0.98±0.08 0.77±1.14b Bax/tubulin 1.00±0.05 2.87±0.37a 0.96±0.12 1.35±0.17b
4 讨论
氧化应激在包括缺血/再灌注损伤、心脏肥大和心力衰竭等在内的心脑血管疾病中起重要作用,过氧化物的水平是衡量氧化应激严重程度的重要因素,清除过氧化物对改善心脑血管疾病具有重要意义[13]。ROS、MDA等过氧化物是氧化应激导致心肌损伤的重要介质;相反,抗氧化酶SOD、CAT则可通过清除过氧化物、抑制脂质过氧化反应等方式来缓解氧化应激、减少心肌损伤,是部分药物改善心脑血管疾病的重要途径[14]。H2O2是氧化应激反应的重要产物,常被用作体外氧化应激损伤的诱导剂,可激活线粒体凋亡途径而使存活细胞明显减少[10]。本研究结果显示,在H2O2的刺激下,H9c2细胞的MDA、ROS水平均显著升高,SOD、CAT水平则显著下降;100、150 μmol/L的芒果苷能显著增强细胞中SOD、CAT活性,有效抑制ROS的生成并降低MDA水平;同时,100、150 μmol/L的芒果苷还可使H2O2诱导的H9c2细胞的相对存活率显著升高,提示芒果苷对H2O2诱导的氧化应激有一定的抑制作用,这与已有研究结果基本一致[15]。
心力衰竭是多种心脏疾病的终末阶段,心肌细胞丢失在促进心力衰竭发展中起重要作用,而氧化应激导致的凋亡是造成心肌细胞丢失的重要原因[16]。研究指出,凋亡相关蛋白参与了不同途径介导的细胞凋亡过程:Bcl-2能与Bax和其他凋亡蛋白结合,Bcl-2表达减少和Bax表达增加是线粒体稳态失衡的主要标志,可反映出细胞凋亡水平的明显升高[17];通常情况下,Bcl-2/Bax比例的下降可导致caspase-3活化,活化的caspase-3(即cleaved caspase-3)进入细胞核后可激活核酸内切酶,导致DNA断裂,最终促进细胞凋亡发生[18—19]。为此,本研究检测了芒果苷对H2O2诱导的H9c2细胞中凋亡相关蛋白Bcl-2、Bax、cleaved caspase-3表达的影响。结果显示,在H2O2刺激下,细胞中抗凋亡蛋白Bcl-2的表达显著下调,而促凋亡蛋白Bax的表达则显著上调,cleaved caspase-3蛋白的表达亦显著升高;经100、150 μmol/L的芒果苷干预后,上述蛋白的表达均被逆转,表明细胞凋亡被芒果苷抑制。这提示芒果苷抗H2O2致细胞氧化应激损伤的作用可能是通过提高抗凋亡蛋白水平、降低促凋亡蛋白水平,从而抑制细胞凋亡来实现的。
NFATc4是重要的转录因子,在被钙调磷酸酶激活后转位入核,参与促进肥大基因、炎症相关因子表达并促进氧化应激、线粒体生成等多种生理病理过程[20]。研究指出,除调节肥大基因表达等经典功能外,NFATc4还可通过多种途径参与凋亡过程,包括提高肿瘤坏死因子α水平、促进凋亡蛋白表达等[21]。本研究结果显示,在H2O2作用下,核蛋白NFATc4的表达显著上调并伴有过氧化物ROS、MDA水平的升高,抗氧化酶SOD、CAT水平的下降和促凋亡蛋白Bax表达的增加;经100、150 μmol/L的芒果苷干预后,细胞中上述指标的分泌/表达均被逆转。
RNA干扰是改变蛋白表达的重要方式,本研究通过转染干扰序列干扰NFATc4的表达,结果显示,核蛋白NFATc4的表达明显下调,提示转染成功;经H2O2刺激后,H2O2+siNFATc4组细胞的ROS、MDA水平和Bax、cleaved caspase-3蛋白的表达均显著降低/下调,SOD、CAT水平和Bcl-2蛋白的表达均显著升高/上调,提示NFATc4蛋白的核内水平与H2O2诱导的氧化应激、细胞凋亡密切相关。结合前文结果,芒果苷能显著抑制NFATc4蛋白入核,这一作用可能是该成分改善H2O2致细胞氧化应激水平和减少凋亡的基础,但上述结论尚需进一步研究予以验证。
综上所述,芒果苷能够减轻H2O2诱导的H9c2细胞氧化应激,减少细胞凋亡,抑制NFATc4蛋白入核,进而缓解心肌细胞损伤;降低NFATc4蛋白的核内水平与减少H2O2诱导的氧化应激、细胞凋亡有关。芒果苷对心肌细胞具有良好的保护作用,在改善心脏疾病领域可能具有进一步开发的潜力。
