超高效液相色谱-串联质谱法测定花椰菜中氯虫苯甲酰胺和多杀霉素的残留
2023-10-27崔家榕董丰收吴小虎潘兴鲁郑永权
崔家榕,董丰收,徐 军,吴小虎,潘兴鲁,郑永权
(1.天津农学院园艺园林学院,天津 300384;2.植物病虫害综合治理全国重点实验室,中国农业科学院植物保护研究所,北京 100193)
花椰菜(Brassica oleracea var.botrytis Linnaeus)是十字花科、芸薹属植物野甘蓝的变种,在我国广泛种植[1]。在花椰菜种植期间,斜纹夜蛾、甜菜夜蛾、小菜蛾等害虫的发生频率高,为害损失大[2-6]。氯虫苯甲酰胺(Chlorantraniliprole,CAP)属双酰胺类杀虫剂,通过激活昆虫靶标中的鱼尼丁受体,使细胞内外的钙离子失衡,影响肌肉收缩[7],该产品对鳞翅目害虫的控制效果好、持效期长[8-9],对花椰菜田小菜蛾幼虫具有良好的防治效果[10]。多杀霉素(Spinosad)又称多杀菌素,活性成分为多杀霉素A和多杀霉素D组成的混合物,是刺糖多孢菌在培养介质下经有氧发酵后产生的次级代谢产物,是一种大环内酯类无公害的高效生物杀虫剂,作用于昆虫的乙酰胆碱受体,可以使靶标昆虫如鳞翅目幼虫、蓟马和食叶性甲虫迅速死亡[11-12]。将氯虫苯甲酰胺和多杀霉素进行混配,可有效防治花椰菜生产中的常见虫害,保证花椰菜的产量和品质[13-14]。但是,由于农药滥用或不规范施用,可能导致两种农药在花椰菜中残留超标,对人类健康产生潜在威胁。所以,开发花椰菜中氯虫苯甲酰胺和多杀霉素的残留分析方法对监督和规范这两种杀虫剂在花椰菜上的使用和保障农产品安全具有重要意义。
根据GB 2763—2021《食品安全国家标准食品中农药最大残留限量》[15]规定,氯虫苯甲酰胺和多杀霉素在花椰菜中没有制定具体限量规定,仅制定了其组限量,氯虫苯甲酰胺即在芸薹属类蔬菜(芥蓝、菜薹除外)的最大残留限量为2 mg/kg,多杀霉素在芸薹属类蔬菜的最大残留限量为2 mg/kg。关于多杀霉素和氯虫苯甲酰胺的残留检测方法有高效液相色谱法[16-17]、免疫法[18]以及超高效液相色谱质谱联用法[19-20]。其中有有关对花椰菜中氯虫苯甲酰胺、多杀霉素残留的单一农药残留的检测分析的研究报道[21-24],但对多杀霉素和氯虫苯甲酰胺在花椰菜上的同时检测方法还未见报道。检测方法的更新迭代,制约着花椰菜中农药残留监测的效率。其中,QuEChERS前处理方法具有迅速、简单、廉价、有效、稳定、安全的优点[25]。本研究采用QuEChERS前处理方法,结合UPLC-MS/MS技术,建立了同时测定花椰菜中氯虫苯甲酰胺和多杀霉素残留量的分析方法,并对北京和湖南2地田间花椰菜样品进行农药残留检测为花椰菜中氯虫苯甲酰胺和多杀霉素残留监测提供参考。
1 材料与方法
1.1 仪器和试剂
SCIEX TRIPLE QUAD 4500超高效液相色谱-串联三重四极杆质谱仪,美国AB SCIEX公司;CK-2000 高通量组织研磨仪,Thmorgan 公司;SI-0246漩涡混合器,美国Scientific Industries;TDZ5-WS台式高速离心机,湖南湘仪实验室仪器开发有限公司;BSA224S-CW电子分析天平(精确到0.01 mg),赛多利斯公司;PL601-L梅特勒电子天平(精确到0.1 g),梅特勒-托利多公司。
氯虫苯甲酰胺标准品(纯度97.28%),Dr.Ehrenstorfer;多杀霉素标准品(纯度99.6%,多杀霉素A与多杀霉素D的比例为77.1∶22.9),国家农药质量监督检验中心;10%多杀·氯虫苯甲酰胺悬浮剂,开封一田生物科技有限公司;乙腈(色谱纯),默克股份有限公司;乙腈、甲醇(分析纯),北京市通广精细化工公司;纯净水,广州屈臣氏食品饮料有限公司;N-丙基乙二胺(PSA)、十八烷基键合硅胶吸附剂(C18)、石墨化碳黑(GCB)和Filter Unit滤膜(0.22 μm),天津博纳艾杰尔科技有限公司;乙腈、无水硫酸镁和氯化钠(分析纯),国药集团化学试剂有限公司。
1.2 田间试验设计
试验分别在北京市和湖南省长沙市进行,设置空白对照区及试验区,每小区面积不少于50 m2。设置10%多杀·氯虫苯甲酰胺悬浮剂有效成分施药剂量为45 g/hm2,采用叶面喷雾施药1次。于施药后5、7 d,采用随机法采样。每个小区选取不少于12株无明显病虫害的花椰菜,随机采集两份至少2 kg的独立样品。花椰菜样品切成1 cm小块,缩分混匀后于-18℃保存备用,每份留样150 g。
1.3 分析方法
1.3.1 样品的前处理
称取10.0 g(精确到0.01 g)花椰菜基质于50 mL离心管中,加入10 mL乙腈(分析纯),1 300 r/min振荡10 min,加入3.0 g氯化钠,1 300 r/min振荡10 min,4 000 r/min离心5 min。取离心后上清液1.5 mL,转移至2 mL离心管(预装10 mg GCB+50 mg PSA+150 mg无水硫酸镁),涡旋匀浆3 min,5 000 r/min离心5 min,将上清用0.22 μm有机膜过滤后入瓶待测。
1.3.2 检测条件
色谱条件:AB Sciex 4500高效液相色谱质谱仪,Triple Quad 45 00 型色谱柱:ACQUITY UPLC HSS T3(50 mm×2.1 mm,1.8 μm,Waters公司)。流动相A为水溶液,B为乙腈,梯度洗脱(表1)。

表1 色谱梯度洗脱流动相组成表
质谱条件:电喷雾离子源(ESI+);多反应监测模式(MRM);离子化电压5 500 V;离子源温度550℃;喷雾气(GS1)0.41 MPa;辅助加热气(GS2)0.41 MPa。其他质谱参数见表2。
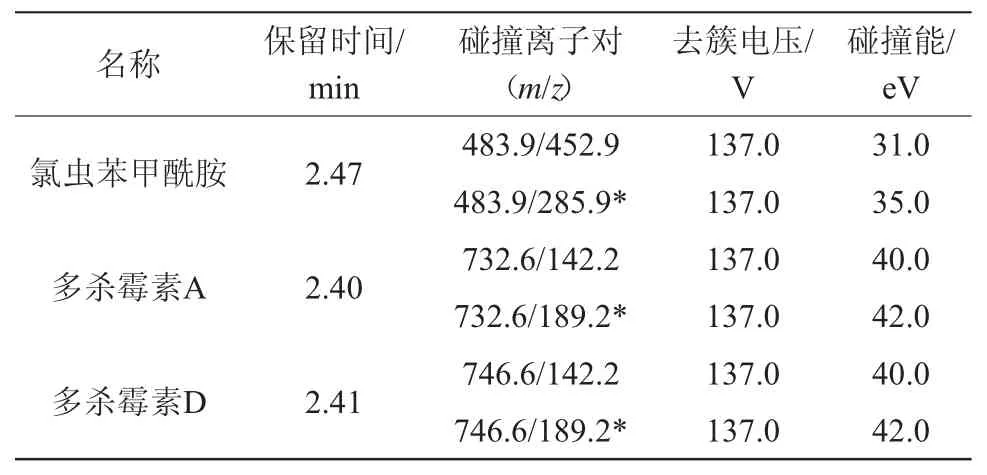
表2 氯虫苯甲酰胺、多杀霉素A 和多杀霉素D 的质谱检测参数
1.4 标准溶液配制及标准曲线绘制
分别称取适量的氯虫苯甲酰胺、多杀霉素标准品,用色谱纯乙腈溶解,配制成1 000 mg/L标准溶液,并等比例混合稀释得到100 mg/L混标溶液。取不含待测物的花椰菜样品,按1.3.1节的前处理方法制得空白基质溶液。将100 mg/L混标溶液用乙腈和花椰菜基质空白提取液稀释成0.05、0.1、0.2、0.5、1、2 mg/kg和5 mg/kg浓度的溶剂匹配标准工作溶液和基质匹配标准工作溶液,分别按1.3.2节的质谱条件进行测定,以质量浓度(x)为横坐标,定量离子峰面积(y)为纵坐标,绘制标准曲线。
1.5 方法的正确度和精密度测定
根据NY/T 788—2018《农作物中农药残留准则》规定,添加水平应包括农药最大残留限量MRL值和检测方法的定量限LOQ[26]。分别在花椰菜空白样品中添加氯虫苯甲酰胺标准溶液和多杀霉素标准溶液,添加质量浓度分别为0.05、2、5 mg/kg,每个添加水平5次重复,按照1.3.1节中的方法进行处理,并在1.3.2节中的色谱条件下测定。计算回收率和相对标准偏差。
1.6 基质效应分析
基质常常对分析物的分析过程有显著的干扰,基质效应(Matrix effect,ME)的存在会影响残留农药的定量分析,按式(1)计算ME[27]。
当ME>1.1时,为基质增强效应;ME<0.9时,为基质减弱效应,而当0.9<ME<1.1时,基质效应不明显[28]。
2 结果与分析
2.1 检测条件优化
选用水-乙腈分别配成不同体积比的流动相,反复进样筛选,得到不同的分离效果。经对比,当流动相为V水∶V乙腈=10∶90时,样品中氯虫苯甲酰胺、多杀霉素A和多杀霉素D 3种目标物与杂质有较好的分离效果,且目标化合物均在5 min内实现有效分离,保留时间分别为2.47、2.40 min和2.41 min(图1)。

图1 氯虫苯甲酰胺(a)、多杀霉素A(b)和多杀霉素D(c)的典型色谱图
为得到氯虫苯甲酰胺和多杀霉素的最佳仪器响应和分离效果,采用1 mg/L混合标准溶液作为工作溶液,在电喷雾离子源(ESI+)下进行全扫描(m/z 300~900)。结果表明:正离子扫描模式下氯虫苯甲酰胺、多杀霉素A和多杀霉素D的母离子峰明显且稳定,3种化合物均具有较好的电离效果。
2.2 方法的线性范围、基质效应和定量限
用溶剂标准溶液及基质匹配标准溶液进样得到的标准曲线来评估方法的线性范围及其相关性(表3)。在0.05~5 mg/kg范围内,氯虫苯甲酰胺和多杀霉素的线性关系良好(R2>0.99)。与溶剂中的标准品相比,基质可能影响目标化合物的电离,并降低或增强农药响应值,导致精密度和正确度降低。基质效应来源于基质中不易挥发的共洗脱成分与目标分析物在喷雾液滴转移到气态离子过程发生竞争,不同类型的农药、基质和样品前处理方式都可能对基质效应产生影响[29]。花椰菜中多杀霉素的两种组分多杀霉素A和多杀霉素D的ME值分别为1.99和1.77,具有基质增强效应。氯虫苯甲酰胺在花椰菜中的ME值为0.36,具有基质减弱效应(表3)。基质效应的差异可能与两种化合物的极性差异有关,极性较高的氯虫苯甲酰胺会集中在液滴的水相内部而不会留在表面,因此化合物的表面张力较低,倾向于产生更多的离子抑制[30]。本研究采用基质匹配标准溶液校正法对基质效应进行了补偿,以提高定量准确性。以最低添加水平确定定量限(LOQ),氯虫苯甲酰胺、多杀霉素A、多杀霉素D的LOQ分别为0.05、0.039 mg/kg和0.011 mg/kg。

表3 多杀霉素和氯虫苯甲酰胺的线性回归方程、相关系数、定量限和基质效应
2.3 方法的正确度与精密度
通过回收率试验评估方法的正确度和精确度。正确度用回收率来体现,精确度用不同重复之间回收率的相对标准偏差(RSD)来评估。在0.05、2 mg/kg和5 mg/kg 3个添加水平下,氯虫苯甲酰胺在花椰菜样品中的回收率为101.6%~106.9%,RSD为1.9%~4.3%;多杀霉素A的回收率为96.1%~105.7%,RSD为1.5%~7.9%;多杀霉素D的平均回收率为97.2%~106.8%,RSD为1.4%~8.4%(表4),根据我国农药残留试验准则,当添加浓度在0.01~0.1 mg/kg,回收率要求为70%~120%,RSD≤20%[26]。均符合农药残留测定的要求。结果表明检测方法正确度和精密度良好。
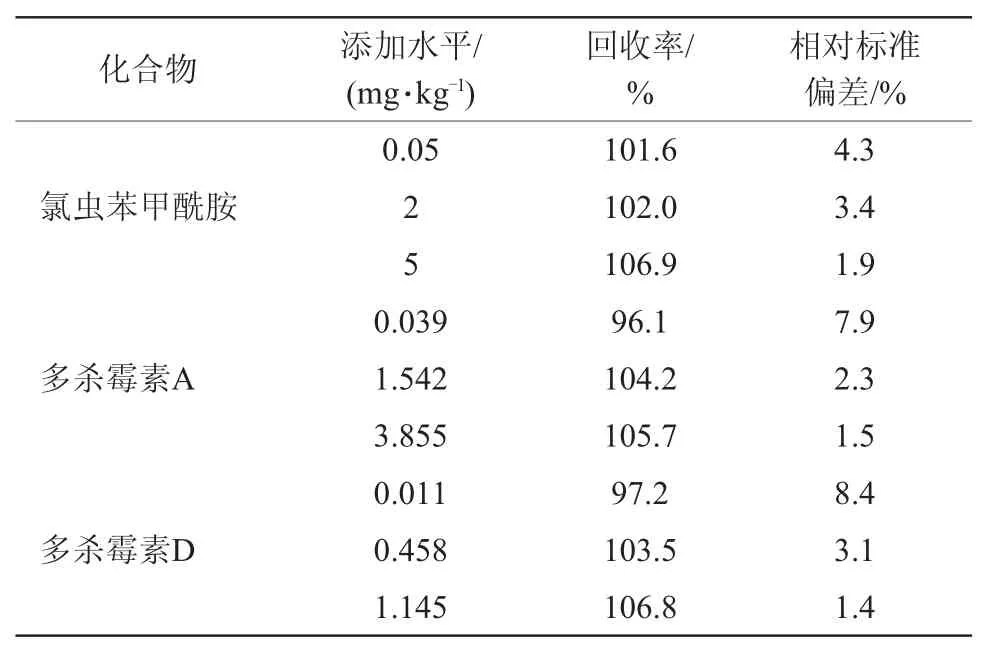
表4 花椰菜中氯虫苯甲酰胺、多杀霉素A 和多杀霉素D 的添加回收率及相对标准偏差
2.4 实际样品检测
利用1.3节中建立的方法,通过乙腈提取,UPLCMS/MS检测采集自北京市和湖南省长沙市2地的16份花椰菜样品中的氯虫苯甲酰胺和多杀霉素残留。结果发现,10%多杀·氯虫苯甲酰胺悬浮剂按推荐剂量(675 g/hm2),在花椰菜上施药5 d后,氯虫苯甲酰胺在花椰菜上的残留量为<0.05~0.70 mg/kg、多杀霉素A和多杀霉素D在花椰菜上的残留量<LOQ;距最后一次施药后7 d,氯虫苯甲酰胺、多杀霉素A和多杀霉素D在花椰菜上的残留量均<LOQ。
3 结论
建立了一种高效液相色谱-串联质谱检测花椰菜中氯虫苯甲酰胺和多杀霉素残留的分析方法。该检测方法在0.05~5 mg/L范围内,线性关系良好(R2>0.99)。在3个添加水平下,该方法正确性和精密度好,灵敏度高,能满足花椰菜中氯虫苯甲酰胺和多杀霉素残留的检测要求,对花椰菜中氯虫苯甲酰胺和多杀霉素残留量的同时检测具有一定的借鉴意义。与目前相关的标准及其他文献报道的氯虫苯甲酰胺或多杀霉素的检测方法相比,本试验将QuEChERS快速前处理技术应用于花椰菜中氯虫苯甲酰胺和多杀霉素的残留分析,确保了正确性和精密度,与Abhijit Kar等[31]所建立的方法相比,该方法简化了前处理过程,具有操作简便、检测结果准确等优点,可用于大批量的日常分析检测。
