改性Cu-Pd双金属电极电化学还原硝酸盐性能研究
2023-10-26刘吉明王永恒逯新宇
王 畅,刘吉明,王永恒,逯新宇
改性Cu-Pd双金属电极电化学还原硝酸盐性能研究
王 畅,刘吉明*,王永恒,逯新宇
(太原理工大学环境科学与工程学院,山西 太原 030024)
为揭示高盐废水中电催化还原硝酸盐氮的能力,采用阴极电沉积法成功制备了NF/CNTs/Cu-Pd双金属复合电极.通过SEM-EDS、XRD和XPS表征,证实CuPd纳米颗粒成功沉积在泡沫镍(NF)底板上.研究了电流密度、初始pH值、初始硝酸盐浓度和Cl-浓度等因素对模拟水中NO3--N、TN的去除能力的影响,并用实际高盐废水验证了其可行性.结果表明:没有Cl-存在情况下,NF/CNTs/Cu-Pd可有效去除NO3--N,但TN去除能力一般,NO3--N主要转化为NH4+-N.有Cl-存在作用下,NO3--N、TN得到有效去除.反应最佳条件为:电流密度30mA/cm2,初始pH值7,初始浓度50mg/L,氯离子浓度2.0g/L,此时NO3--N、TN去除率分别达到100%和97.2%.实际废水中溶解性有机物(DOM)会抑制NO3--N去除.DOM去除后,NO3--N去除率为95.5%,TN去除率达到85.6%.
硝酸盐还原;NF/CNTs/Cu-Pd电极;电沉积;高盐废水
NO3--N是生活污水、工业废水常见的无机污染物.高浓度NO3--N可引起水生生态系统的富营养化,其还原中间产物NO2--N也会对人类健康造成严重问题,由此引起众多学者关注,世界卫生组织已将NO3--N列为2A类致癌物[1].NO3--N去除的技术众多,如反渗透技术[2],吸附技术[3],电透析技术[4],微生物技术[5],光催化还原技术[6],化学催化还原技术[7],电催化还原技术[8]等.其中电催化还原NO3--N具有处理高浓度NO3--N的能力、无污泥产生、投资成本相对较低且易实施等优点,正成为一种非常有发展前景的处理技术[9].
电催化处理效果主要取决于电极材料.到目前为止,NO3--N电还原已经在很多种金属电极上进行了广泛研究,如Rh,Pt[10],Cu[11],Al,Ni,Fe[12],Ti[13]和Sn[14]等单一金属[15],Co3O4或钛阴极支撑Fe3O4[16]等二元金属[17],合金[18],金属配合物[19]和合成钻石[20].通常,双金属催化剂对NO3--N电催化的催化活性优于单金属催化剂.研究发现,铜改性的Pd[18]电极,Fe-Cu双金属[21],Pd-Cu/γAl2O3[22]比单一金属具有更高的NO3--N还原活性.当使用Cu/Pd双金属电极时,Cu是NO3--N转化为NO2--N的助催化剂,Pd是NO2--N转化为N2的助催化剂[23].因此,可以选择Pd和Cu来制备双金属复合电极,以获得较高的电催化反应动力学.虽然双金属催化剂表现出高效的NO3--N去除能力,但TN去除能力较低.而且,材料的不稳定性限制了其应用.
碳纳米管(CNTs)因其超高的机械强度,优异的电学性能,较大的比表面积和高长径比[24]已被证明是催化剂[25]的优秀载体.但关于CNTs/Cu-Pd对硝酸盐电化学还原的研究报道很少.本文利用电泳沉积法制备了镍/碳纳米管负载铜钯合金(NF/CNTs/ Cu-Pd)电极,通过表征方法评价了材料性能,研究了电催化硝酸盐还原的影响因素和机理,并通过实际高盐废水验证了NF/CNTs/Cu-Pd电催化硝酸盐和总氮的去除能力.研究结果可为NF/CNTs/Cu-Pd电催化NO3--N还原在实际高盐废水中的应用提供理论支持.
1 材料和方法
1.1 化学品和材料
1.1.1 材料预处理 PdCl2、CuCl2、硝酸钠、氯化钠、硫酸钠等均购自国药化学试剂有限公司,所有药剂均为分析级,使用时未进一步纯化.泡沫镍(NF,厚度0.5mm,3cm´4cm,孔隙率³98%)电沉积前进行了预处理,首先浸泡在丙酮中超声脱脂处理30min,然后在1mol/L盐酸中浸泡10min以去除表面氧化物,最后用大量的超纯水冲洗3遍.
多壁碳纳米管(CNTs)购自先丰纳米材料科技有限公司,直径10~20nm,长度10~30μm,使用前在H2SO4/HNO33:1(/)混合溶液中于60℃下超声处理7h,然后引入羧酸基进行化学氧化浓缩预处理,以促进其在水溶液中能更好地分散[26].处理后的碳纳米管保存在100mL容量瓶中(2mg/mL),进一步稀释(1mg/mL)后用于电泳沉积.
1.1.2 电极材料制备 电极材料制备参考文献[27]并略做改动.具体为:电泳电压10V/cm,电解液为预处理后的CNTs (1mg/mL),预处理后的NF作为阳极,同等面积的石墨板作为阴极,平行放置,间距控制在3cm,电泳沉积持续20min.沉积完的NF于60℃下干燥3h,得到NF/CNTs电极.电沉积实验在电化学工作站(CHI 660D,上海,中国)上进行,以NF/CNTs为工作电极,铂片为对电极,饱和甘汞电极为辅助电极.电沉积电解液由5mmol/L CuCl2、5mmol/L PdCl2、0.5mol/L NaCl和1g/L聚乙烯吡咯烷酮组成.在-700mV条件下进行恒电位沉积7min,得到的样品在60℃下真空干燥12h,形成NF/CNTs/Cu-Pd.为对比不同材料性能,制备了NF/Cu、NF/Pd和NF/Cu-Pd电极材料,制备过程参照上述过程,主要区别是未沉积CNTs,同时电解液按目标产物进行了相应调整.
1.2 电极材料表征和电化学测试
电极的形貌采用SEM(Tescan MIRA LMS,捷克)进行分析,并配备EDX分析仪进行元素分析.XRD (Panalytical Empyrean,荷兰)用于检测微观结构.XPS(Thermo Scientific K-Alpha,美国)用于研究材料化学成分.此外,利用CHI660E电化学工作站对常规三电极玻璃电池进行了LSV、CV和EIS测试,工作电极为4cm´3cm的NF/CNTs/Cu-Pd电极,对电极为等面积的Ir-Ru/Ti电极,参比电极为饱和甘汞电极(SCE).
1.3 电化学NO3--N还原实验和测定方法
电化学NO3--N还原实验在300mL的电解池中进行.电解实验使用200mL 50mg/L的NO3--N溶液,加入0.05mol/L Na2SO4以提高电解质的电导率.NF/CNTs/Cu-Pd电极作为阴极,Ir-Ru/Ti电极作为阳极,极板间距为3cm.NO3--N浓度采用紫外分光光度法测定,NO2--N浓度采用N-(1-萘基)-乙二胺光度法测定、NH4+-N浓度采用纳氏试剂分光光度法测定、TN的浓度由TOC分析仪测定.NO3--N去除率、NH4+-N生成率、TN去除率 (TN包括NO3--N和NO2--N、NH4+-N之和)和N2选择性根据公式(1)~(4)计算.
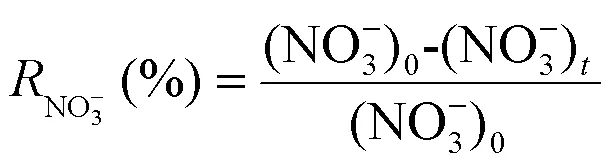

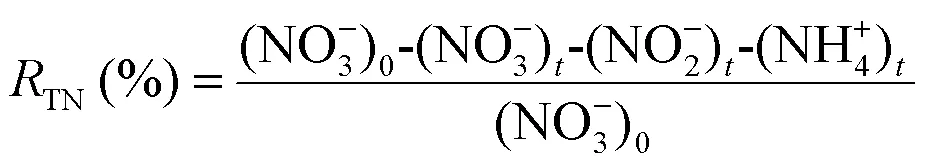
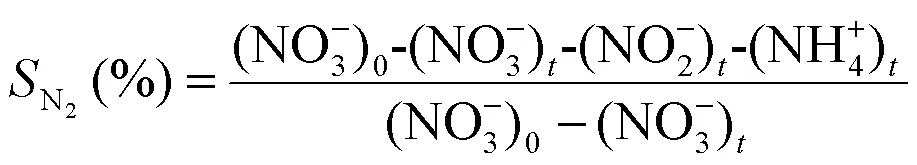
式中:下标0和分别表示初始状态和反应时刻的浓度.
翠姨很喜欢我,因为我在学堂里念书,而她没有,她想什么事我都比她明白。所以她总是有许多事务同我商量,看看我的意见如何。
2 结果与讨论
2.1 材料表征和电化学测试
2.1.1 SEM-EDS表征 采用扫描电镜对NF/Cu- Pd和NF/CNTs/Cu-Pd的微观形貌进行了表征.图1(a)和(c)为NF基底的大孔分布,图1 (b)为NF/Cu-Pd上形成的一些较大的团聚体,图1(e)显示NF/CNTs/ Cu-Pd纳米颗粒分散而均匀.可以看出,没有CNTs的存在,Cu-Pd很容易团聚,不易暴露其活性位点.而CNTs在经过酸性处理后产生了丰富官能团,并且由于其具有的纳米限域效应,使得Cu-Pd保持了高度分散状态,从而暴露出更多活性位点.通过SEM- EDS对电极材料元素组成进行分析,从图1(c)和(f)可以看出,Cu、Pd均成功的沉积在NF表面.检测到的化学元素中,Cu、Pd的元素百分比分别为0.86和0.88,含量基本接近1:1,表明溶液中的组分有效地进行了沉积.

图1 NF/Cu-Pd和NF/CNTs/Cu- Pd电极的SEM、EDS分布图谱

图2 不同电极的XRD图
2.1.2 XRD图 通过XRD分析了NF、NF/Cu、NF/Pd、NF/Cu-Pd、NF/CNTs/Cu-Pd电极的表面晶体结构.由图2可以看出,所有材料在44.3°,51.6°和76.2°处都出现衍射峰,显示出NF组分的111、200和220面的特征峰(JCPDS Card No.40-0850). NF/Cu、NF/Cu-Pd、NF/CNTs/Cu-Pd都出现了43.2°处的衍射峰,这是Cu(JCPDS Card No.99-0034)[28]的111面衍射峰.NF/Pd、NF/Cu-Pd、NF/CNTs/Cu-Pd还在40.3°和45.4°处出现了属于Pd的111和200晶面衍射峰(JCPDS Card No.46-1043).表明Cu、Pd均有效地沉积在NF表面,这与SEM-EDS的结果一致.
2.1.3 XPS图 利用XPS分析了NF表面沉积的Cu、Pd元素价态,如图3所示.图3(a)显示了NF/Cu-Pd的Cu2p谱图,共出现6处特征峰.其中951.99和932.19eV分别对应于Cu02p1/2和 Cu02p3/2的电子结合能, 954.65和934.78eV分别对应于Cu2+2p1/2和Cu2+2p3/2的电子结合能,962.56和 942.76eV分别对应于Cu2+2p1/2和 Cu2+2p3/2的电子结合能,表明存在CuO.在图3(b) Pd 3d 图谱中存在4个特征峰,其中339.71和334.60eV分别对应于Pd03d3/2和 Pd03d5/2的电子结合能,341.45和336.30eV分别对应Pd2+3d3/2和Pd2+3d5/2的电子结合能.这些峰表明PdO和PdCl2的存在.Cu2+和Pd2+的产生可能是Cu、Pd纳米粒子在制备和干燥过程中被空气氧化的结果.相比之下, NF/CNTs/Cu-Pd的Cu和Pd的结合能(图3(c)和图3(d))与NF/Cu-Pd的结合能基本相同,说明碳纳米管的引入并未导致Cu和Pd的结合能变化[27].此外,根据拟合峰的面积计算了Cu和Pd的比值.NF/Cu-Pd的Cu0和Pd0的比值(23.32%,54.24%)与NF/CNTs/Cu-Pd (17.93%, 41.97%)基本相同,再一次证明了Cu、Pd有效地沉积到NF基底.

图3 NF/Cu-Pd和NF/CNTs/Cu-Pd电极的Cu2p和Pd3d的XPS光谱

图4 电极LSV和CV曲线
测试条件为0.05mol/L Na2SO4+0.036mol/L NaNO3,10mV/s. ∆的计算方法是用0.05mol/L Na2SO4+0.036mol/L NaNO3测量的电流密度减去用0.05mol/L Na2SO4测量的电流密度
2.1.4 电化学测试 对NF、NF/Pd、NF/Cu、NF/Cu-Pd和NF/CNTs/Cu-Pd等复合材料进行一系列LSV和CV曲线测试,研究不同电极上NO3--N电还原的LSV和CV曲线,具体结果见图4.由图4(a)可以看出,NF与NF/Pd几乎没有出现峰,表明几乎没有NO3--N电还原能力.与之相比,NF/Cu、NF/Cu-Pd和NF/CNTs/Cu-Pd电极有明显的峰电流,表明Cu的引入,促进了硝酸盐的吸附和降解.在相同电位下,NF/Cu-Pd电极的电流密度高于NF/Cu电极和NF/Pd电极,说明NF/Cu-Pd在低电位下就具有降解溶液中NO3--N的能力.而NF/CNTs/Cu-Pd电极具有比NF/Cu-Pd更高的峰电流,这说明在NF基底和Cu-Pd双金属之间引入CNTs之后活性表面积增加,从而进一步提高了双金属的电还原活性.图4(b)展示了不同阴极电催化反硝化的氧化还原过程.可以看出,与LSV曲线类似,NF与NF/Pd电极的CV曲线未出现明显的还原峰,-1.3V之后快速的下降是产氢(HER)的结果,而NF/Cu、NF/Cu-Pd和NF/CNTs/ Cu-Pd电极在-0.4~-1.1V之间出现密集的还原峰,这是由硝酸盐还原引起的.呈现出的负漂移,表明还原能力逐渐增强,产生了更多的氨[31],这与图4(b)的结果一样,也与LSV测试结果一致.
此外,本文还对NF、NF/Pd、NF/Cu、NF/Cu-Pd和NF/CNTs/Cu-Pd等复合材料进行了EIS测试,具体结果如图5所示.可以看出,NF/CNTs/Cu-Pd泡沫电极的奈奎斯特图的弧曲率小于NF泡沫电极的弧曲率.这表明,在NF/CNTs/Cu-Pd电极上,界面电荷转移到电子受体的速率比在NF电极上更快[30].说明Cu-Pd双金属以及碳纳米管的引入降低了电阻,加速了NF/CNTs/Cu-Pd界面上的电子转移.
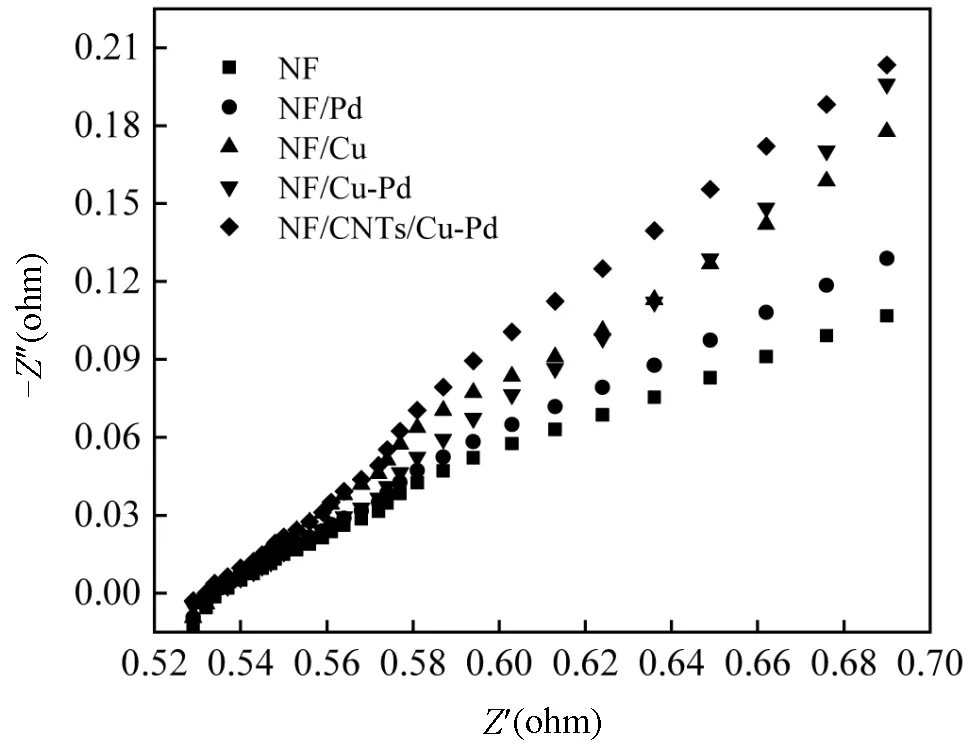
图5 电极EIS曲线图
2.2 影响因素分析
2.2.1 不同阴极对硝酸盐还原的影响 通过电解池反应器,以0.05mol/L Na2SO4为电解质,电流密度设为30mA/cm2,测试了NF/Cu、NF/Pd、NF/Cu-Pd、NF/CNTs/Cu-Pd电极对50mg/L的NaNO3还原的影响,结果如图6所示.可以看出,NF降解NO3--N的能力较弱,360min后仅能去除20%.NF/CNTs/Cu-Pd和NF/Cu-Pd的电催化NO3--N能力优于NF/Cu和NF/Pd,表明双金属的协同作用优于单原子作用,这是因为在双原子体系中,Cu的作用是将NO3--N转化为NO2--N,而Pd的作用是将NO2--N转化为N2或NH4+-N.NF/CNTs/Cu-Pd的电催化NO3--N能力较NF/Cu-Pd更强,说明CNTs更好的分散了Cu、Pd,暴露更多活性位点,因此后续实验选用NF/CNTs/ Cu-Pd研究不同影响因素降解NO3--N还原能力.

图6 不同阴极的硝酸盐去除率
2.2.2 电流密度的影响 电流密度对硝酸盐还原的影响评价在电解池中进行,NO3--N初始浓度50mg/L,pH=7,电流密度从10mA/cm2逐渐增加到30mA/cm2,反应时间6h,NO3--N去除率、NH4+-N生成率和TN去除率结果见图7.从图7可以看出,电流密度为10mA/cm2,NO3--N去除率就可以达到75.5%.随着电流密度的增加,NO3--N去除率进一步提高.当增大到30mA/cm2,NO3--N的去除率可以提高到94.4%,这是由于电流密度的增大加速电子转移的结果[29].类似地,当电流密度为10mA/cm2时,NH4+-N生成率为51.7%,TN去除效率为25.4%,而当电流密度达到30mA/cm2,NH4+-N生成率为56.9%,TN去除率增至43.3%.表明会有50%以上的N源转化为NH4+-N,而TN去除率是NO3--N减少和NH4+-N增加累积的结果.同时,硝酸盐的电还原被证明遵循伪一级动力学模型(表1),相应的反应速率常数从10mA/cm2时的0.004h-1显著增加到30mA/cm2下的0.009h-1. 需要说明的是NO2--N在整个实验过程中均未检出.
2.2.4 初始浓度的影响 不同NO3--N初始浓度对NO3--N还原也会产生影响,因此改变NO3--N初始浓度分别为25.0 , 50.0 , 75.0和100.0mg/L, pH=7 ,电流密度30mA/cm2,反应控制在6h,探讨不同初始浓度对NO3--N还原、NH4+-N生成、TN去除的影响,结果见图9.可以看出,不同初始NO3--N浓度下NO3--N都保持了较高的去除率,6h的NO3--N去除率分别为95.4%、94.4%、95.2%和93.8%.随着初始浓度的增加,NO3--N的去除率略微降低,这可能是由于NO3--N在电极表面的吸附所致.NO3--N浓度越低,反应产物生成越少,对电极表面NO3--N吸附的影响较小.此外,在NO3--N浓度较高的情况下,NO3-主导了阴极表面阴离子的吸附,其他离子如H+、NH4+的竞争吸附可以忽略[15].因此,NO3--N初始浓度为100.0mg/L时,仍能获得显著的去除率.同时,硝酸盐的电还原被证明遵循伪一级动力学模型(表1).NH4+-N的转换率随着NO3--N初始浓度的增大而上升.由于 NO3--N在初始浓度较高时其去除率较低,故TN在NO3--N初始浓度较高时其去除率也较低.

图8 初始pH值对NO3--N去除,NH4+-N生成,TN去除和NO3--N的伪一阶动力学模型的影响
2.2.5 氯离子浓度的影响 从上述影响因素实验可以看出,NO3--N电还原是一个复杂的过程,产物并不能完全转化为N2,有相当数量的产物为NH4+-N.为探讨TN的去除能力,研究Cl-浓度对NO3--N去除、NH4+-N生成和TN去除的影响.在阳极区电解过程中,通过直接失去电子,大量的Cl-最终在阳极表面被氧化成Cl2或HClO.游离氯,即Cl2、HClO等,具有较强的氧化能力,可通过氯化反应[9,28]将NH4+-N氧化成N2(式(5)~(7)).实验研究了不同NaCl初始浓度(分别为0.5, 1.0, 1.5和2.0g/L)加入到200mL 50mg/L NO3--N溶液中,电流密度为30mA /cm2, pH=7 ,反应6h ,结果见图10.可以看出,随着Cl-浓度的增加,NO3--N去除率逐渐提高,零Cl-投加时,NO3--N去除率为94.4%,NH4+-N生成率为56.9%,TN去除率为43.3%,当Cl-浓度增加到2.0g/L时,NO3--N去除率增加至100%,NH4+-N经过2h左右的积累后逐渐降低,生成率降低至1.4%,TN去除率增加至97.2%.这是因为NH4+的减少促进了催化位点再次暴露于反应物中,从而使NO3--N的去除增加.高浓度的Cl-能产生足够的HClO,使得NH4+-N减少,从而TN的去除率得到极大提高.同时硝酸盐的电还原被证明遵循伪一级动力学模型(表1),相应的反应速率常数从0g/L Cl-时的0.009h-1显著增加到2.0g/L Cl-下的0.0177h-1,再一次证明Cl-的加入对NO3--N和TN的去除有积极的促进作用.
2Cl-→Cl2+2e-(5)
Cl2+H2O→HClO+H++Cl-(6)
HClO+NH4+→N2+H2O+H++Cl-(7)
2.2.6 初始DOM浓度的影响 为探究类腐殖酸类物质(DOM)对电催化硝酸盐还原的影响,选择腐殖酸作为DOM代表物.改变腐殖酸浓度0g/L、0.5g/L和1.0g/L, NO3--N初始浓度50mg/L,电流密度30mA/ cm2, pH=7, Cl-浓度1.0g/L,研究类腐殖酸对NO3--N去除、NH4+-N生成和TN去除的影响,结果见图11.随着腐殖酸的浓度由0g/L增加到1.0g/L, NO3--N的去除率由97.0%降至46.4%,TN的去除率由89.3%降至21.3%,这是因为腐殖酸可以容易地吸附在Cu/Pd原子上或与Cu/Pd离子络合,从而减少了活性位点的数量[32],与NO3--N的去除产生竞争作用,同时腐殖酸的浓度过高也会影响NH4+-N的去除,说明腐殖酸更容易与HClO反应而消耗,导致氯化反应无法进行,抑制氨氮的氧化,从而使TN去除率降低.
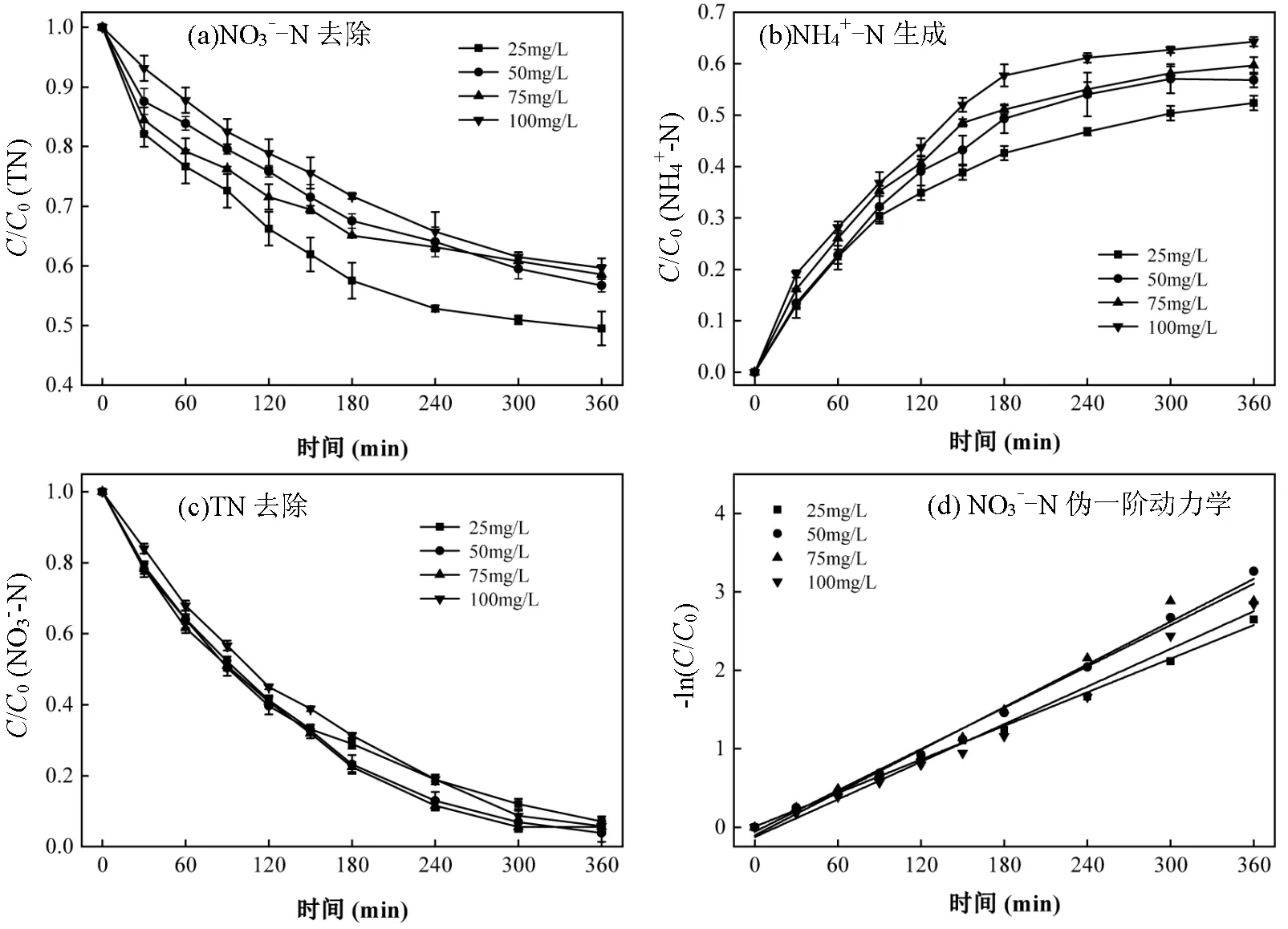
图9 初始NO3--N浓度对NO3--N去除,NH4+-N生成,TN去除的影响和NO3--N的伪一阶动力学模型

图10 氯离子浓度对NO3--N去除,NH4+-N生成,TN去除的影响和NO3--N的伪一阶动力学模型
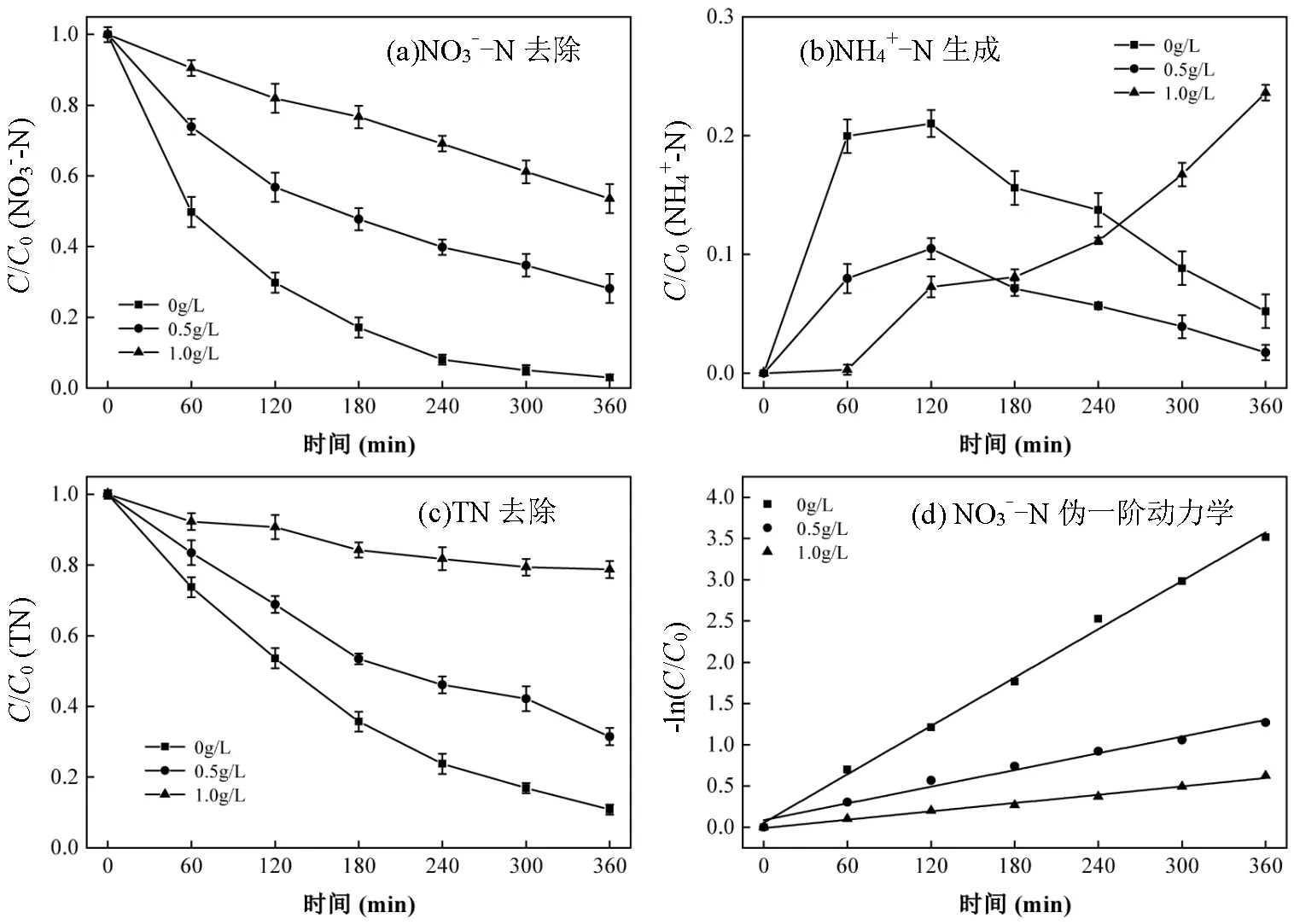
图11 DOM浓度对NO3--N去除,NH4+-N生成,TN去除的影响和NO3--N的伪一阶动力学模型
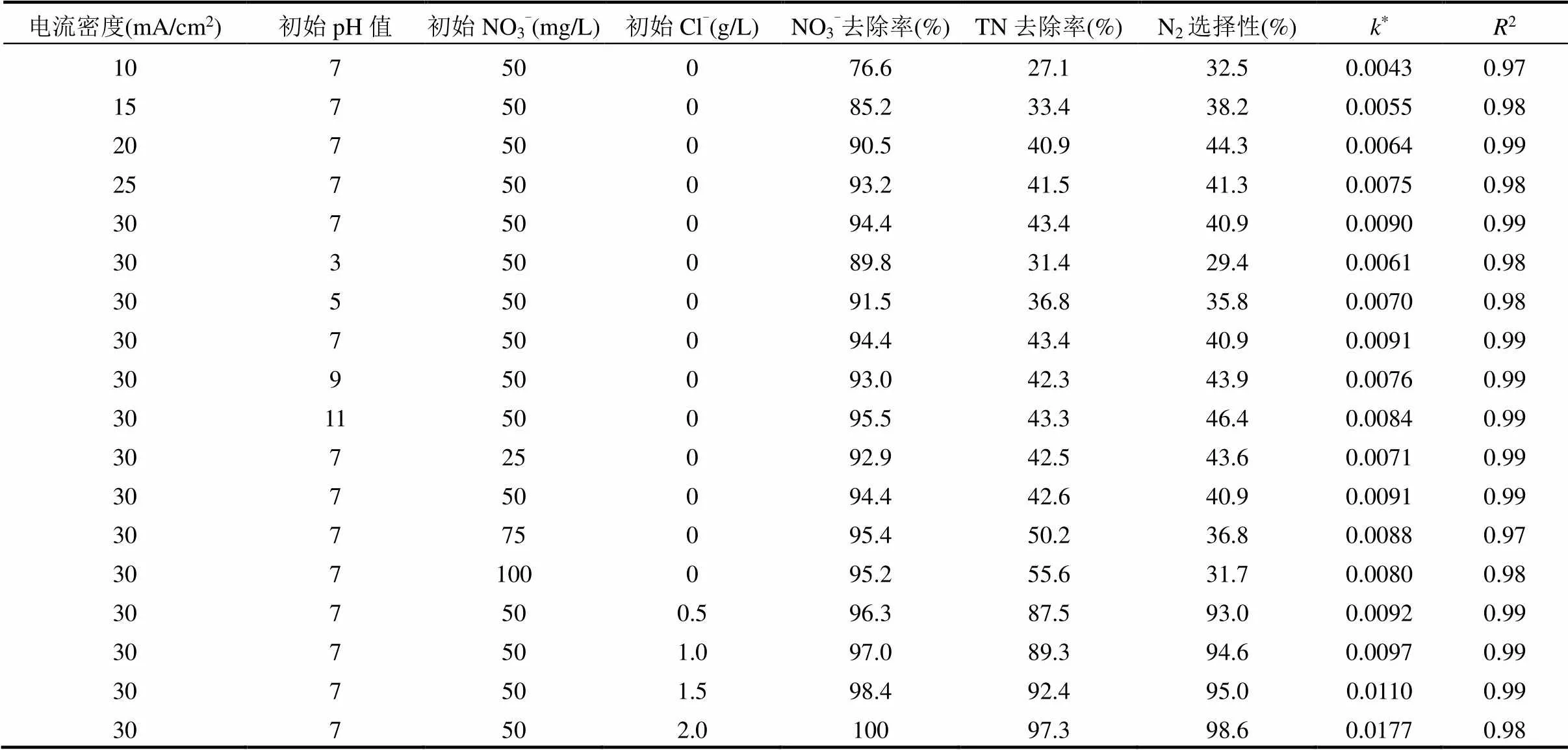
表1 不同条件下电化学去除硝酸盐性能分析
注:为硝酸盐还原伪一阶动力学速率常数,min-1.
2.2.7 电极的可重复性 在给定的条件下,选择3个制备好的NF/CNTs/Cu-Pd电极分别进了5个循环的硝酸盐还原实验,由图12可以看出,经过5次循环使用后,NO3--N去除率和TN去除率仍达85.0%,表明NF/CNTs/Cu-Pd电极材料具有良好的稳定性.
为进一步理清不同反应条件下的NO3--N、NH4+-N和TN去除情况,汇总实验数据见表1.反应最佳条件为:电流密度30mA/cm2,pH=7,初始浓度50mg/L,氯离子浓度2.0g/L,去除情况见图13.此时,NO3--N去除率为100%,NH4+-N生成率为1.4%,TN去除率为97.2%,NO2--N未检出,N2选择性为98.6%.

图12 电极材料稳定性重复实验
反应条件为200mL50mg/L NO3--N,1.0g/L Cl-,中性pH值
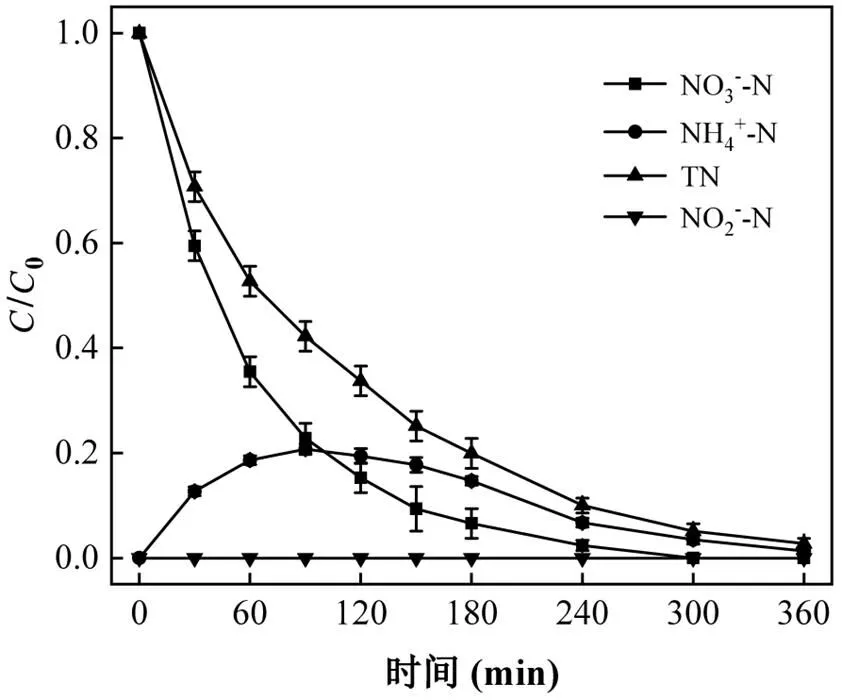
图13 最佳条件下NO3--N、NH4+-N和TN的转化
2.3 淬灭研究
为了进一步证实硝酸盐电催化还原过程中自由基的特异性贡献,本文选用自由基清除剂叔丁醇(TBA)和HCO3-.HCO3-可以清除HO•,Cl•,和Cl2•-,但不能清除ClO•,TBA可以清除HO•,Cl•和ClO•,但不能清除Cl2•-[33].图14(a)显示了HCO3-和TBA对NO3--N还原的抑制作用,在2mmol/L TBA和100mmol/L HCO3-的存在下,NO3--N的还原速率无明显变化.说明自由基对NO3--N的还原贡献不大,NO3--N的还原主要以阴极的表面还原为主.图14(b)显示了HCO3-和TBA对NH4+-N转化的影响,TBA的加入对NH4+-N的转化也无明显影响,HCO3-的加入对NH4+-N转化的影响在5%左右,说明NH4+-N的转化以氯化反应为主.
2.4 降解机理分析
根据实验结果及参考文献,推断反应机理如下:首先,NO3--N在Cu阴极作用下还原为NO2--N (式(8)).但由于NO2--N不稳定,它被直接转化为NH4+-N和N2(式(11)~(12)).在Cl-存在的情况下,氯在水溶液中通过水解反应形成HClO,HClO具有较强的氧化能力,通过氯化反应将NH4+-N氧化成N2(式(7)).值得注意的是,一些NO3--N在阴极处被直接地还原为N2(式(9)~(10)).因此,整个过程包括对NO3--N的阴极还原和NH4+-N的氯化反应,实现了TN的完全去除.



2.5 实际废水中的应用
为进一步探讨NF/CNTs/Cu-Pd电极材料在实际废水中的NO3--N还原能力,取山西省某焦化废水厂二沉池出水,开展实际废水研究.经测定NO3--N的浓度为64mg/L,氯离子浓度1.0g/L左右,初始TOC 23.69mg /L,主要为类腐殖酸类物质(DOM).同时取经过UV/电催化预处理后,难降解有机物降解后的废水进行了对比,此时TOC 3.54mg/L.结果如图15所示,对于原废水,6h后NO3--N的去除率为56.0%, NH4+-N约为3%,NO2--N未检出,TN去除率约为45.0%,这说明类腐殖酸等溶解性有机物的存在会抑制NO3--N和TN的去除能力,原因在于其可以容易地吸附在Cu/Pd原子上或与Cu/Pd离子络合,从而减少了活性位点的数量.而对于NH4+-N浓度反应完成后基本不再存在,说明活性氯的作用基本实现了完全去除.对于UV/电催化预处理的废水,经过6h处理后,NO3--N的去除率显著提高至95.5%,NH4+-N的生成率不到1.0%,NO2--N同样未检出,TN的去除率接近85.6%,这可能是由于实际焦化废水中含有少量的有机氮未被去除.以上表明NF/CNTs/Cu-Pd电极在实际高盐废水中对NO3--N和TN的去除都有较好的效果.
电流密度为50mA/cm2,反应时间为6h
3 结论
3.1 CNTs引入增加了材料导电性,同时增加了Cu/Pd双金属材料的稳定性和分散性,从而获得了更多的活性位点,使得NO3--N的还原能力增强.与NF/Cu-Pd电极相比,NO3--N去除率从77.63%增加到94.4%.
3.2 增加电流密度有利于NO3--N的去除和TN的去除.酸性条件存在产氢和NO3--N还原的竞争,不利于NO3--N和TN的去除.
3.3 Cl-的存在不仅在一定程度上促进了NO3--N的转化,而且有利于NH4+-N向N2的转化,从而使得TN去除能力显著提高.
3.4 通过淬灭实验得出硝酸盐的去除以阴极的表面还原为主,氨氮的转化以氯化反应为主.
3.5 实际废水中DOM会抑制NO3--N的降解,而DOM去除后的高盐实际废水中NO3--N和TN都能得到有效去除.
[1] Yao F B, Jia M C, Yang Q, et al. Highly selective electrochemical nitrate reduction using copper phosphide self-supported copper foam electrode: Performance, mechanism, and application [J]. Water Research, 2021,193:116881.
[2] 蓝 梅,董 萌,吴宏举.地下水硝酸盐氮污染原位修复研究进展 [J]. 工业水处理, 2015,35(8):15-17. Lan M, Dong M, Wu H J. Research progress in-situ remediation technology of groundwater nitrate nitrogen pollution [J]. Industrial Water Treatment, 2015,35(8):15-17.
[3] Song W, Gao B Y, Xu X, et al. Adsorption of nitrate from aqueous solution by magnetic amine-crosslinked biopolymer based corn stalk and its chemical regeneration property [J]. Journal of Hazardous Materials. 2016,304(0):280-290.
[4] Belkada F D, Kitous O, Drouiche N, et al. Electrodialysis for fluoride and nitrate removal from synthesized photovoltaic industry wastewater [J]. Separation and Purification Technology, 2018,204(0):108-115.
[5] 张鹏程,李晓玲,王晓婷,等.活性污泥体系中C/N/S对硝酸盐还原过程的影响 [J]. 中国环境科学, 2021,41(5):2117-2122. Zhang P C, Li X L, Wang X T, et al. Effect of C/N/S on nitrate reduction process in activated sludge system [J]. China Environmental Science, 2021,41(5):2117-2122.
[6] 刘 霞,石会龙,李成帅,等.g-C3N4/BiVO4光催化还原水中硝酸盐氮性能研究 [J]. 现代化工, 2022,42(12):215-220. Liu X, Shi H L, Li C S, et al. Study on photocatalytic reduction of nitrates-based nitrogen in water by g-C3N4/BiVO4[J].Modern Chemical Industry, 2022,42(12):215-220.
[7] Brian P C, John R S, Charles J W. The Selectivity and Sustainability of a Pd-In/gamma-Al2O3Catalyst in a Packed-Bed Reactor: The Effect of Solution Composition [J]. Catalysis Letters, 2009,130(1/2):56-62.
[8] Martinez J, Ortiz A, Ortiz I, State-of-the-art and perspectives of the catalytic and electrocatalytic reduction of aqueous nitrates [J]. Applied Catalysis B:Environmental, 2017,207:42-59.
[9] Xu H, Ma Y Y, Chen J, et al. Electrocatalytic reduction of nitrate-a step towards a sustainable nitrogen cycle [J]. Chemical Society Reviews, 2022,51(7):2710-2758.
[10] Yang J, Sebastian P, Duca M, et al. pH dependence of the electroreduction of nitrate on Rh and Pt polycrystalline electrodes [J]. Chemical Communications, 2014,50(17):2148-2151.
[11] Wang X, Zhu M, Zeng G, et al. A three-dimensional Cu nanobelt cathode for highly efficient electrocatalytic nitrate reduction [J]. Nanoscale, 2020,12(17):9385-9391.
[12] Li W, Xiao C W, Zhao Y, et al. Electrochemical Reduction of High- Concentrated Nitrate Using Ti/TiO2Nanotube Array Anode and Fe Cathode in Dual-Chamber Cell [J]. Catalysis Letters, 2016,146(12): 2585-2595.
[13] Li M, Feng C, Zhang Z, et al. Efficient electrochemical reduction of nitrate to nitrogen using Ti/IrO2–Pt anode and different cathodes [J]. Electrochimica Acta, 2009,54(20):4600-4606.
[14] Dortsiou M, Katsounaros I, Polatides C, et al. Influence of the electrode and the pH on the rate and the product distribution of the electrochemical removal of nitrate [J]. Environmental Technology, 2013,34(3):373-381.
[15] Peel J W, Reddy K J, Sullivan B P, et al. Electrocatalytic reduction of nitrate in water [J]. Water Research, 2003,37(10):2512-2519.
[16] Su L H, Li K, Zhang H B, et al. Electrochemical nitrate reduction by using a novel Co3O4/Ti cathode [J]. Water Research, 2017,120:1-11.
[17] Kerkeni S, Lamy-Pitara E, Barbier J, Copper–platinum catalysts prepared and characterized by electrochemical methods for the reduction of nitrate and nitrite [J]. Catalysis Today, 2002,75(1-4): 35-42.
[18] Vooys D, Arnoud C A, Van S, et al. Electrocatalytic reduction of NO3−on palladium/copper electrodes [J]. Journal of Molecular Catalysis. A, 2000,154(1):203-215.
[19] Gootzen J F E, Lefferts L,Veen J A R, et al. Electrocatalytic nitrate reduction on palladium based catalysts activated with germanium [J]. Applied Catalysis A: General, 1999,188(1):127-136.
[20] Tenne R, Patel K, Hashimoto K, et al. Efficient electrochemical reduction of nitrate to ammonia using conductive diamond film electrodes [J]. Journal of Electroanalytical Chemistry, 1993,347(1): 409-415.
[21] 查晓松,冯智梁,金苏雯.铁-铜双金属还原去除水中硝酸盐研究 [J]. 水处理技术, 2020,46(8):44-48. Cha X S, Feng Z L, Jin S W. Removal of nitrate in water by reduction of iron-based bimetal [J].Technology of Water Treatment, 2020, 46(8):44-48.
[22] Zhang Z Q, Xu Y P, Shi W X, et al. Electrochemical-catalytic reduction of nitrate over Pd–Cu/γAl2O3catalyst in cathode chamber: Enhanced removal efficiency and N2selectivity [J]. Chemical Engineering Journal, 2016,290(0):201-208.
[23] Su J F, Ruzybayev I, Shah I, Huang C P, The electrochemical reduction of nitrate over micro-architectured metal electrodes with stainless steel scaffold [J]. Applied Catalysis B: Environmental, 2016,180:199-209.
[24] Li Q, Zhang Q, Ding L, et al. Synthesis of silver/multi-walled carbon nanotubes composite and its application for electrocatalytic reduction of bromate [J]. Chemical Engineering Journal, 2013,217(0):28-33.
[25] Gu Y J, Wong W T, Nanostructure PtRu/MWNTs as anode catalysts prepared in a vacuum for direct methanol oxidation [J]. Langmuir 2006,22(26):11447-11452.
[26] Ding L, Li Q, Zhou D D, et al. Modification of glassy carbon electrode with polyaniline/multi-walled carbon nanotubes composite: Application to electro-reduction of bromate [J]. Journal of Electroanalytical Chemistry, 2012,668:44-50.
[27] Zhang Q, Ding L, Cui H, et al. Electrodeposition of Cu-Pd alloys onto electrophoretic deposited carbon nanotubes for nitrate electroreduction [J]. Applied Surface Science, 2014,308(1):113-120.
[28] Zhang Y M, Zhao Y L, Chen Z, et al. Electrochemical reduction of nitrate via Cu/Ni composite cathode paired with Ir-Ru/Ti anode: High efficiency and N2selectivity [J]. Electrochimica Acta, 2018,291: 151-160.
[29] Vanlangendonck Y, Corbisier D, Van Lierde A, Influence of operating conditions on the ammonia electro-oxidation rate in wastewaters from power plants (ELONITA™ technique) [J]. Water Research, 2005, 39(13):3028-3034.
[30] Lüdtke K, Peinemann K V, Kasche V, et al. Nitrate removal of drinking water by means of catalytically active membranes [J]. Journal of Membrane Science, 1998,151(1):3-11.
[31] Chen Z, Wang Y,Wang J, et al. Enhanced activity and selectivity of electrocatalytic denitrification by highly dispersed CuPd bimetals on reduced graphene oxide [J]. Chemical Engineering Journal, 2021, 416(0):129074.
[32] Duan W, Li G, Lei Z, et al. Highly active and durable carbon electrocatalyst for nitrate reduction reaction [J]. Water Research, 2019,161:126-135.
[33] Kong X J, W Z H, Ren Z R, et al. Degradation of lipid regulators by the UV/chlorine process: Radical mechanisms, chlorine oxide radical (ClO•)-mediated transformation pathways and toxicity changes [J]. Water Research, 2018,137:242-250.
Study on the electrochemical reduction of nitrate using a modified Cu-Pd bimetallic electrode.
WANG Chang, LIU Ji-ming*, WANG Yong-heng, LU Xin-yu
(College of Environmental Science and Engineering, Taiyuan University of Technology, Taiyuan 030024, China)., 2023,43(10):5196~5207
A NF/CNTs/Cu-Pd bimetallic composite electrode was effectively synthesized using the cathodic electrodeposition technique. The objective was to achieve efficient electrocatalytic reduction of nitrate in wastewater. SEM-EDS, XRD, and XPS analysis confirmed the successful deposition of Cu-Pd nanoparticles onto the nickel foam (NF) substrate. The efficacy of NO3--N and TN removal in simulated water was investigated by manipulating various factors, including current density, initial pH value, initial nitrate concentration, and Cl-concentration. The approach was also applied to actual saline wastewater to validate its feasibility. The results showed that NF/CNTs/Cu-Pd exhibited effective NO3--N removal capabilities without Cl-, while TN removal efficiency was relatively modest, with NO3--N primarily converted into NH4+-N. However, in the presence of Cl-, both NO3--N and TN were efficiently removed. The optimal reaction conditions were determined to be a current density of 30mA/cm2, an initial pH value of 7, an initial concentration of 50mg/L, and a chloride ion concentration of 2.0g/L. Under optimal conditions, the removal efficiencies of NO3--N and TN reached 100% and 97.2%, respectively. The presence of dissolved organic matter (DOM) in actual wastewater could impede NO3--N removal. After removing the DOM, the removal efficiency of NO3--N decreased to 95.5%, and the TN removal efficiency declined to 85.6%.
nitrate reduction;NF/CNTs/Cu-Pd electrode;electrodeposition;high-salt wastewater
X703.1
A
1000-6923(2023)10-5196-12
2023-02-23
国家自然科学基金资助项目(52070139);山西省自然科学基金资助项目(20210302124100)
* 责任作者, 副教授, liujiming@tyut.edu.cn
王 畅(2000-),女,河北保定人,太原理工大学硕士研究生,主要从事水污染控制研究.发表论文1篇.1102314713@qq.com.
王 畅,刘吉明,王永恒,等.改性Cu-Pd双金属电极电化学还原硝酸盐性能研究 [J]. 中国环境科学, 2023,43(10):5196-5207.
Wang C, Liu J M, Wang Y H, et al. Study on the electrochemical reduction of nitrate using a modified Cu-Pd bimetallic electrode [J]. China Environmental Science, 2023,43(10):5196-5207.
