进境大豆种子携带真菌的分离与鉴定*
2023-10-25杨瑾李凯兴李培谦
杨瑾,李凯兴,李培谦
(运城学院生命科学系,山西 运城 044000)
大豆原产我国,是重要的粮食作物之一,其富含油脂和蛋白质,在国民生产中占有重要地位。随着大豆进境量的快速增长,携带各种检疫性病虫草害风险不断加大。据统计,我国进境大豆携带的有害生物种类高达600 余种[1]。进境大豆中的检疫性病害,如大豆茎溃疡病菌、大豆疫霉、菜豆荚斑驳病毒等检出率逐年增高[2]。因此,了解进境大豆病害发生及其携带病原情况对阻断检疫性病害在我国的危害和流行具有重要现实意义。检疫性病害,尤其是国内尚未发现的病害一经传入,将给我国农业生产带来严重危害[2]。大豆在贮存和运输过程中,不适合的温度和湿度条件易使其产生霉变,而霉菌产生的毒素是影响大豆品质的重要因素之一。因此,掌握进境大豆在运输和贮存过程的真菌携带情况对保障进境大豆质量至关重要。
本研究采用传统分离培养技术,通过形态学观察和分子生物学手段对2021 年经南通海关进境的美国、乌拉圭、巴西大豆种子进行检测鉴定,并对植物病原微生物随大豆入境传播的可能性进行分析,以期为进境大豆检验检疫工作提供参考。
1 材料与方法
1.1 材料
1.1.1 植物材料大豆种子:为2021 年南通海关现场检疫采样样品,分别来自美国、乌拉圭和巴西。
1.1.2 培养基
马铃薯葡萄糖琼脂培养基(PDA):购自青岛海博生物技术有限公司。称取PDA 粉9.2 g 于250 mL三角瓶中,加入200 mL 超纯水,115 ℃高压灭菌15 min。
1.1.3 主要仪器材料
上海一恒电热恒温培养箱(DHP-9052),上海一恒科学仪器有限公司;苏州净化(SW-CG-2G)超净工作台,苏州净化设备有限公司;德国Eppendorf(5804R)离心机,上海艾研生物科技有限公司;天根基因组提取试剂盒(DP320),天根生化科技(北京)有限公司。
1.1.4 其他材料
碱基序列比对网站:NCBI 数据库(https://www.ncbi.nlm.nih.gov)。
1.2 试验方法
1.2.1 种子带菌率检测
采用分离培养法[3]对种子携带真菌情况进行检测。随机选取美国、乌拉圭、巴西进境大豆种子各100 粒,先将大豆种子在5%次氯酸钠溶液中浸泡1 min 进行表面消毒,再用无菌水冲洗3 次,然后均匀摆放于直径9 cm 的马铃薯葡萄糖琼脂培养基(PDA)平板上,每皿10 粒,共10 个培养皿。在25 ℃培养箱中黑暗培养5 d 后统计100 粒大豆种子带菌情况。种子带菌率= 带菌种子数/检测种子总数×100%。
1.2.2 种子表面带菌检测
随机选取美国、乌拉圭和巴西进境大豆种子各15 粒,剔除土屑和木屑,放入装有100 mL 灭菌超纯水的三角瓶中,置于超净工作台后用漩涡仪剧烈震荡10 min。将震荡后的上清液倒入灭菌离心管中,12 000 rpm/min 离心3 min。将离心后的下层液体均匀涂布在PDA 平板上,每种大豆以上步骤均3 次重复。将涂好的平板置于25 ℃培养箱中黑暗培养。每天观察大豆周围菌落生长状况,及时挑出形态、颜色不同的菌落。将挑出的菌丝块在新的PDA 培养基上转接3 代,用以纯化。观察纯化后的真菌,记录菌落特征,用显微镜观察菌丝和分生孢子形态,对所有纯化后的真菌对照检索表进行形态学[4]鉴定。纯化好的菌株经转接后于灭菌滤纸片过夜吹干,置于-20 ℃冰箱保存。
1.2.3 种皮、种内带菌检测
采用组织分离法[3],随机选取美国、乌拉圭和巴西进境大豆种子各15 粒,用漩涡仪剧烈震荡10 min,处理方法同上。用镊子将震荡后的大豆种子取出放入5%次氯酸钠溶液中消毒1 min,灭菌超纯水冲洗3 次后,用灭菌后的镊子将大豆表皮撕下放在PDA 培养基上,将撕皮后的种子同样放置于PDA 培养基上,每种大豆以上步骤均3 次重复[3]。将涂好的平板置于25 ℃培养箱中黑暗培养。菌株纯化及形态学鉴定同1.2.2。纯化好的菌株接于滤纸片干燥后置于-20 ℃冰箱保存。1.2.4 菌株分子鉴定
用灭菌手术刀轻轻刮取培养基上纯化后的菌丝,采用天根基因组提取试剂盒(DP320)提取菌株基因组DNA。提取后的基因组DNA 置于-20 ℃冰箱保存。利用ITS 序列引物ITS4/ITS5 进行普通PCR 反应。反应体系为25 μL,其中2XEasy-LoadTMPCR Master Mix 12.5 μL;ITS4/ITS5 各1 μL;基因组模板1 μL;最后用灭菌超纯水补足体积至25 μL。反应程序:95 ℃预变性5 min;95 ℃变性30 s,58 ℃复性30 s,72 ℃延伸40 s,变性至延伸阶段32 个循环;72 ℃再延伸10 min。扩增产物在1%琼脂糖凝胶1 × TAE 缓冲液中电泳,经核酸染料染色后于紫外灯下凝胶成像。将出现650 bp 长度的条带样品送至武汉金开瑞生物工程有限公司测序。将测序获得的序列在NCBI 网站进行Blast 同源性比对分析,将比对结果结合菌丝形态学观察对病原菌进行鉴定。
1.3 数据分析
试验数据采用Excel 2020 进行计算和整理。序列比对在NCBI 数据库上进行。
2 结果分析
2.1 种子带菌率检测结果分析
由表1 可知,不同国家进境大豆种子带菌率不同。进境大豆种子带菌率表现为美国>巴西>乌拉圭。其中美国进境大豆种子带菌率为20.7%;巴西进境大豆种子带菌率为18.1%;乌拉圭进境大豆种子带菌率为15.4%。

表1 不同国家进境大豆种子带菌率检测结果
2.2 真菌分离物初步鉴定结果分析
对来自3 个国家的进境大豆种子分别进行种子表面、种皮和种内携带真菌分离鉴定。经3 代纯化培养后,共得到21 个分离物。其中美国进境大豆上获得6 个分离物,巴西进境大豆上获得11 个分离物,乌拉圭进境大豆上获得4 个分离物。通过菌落形态、菌丝和分生孢子观察,初步鉴定其分属青霉属(Penicillium spp.)、曲霉属(Aspergillus spp.)和壳球孢属(Macrophomina spp.)。
2.3 菌株分子鉴定结果分析
通过引物ITS4/ITS5 对病原菌rDNA 区段的内转录间隔区进行PCR 扩增,将凝胶结果中显示为650 bp 长度的单条带序列进行测序,经NCBI 网站进行序列比对分析,结合形态学观察,将菌株鉴定到种(见表2)。
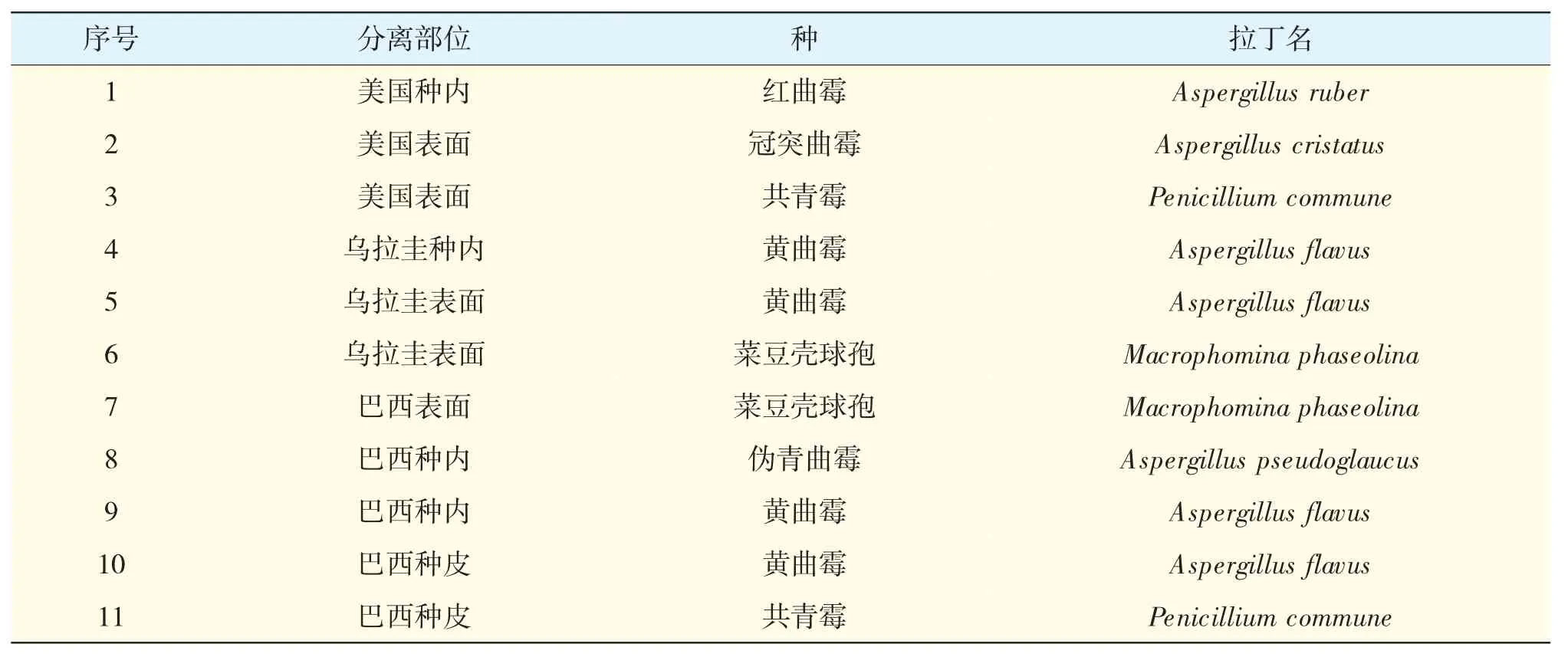
表2 不同国家进境大豆种子菌株分子鉴定结果
由表2 可知,经鉴定,21 个分离物中曲霉属(Aspergillus spp.)真菌分离率最高,共获得12 个,占比达57%。其主要为红曲霉(A.ruber)、黄曲霉(A.flavus)、冠突曲霉(A.cristatus)和伪青曲霉(A.pseudoglaucus)。其中乌拉圭进境大豆种子分离得到黄曲霉(A.flavus)和菜豆壳球孢(M.phaseolina);巴西进境大豆种子分离得到菜豆壳球孢(M.phaseolina)、伪青曲霉(A.pseudoglaucus)、黄曲霉(A.flavus)和共青霉(P.commune);美国进境大豆种子分离得到红曲霉(A.ruber)、冠突曲霉(A.cristatus)和共青霉(P.commune)。
通过对种子表面、种皮和种内3 个不同部位带菌情况进行比较,发现种子表面带菌情况与种内、种皮带菌情况存在较大差别。来自3 个国家进境大豆种子表面均可分离得到真菌,但美国和乌拉圭进境大豆种子种皮均未分离得到真菌。其中美国进境大豆种子表面分离物与种内分离物不同;乌拉圭进境大豆种子表面分离得到菜豆壳球孢,而种内未分离得到该真菌;巴西进境大豆种子表面分离得到菜豆壳球孢,但在种皮和种内均未分离到该真菌(见表2)。
3 结论与讨论
本研究对2021 年经南通海关进境的美国、乌拉圭和巴西进境大豆种子带菌情况进行检测,共得到21 个分离物,其中曲霉属(Aspergillus spp.)真菌分离率最高,占比为57%;其次为青霉属真菌和菜豆壳球孢。魏思楠等[3]对我国不同地区大豆主栽品种种子携带真菌进行研究表明,我国大豆种子中青霉属的分离率最高,其次是曲霉属。其中青霉属真菌多为贮藏期病害病原菌,对植物生育期的生长发育影响不大。王勇等[5]对浙江省舟山口岸进境大豆携带常见真菌进行检测表明,青霉属和曲霉属真菌检出率最高。
大豆在运输和贮存过程中易发生霉变,霉变后产生的霉菌毒素可严重危害人体健康。黄曲霉毒素(A.flatoxins)由曲霉属(Aspergillus spp.)真菌产生,是最常见也是毒性最强的霉菌毒素之一。曲霉属在自然界中分布较广,可侵染饲料、花生和油料等。黄曲霉侵染食物后产生的黄曲霉毒素是化合物中毒性和致癌性最强的有害物质之一[6]。其中花生种子为最易感染黄曲霉的作物之一,由黄曲霉毒素产生的污染已成为制约花生国际竞争力的关键因素[7]。自1960 年发现黄曲霉毒素后,国内及出入境大豆种子及其制品中黄曲霉毒素监测成为重要关注领域。对于进境大豆携带的贮存期病原真菌可采用熏蒸处理,杀死运输过程或贮存中产生的青霉和曲霉。此外,还可采用干热方法处理带菌大豆[9]。
菜豆壳球孢(M.phaseolina)是一种常见土传性病原菌,可侵染500 多种植物。由其引起的大豆炭腐病为影响美国大豆生产的第三大病害,其广泛发生于世界主要大豆生产区,可造成大豆严重减产[10-12]。本研究中,在乌拉圭和巴西进境大豆中均分离得到了该真菌。间座壳属(Diaporthe novem)真菌是一种常见检疫性病害,该病菌可引起大豆茎秆溃疡及种子腐烂,对大豆产生严重危害[13],本研究未检测到该检疫性病原。
本研究通过对大豆种子表面、种皮和种内不同部位带菌情况进行比较发现,不同部位真菌分离情况差别较大。种皮和种内带菌不同的原因可能是真菌侵染大豆种子后,种子较为干燥,真菌无法继续扩展,因此只在表面或种皮分离得到。此外,试验中由于纯化技术的限制也会导致某些真菌无法分离得到。因此在进行种子带菌检测时,不能仅单一地进行表面分离物的鉴定,还应从不同部位全面取样进行鉴定才能准确反映种子带菌情况。
致谢:感谢中华人民共和国南通海关朱林为本试验提供大豆种子,在此表示衷心感谢!
