气体信号分子硫化氢介导胃癌多药耐药性研究
2023-10-25陈伟毅李小成段绍毅陈立军杨骐彰
陈伟毅,胡 柯,刘 雨,彭 靖,李小成,段绍毅,陈立军,杨骐彰
(1.湖南医药学院医学院,湖南 怀化 418000;2.湖南医药学院第一附属医院普外科,湖南 怀化 418000)
胃癌(gastric cancer)是消化系统常见的恶性肿瘤之一,全国肿瘤中心数据显示,胃癌发病人数和死亡人数均居所有恶性肿瘤第2 位,已严重危害我国居民健康[1]。化疗是治疗胃癌的主要方法之一,然而胃癌对化疗并不敏感,目前应用的多种药物以及多种给药方案的总体疗效评价很不理想[2]。化疗失败主要是由于胃癌对化疗药物产生了多药耐药性(multidrug resistance,MDR)[3]。胃癌多药耐药的产生严重影响了化疗在胃癌治疗中的效果,如何逆转多药耐药已成为胃癌治疗中的一个关键问题。硫化氢(hydrogen sulphide,H2S)是一种新的内源性气体信号分子,具有多种生理、毒理和药理作用,如调节离子通道的开放和关闭、抑制细胞增殖、抗氧化应激、舒张平滑肌、抗内质网应激等[4]。研究表明[5],H2S 可以促进肿瘤耐药性,但H2S 对胃癌耐药性的影响目前尚未明确。本研究拟探讨H2S 与胃癌多药耐药的关系,为逆转胃癌多药耐药提供新的靶点。
1 材料与方法
1.1 药物与试剂 RPMI 1640、胎牛血清(美国Gibco公司),顺铂(齐鲁制药有限公司),阿霉素(深圳万乐药业有限公司),5-氟尿嘧啶(海南卓泰制药有限公司),CCK8 试剂盒(碧云天公司),BCA 蛋白定量试剂盒(北京索莱宝科技有限公司),NaSH(美国Sigma公司),胱硫醚-β-合成酶(Cystathionine-β-synthase,CBS)抗体、β-actin 抗体(美国CST 公司)。
1.2 仪器 UV2450 型亚甲基蓝分光光度计(日本SHIMADZU 公司),AE2000 型光学倒置显微镜(美国Motic 公司),Mini-PROTEAN Tetra 型聚丙烯酰胺垂直电泳系统、ChemiDoc XRS+型凝胶成像系统(美国Bio-Rad 公司)。
1.3 细胞及培养 人胃癌MGC803 细胞购于中科院上海细胞库,用含有10%的胎牛血清的RPMI 1640,培养于37 ℃、5% CO2孵箱中,每48 h 用0.25%的胰酶消化传代进行后续实验。
1.4 方法
1.4.1 顺铂诱导多药耐药胃癌细胞株的建立 取对数生长期的胃癌MGC803 细胞,用含1 mg/L 顺铂的培养基培养48 h 后更换为不含顺铂的培养基继续培养。待细胞恢复活力后,用含相同浓度顺铂的培养基继续培养,直至细胞能够在含1 mg/L 顺铂的培养基里稳定生长。采用同样的方法将顺铂浓度逐步提高为2、3、4、5 mg/L,最终建立耐5 mg/L 顺铂的胃癌多药耐药细胞MGC803/MDR,倒置显微镜观察细胞形态并拍照。
1.4.2 细胞分组及处理 将MGC803/MDR 细胞随机分成对照组和氨基氧乙酸(AOAA)组,AOAA 组予以1 mmol/L AOAA 处理24 h,对照组予以等量的培养基处理24 h。另取MGC803 细胞随机分成对照组和NaSH 组,NaSH 组予以200 μmol/L NaSH 处理24 h,对照组予以等量的培养基处理24 h。
1.4.3 CCK8 法计算IC50值 取对数生长期的胃癌MGC803 或MGC803/MDR 细胞以每孔1×105/ml,100 μl/孔接种在96 孔板中,常规培养细胞达到板底80%,分别予以0、1、2、3、4、6 mg/L 顺铂、5-氟尿嘧啶、0、0.5、1、1.5、2 mg/L 阿霉素处理24 h 后,吸去培养液,每孔加入含10 μl CCK8 的培养液110 μl,同时在空白孔内加入含10 μl CCK8 的培养液110 μl 进行空白对照,继续孵育1 h,酶标仪检测450 nm 出吸光度OD 值,计算细胞活力=(加药孔OD 值-空白孔OD值)/(不加药孔OD 值-空白孔OD 值)×100%,采用改良寇式法计算IC50值[6]。
1.4.4 亚甲基蓝分光光度计法检测H2S 含量 取对数生长期的胃癌MGC803 或MGC803/MDR 细胞以每孔1×106/ml,500 μl/孔接种在24 孔板,收集细胞培养基于含2%醋酸锌30 μl 离心管中,超声波裂解细胞后将其置于之前的离心管中,采用亚甲基蓝分光光度计法检测H2S 含量[7]。
1.4.5 Western blot 检测蛋白表达 提取细胞蛋白,采用BCA 法测量蛋白浓度,每组取60 μg 蛋白样品进行聚丙烯酰胺凝胶电泳,然后将蛋白转移到NC 膜上,封闭后加入一抗4 ℃过夜,再加入二抗孵育2 h,曝光显影,以β-actin 作为内参,采用Quantity one软件分析蛋白表达量。
1.5 统计学方法 采用SPSS 26.0 软件进行统计分析,实验数据均以()表示,两两比较采用独立样本检验,<0.01 视为统计学意义显著。
2 结果
2.1 细胞形态学观察 采用倒置显微镜观察细胞形态:MGC803 细胞形态规则,呈多边性或三角形,胞体较大,细胞之间连接紧密,边界清晰。MGC803/MDR细胞排列松散,细胞之间界限不清,胞体较小,细胞形态呈梭形或不规则形,见图1。
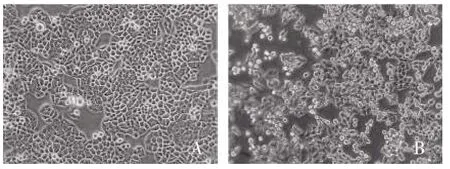
图1 胃癌细胞形态观察(×200)
2.2 两种胃癌细胞株IC50值 MGC803/MDR 细胞对顺铂、阿霉素、5-氟尿嘧啶的IC50值高于MGC803细胞(<0.01),见图2。

图2 两种胃癌细胞株IC50 值
2.3 两种胃癌细胞株H2S、硫化氢生成酶CBS 表达MGC803/MDR 细胞H2S(91.8±4.36)、CBS(0.85±0.02)表达高于MGC803 细胞(62.53±1.86)、(0.32±0.01)(<0.01),见图3。
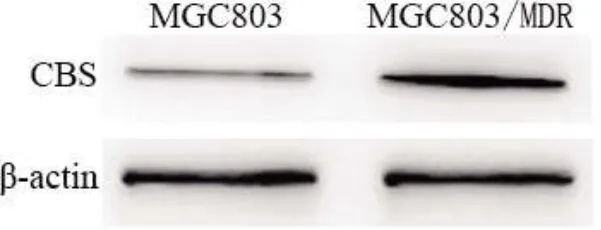
图3 两种胃癌细胞CBS 表达
2.4 AOAA 对MGC803/MDR 细胞H2S 表达和IC50值的影响 采用CBS 抑制剂 AOAA 作用于MGC803/MDR 细胞24 h 后,H2S 生成显著减少,见图4A;对顺铂、阿霉素、5-氟尿嘧啶的IC50值显著降低,见图4B。
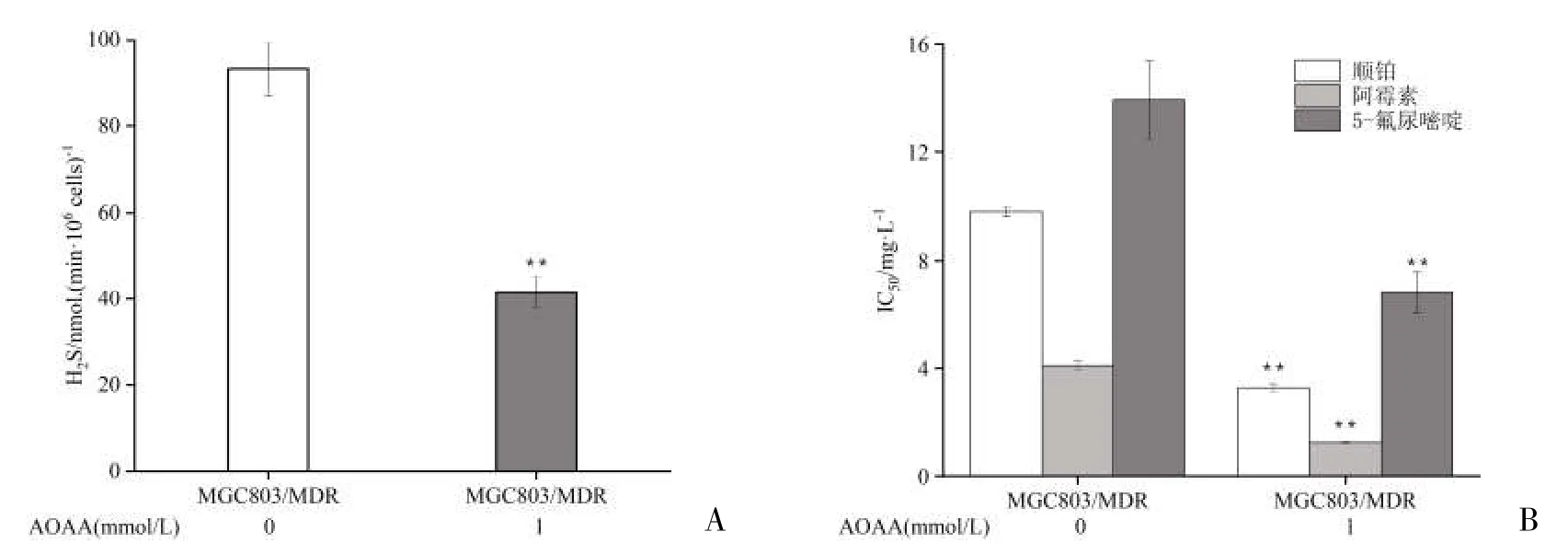
图4 AOAA 对H2S 表达和IC50 值的影响
2.5 NaSH 对MGC803 细胞IC50值的影响 采用NaSH(外源性H2S)作用MGC803 细胞24 h 后,MGC803 细胞对顺铂、阿霉素、5-氟尿嘧啶的IC50值显著升高,见图5。
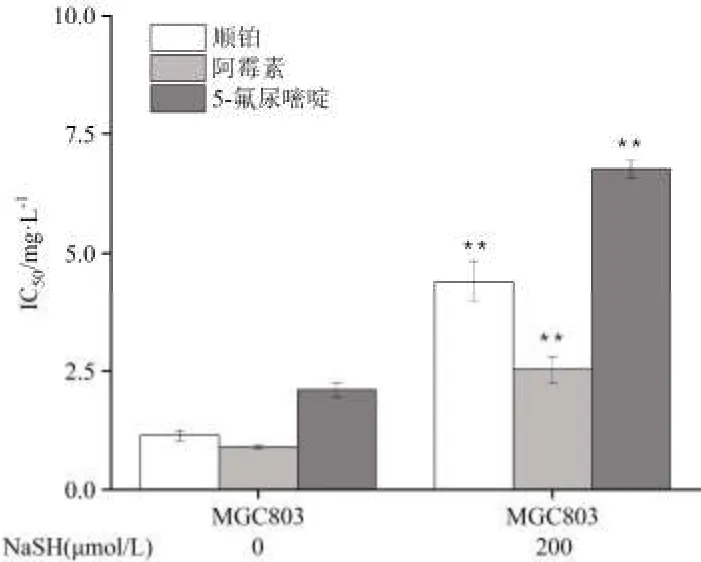
图5 NaSH 对MGC803 细胞IC50 值的影响
3 讨论
胃癌多药耐药的产生严重影响了化疗在胃癌治疗中的效果,并导致肿瘤复发和转移,引起胃癌治疗失败[8,9]。如何逆转多药耐药已成为胃癌治疗中的关键问题[10]。H2S 是机体内一种新型气体信号分子,具有分子量小、扩散快、效应广等特点[11,12]。研究表明,H2S 与肿瘤耐药形成有关[5],但其与胃癌多药耐药的关系目前尚未明确。本研究拟探讨H2S 与胃癌多药耐药的关系,为防治胃癌多药耐药提供新的思路。H2S 是继一氧化氮(NO)和一氧化碳(CO)后第3 种气体信号分子,广泛参与多种生理和病理过程[13,14]。近来越来越多的文献报道H2S 与肿瘤耐药相关,如Untereiner AA 等[15]发现H2S 和CBS 在5-氟尿嘧啶耐药结肠癌细胞中显著上调,Bhattacharyya S 等[16]报道CBS 可以促进卵巢癌细胞对顺铂耐药,Wang L等[17]发现CBS 过表达可引起肝癌细胞对多柔比星和舒尼替尼产生耐药。上述研究表明H2S 与多种肿瘤耐药密切相关,但H2S 与胃癌耐药的关系尚未明确。
本研究首先采用药物浓度递增法建立了胃癌多药耐药细胞株MGC803/MDR。通过CCK8 实验发现MGC803/MDR 细胞对顺铂、阿霉素、5-氟尿嘧啶的IC50值显著高于MGC803 细胞,表明其具有多药耐药性。其次通过亚甲基蓝分光光度计法、Western blot 等实验发现MGC803/MDR 细胞H2S 含量、H2S生成酶CBS 表达高于MGC803 细胞,表明MGC803/MDR 细胞多药耐药性与H2S 生成增多有关。之后采用CBS 抑制剂AOAA 降低MGC803/MDR 细胞H2S后,发现MGC803/MDR 细胞H2S 生成减少,同时对顺铂、阿霉素、5-氟尿嘧啶的IC50值降低,表明抑制H2S 生成可以逆转MGC803/MDR 细胞的多药耐药性。为了进一步验证H2S 对胃癌多药耐药的影响,给予MGC803 细胞NaSH(外源性H2S)处理,发现在NaSH 的作用下,MGC803 细胞对顺铂、阿霉素、5-氟尿嘧啶的IC50值升高,表明增加H2S 生成可以促进MGC803 细胞多药耐药性。上述研究结果表明H2S介导了胃癌细胞多药耐药性的形成。
有研究报道[18],内源性H2S 可以促进人胃癌细胞增殖。另有文献报道[19],抑制H2S 生成可以减少胃癌血管生成。此外,有资料发现[20],降低H2S 生成可以抑制胃癌细胞的增殖、迁移。本实验发现升高H2S浓度可以促进胃癌多药耐药,降低H2S 浓度可以逆转胃癌多药耐药,表明H2S 介导了胃癌的多药耐药,H2S 可能是防治胃癌多药耐药的一个新的靶点。
综上所述,本研究发现H2S 介导了胃癌的多药耐药的形成,发掘了胃癌多药耐药形成的新机制,为防治胃癌多药耐药提供了新的思路。然而,本研究也有一些不足之处,比如只进行了体外细胞实验验证,没有进行体内动物实验验证,以及H2S 通过何种途径介导胃癌多药耐药,其机制还需进一步研究。
