非酒精性脂肪肝发病相关影响因素研究
——基于广西南宁某体检中心对象*
2023-10-24梁忠平张运莲
林 洁,梁忠平,张运莲,林 华
(1.广西国际旅行卫生保健中心(南宁海关口岸门诊部),广西南宁 530021;2.南宁海关国际旅行卫生保健中心北海分中心,广西北海 536000;3.广西医科大学第二附属医院健康体检中心,广西南宁 530007)
非酒精性脂肪肝(Non-alcoholic Fatty Liver Disease,NAFLD)指排除过量饮酒和其他明确的损肝因素,以弥漫性肝细胞脂肪变性为病理特征的临床综合征[1]。全球范围内,发病率逐年升高的NAFLD已是肝功能异常的首要原因[2],也是增加肝细胞癌不良预后及死亡率的风险因素[3,4]。NAFLD与不良的生活方式和饮食习惯有关[5,6],比如久坐、少动和摄入糖分、脂肪过多等。国外有研究显示生活方式和饮食习惯与NAFLD高度相关,但由于我国居民体质、生活方式和饮食习惯与国外不同,研究本地区的NAFLD发病的影响因素有着重要意义。本研究以广西南宁某体检中心的部分患者为研究对象,从患者的常规检查指标及反映其生活方式的问卷调查表结果切入,探讨NAFLD发病的原因,拟为降低NAFLD发病概率,改善其预后所采取的健康干预措施提供参考依据。
1 材料与方法
1.1 研究对象
选择2018年3月至2023年5月广西南宁某体检中心的577名常规体检者为研究对象。纳入标准:(1)年龄大于18岁;(2)完善肝脏超声检查者;(3)获得知情同意。排除标准:(1)每周酒精摄入量超标者,即男性每周酒精摄入量大于210 g,女性大于140 g;(2)病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性、自身免疫性肝病等可致脂肪肝的特定疾病患者;(3)严重心肺疾病及恶性肿瘤患者;(4)妊娠、哺乳期的孕产妇;(5)重要数据缺失者。
1.2 方法
1.2.1 体格检查和实验室检查
(1)空腹(无任何能量摄入8 h)时,采用校正后的沃申WS-H600A身高体重仪测量体重(精确至0.1 kg) 、身高(精确至0.01 m),计算身体质量指数(BMI)。(2)由专业超声诊断科医师采用飞利浦EPIQ5超声诊断仪对每例受检者进行空腹状态下肝脏超声检查。(3)采用贝克曼AU5800全自动生化分析仪测定患者血谷丙转氨酶(ALT)、谷草转氨酶(AST)、空腹血糖(FPG)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL)和低密度脂蛋白(LDL)。
1.2.2 问卷调查
参考《中国健康管理学杂志》编辑部编写的《专家共识:健康体检项目专家共识》[7],通过调查问卷收集(1)一般人口学指标,包括年龄、年龄分组(18-44岁、45-59岁、≥60岁)、性别;(2)饮食行为情况,包括是否按时三餐(不能、基本能、能)、经常暴饮暴食(否、是)、夜宵、主食结构(粗细搭配、不确定、粗粮为主、细粮为主)、牛奶摄入(无、偶尔、经常、每天)、鸡蛋摄入(无、偶尔、经常、每天)、豆类及豆制品摄入(无、偶尔、经常、每天)、水果摄入(无、偶尔、经常、每天)、动物内脏摄入(无、偶尔、经常)、鱼肉或海鲜摄入(无、偶尔、经常)、咖啡摄入(无、偶尔、经常、每天)、含糖饮料摄入(无、偶尔、经常)、吸烟(已戒、无、是、被动)、饮酒(偶尔、已戒、无、是)、运动锻炼、睡眠质量(差、一般、好)、日均睡眠时间(<5、5-7、7-9 h)、宵夜(不吃、偶尔、经常)。调查由经过统一培训的人员进行一对一问卷数据收集。
1.2.3 相关指标定义和诊断标准
NAFLD诊断标准:参考中华医学会肝病学分会脂肪肝和酒精性肝病学组《非酒精性脂肪性肝病防治指南(2018年更新版)》[8],采用腹部超声作为NAFLD的影像学诊断依据,符合以下3个基本条件认定为 NAFLD:(1)无饮酒史或无过量饮酒史(每日饮酒量折合乙醇含量:男性≤30 g,女性≤20 g);(2)排除自身免疫性肝病、肝豆状核变性、病毒性肝炎、药物性脂肪肝等其他可导致脂肪肝的肝脏疾病;(3)影像学或组织学检查表明有肝脂肪变性的证据。BMI分级根据中华人民共和国卫生部(原)疾病控制司《成人体重判定》推荐标准[9]进行划分:消瘦(BMI<18.5 kg/m2),正常(18.5 kg/m2≤BMI<24 kg/m2),超重(24 kg/m2≤BMI<28 kg/m2),肥胖(BMI≥28 kg/m2)。
1.3 统计学分析
应用软件SPSS 23.0对数据进行统计学分析。符合正态分布的计量资料用“均数±标准差”的形式表示,计数资料用“例数(百分比)”的形式表示。对纳入的指标进行组间比较,计量资料采用t检验,计数资料采用χ2检验或Fisher′s精确检验。P<0.05为差异有统计学意义。多因素逻辑回归分析将是否患有NAFLD作为结果变量,将组间比较差异具有统计学意义的指标作为自变量。
2 结果与分析
2.1 一般情况
本研究最终选取了577例研究对象,其中184例为NAFLD患者,患病率为31.89%,其余为非NAFLD患者。
2.2 NAFLD患者与非NAFLD群体各指标比较及逻辑回归分析
两组患者在性别(χ2=23.675,P=0.000)、BMI分级(P=0.000)、ALT水平(t=-3.110,P=0.002)、AST(t=-2.094,P=0.037)水平、TC(t=-2.616,P=0.009)、TG分级(χ2=61.420,P=0.000)、HDL(t=7.079,P=0.000)、LDL(t=-3.613,P=0.000)和主食构成(P=0.000)差异显著;其他指标均无显著差异(即P均大于0.05,因篇幅所限未列出),详见表1。多因素逻辑回归分析结果显示,超重(P=0.000,OR=1.248,95%CI:1.154-1.351)、肥胖(P=0.000,OR=1.561,95%CI:1.398-1.742)、TG高危水平(P=0.001,OR=1.177,95%CI:1.066-1.298)与以细粮为主(P=0.002,OR=1.138,95%CI:1.051-1.233)是NAFLD发病的独立危险因素,详见表2。
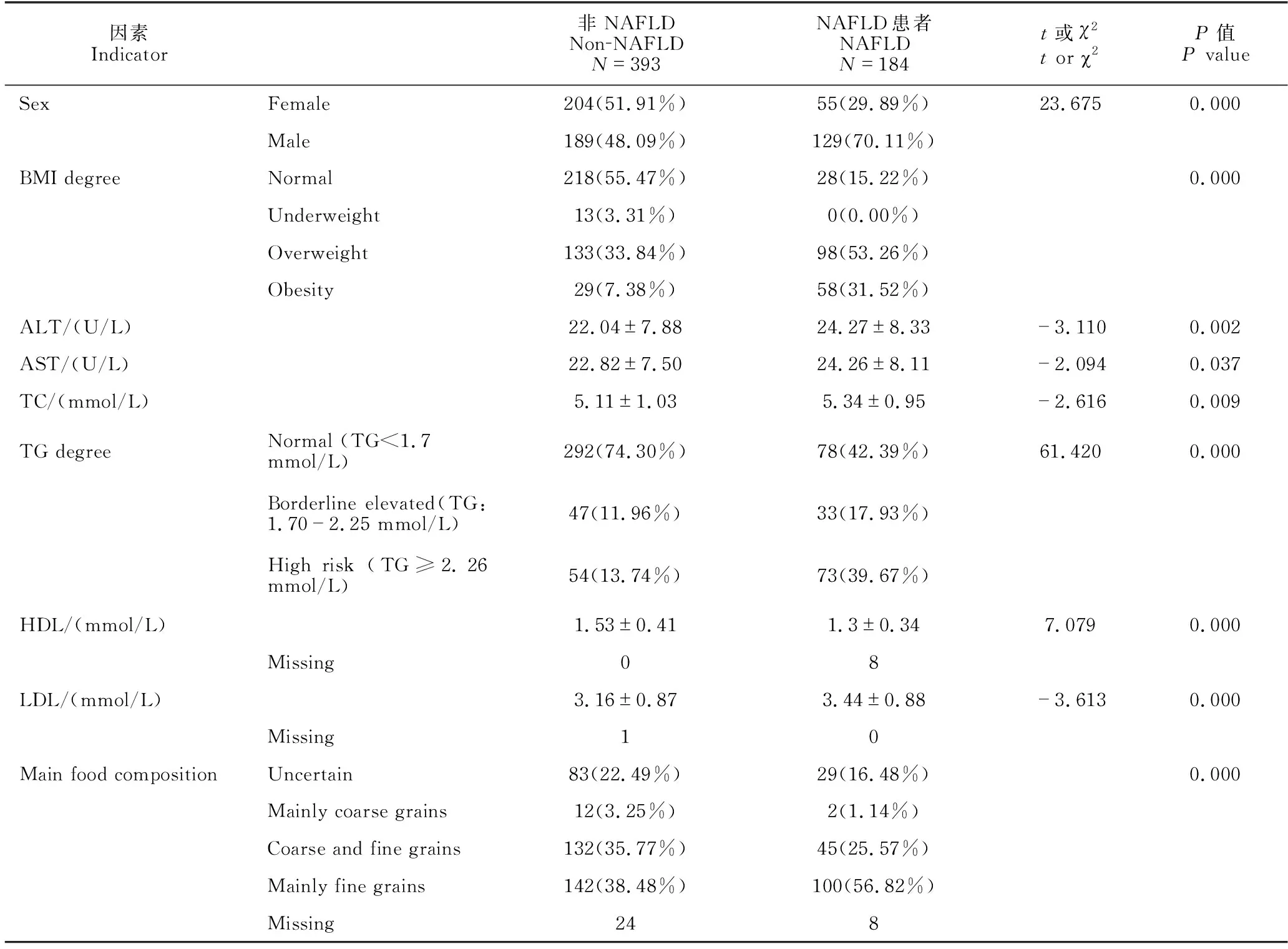
表1 非NAFLD群体与NAFLD对象各指标比较
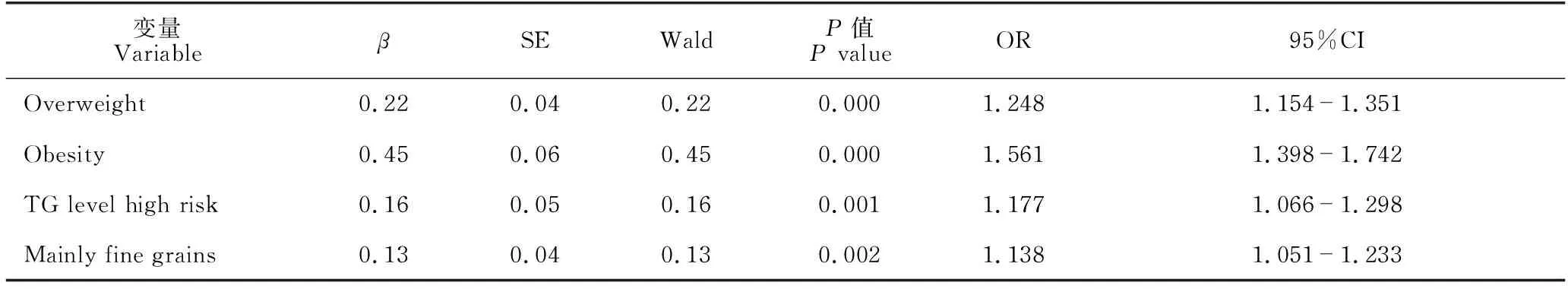
表2 NAFLD相关影响因素logistic回归分析
2.3 男性NAFLD患者与非NAFLD群体各指标比较及逻辑回归分析
男性患者在年龄分组(χ2=6.848,P=0.033)、BMI(P=0.000)、TG分级(χ2=24.349,P=0.000)、HDL(t=7.080,P=0.000)、主食构成(P=0.000)、豆类摄入(χ2=13.864,P=0.000)、饮酒(P=0.016)、运动(χ2=8.747,P=0.013)方面差异显著;其他指标均无显著差异(P均大于0.05,因篇幅所限未列出),详见表3。多因素逻辑回归分析结果显示,超重(P=0.000,OR=1.282,95%CI:1.142-1.438)、肥胖(P=0.000,OR=1.536,95%CI:1.324-1.783)、TG高危水平(P=0.020,OR=1.160,95%CI:1.024-1.314 )、以细粮为主(P=0.021,OR=1.152,95%CI:1.022-1.298)是男性NAFLD的独立危险因素;年龄大于等于60岁(P=0.024,OR=0.813,95%CI:0.681-0.972 )、经常摄入豆类(P=0.016,OR=0.766,95%CI:0.617-0.950)是其NAFLD的保护因素(表4)。
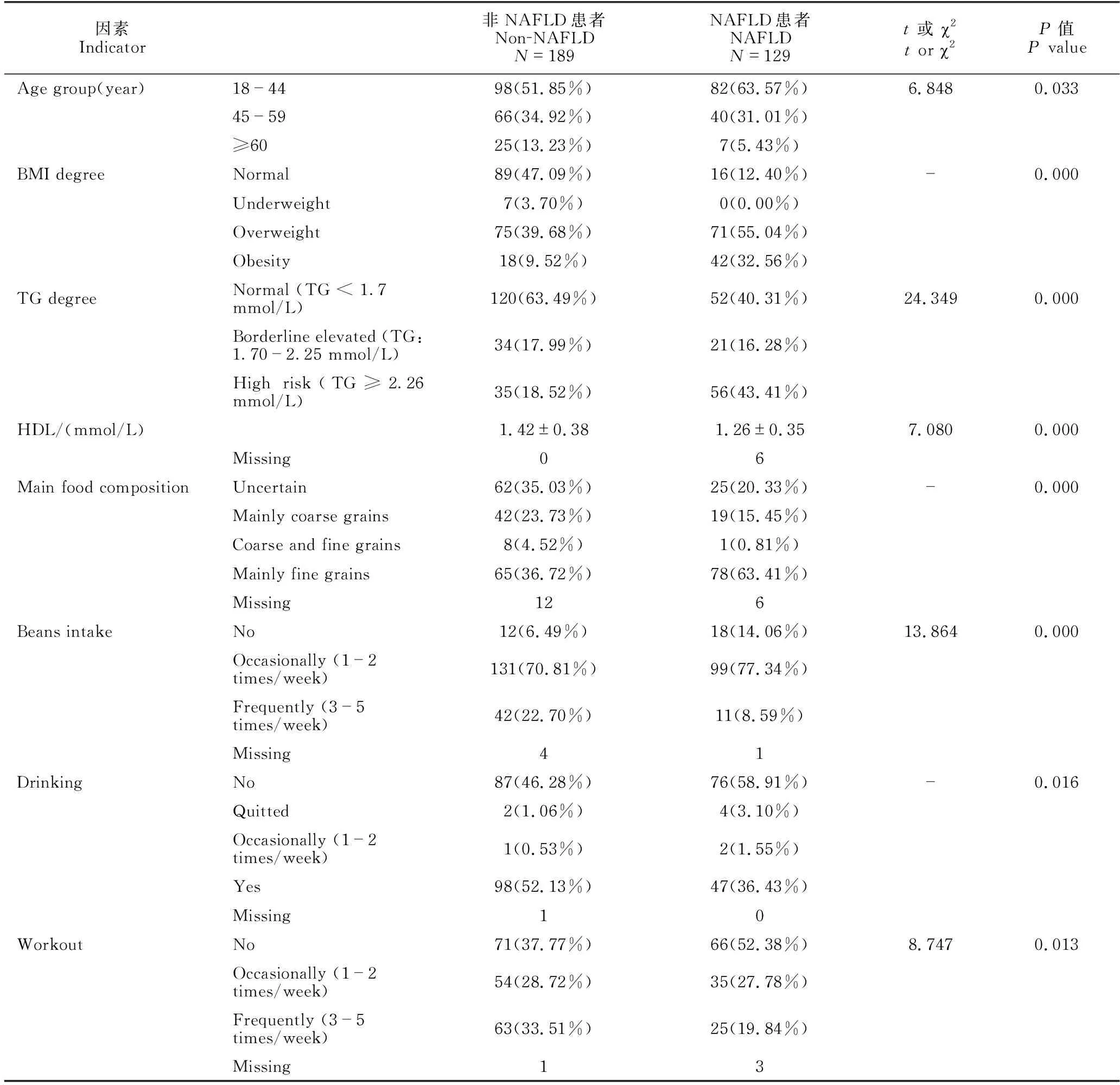
表3 男性NAFLD患者与非NAFLD群体各指标比较
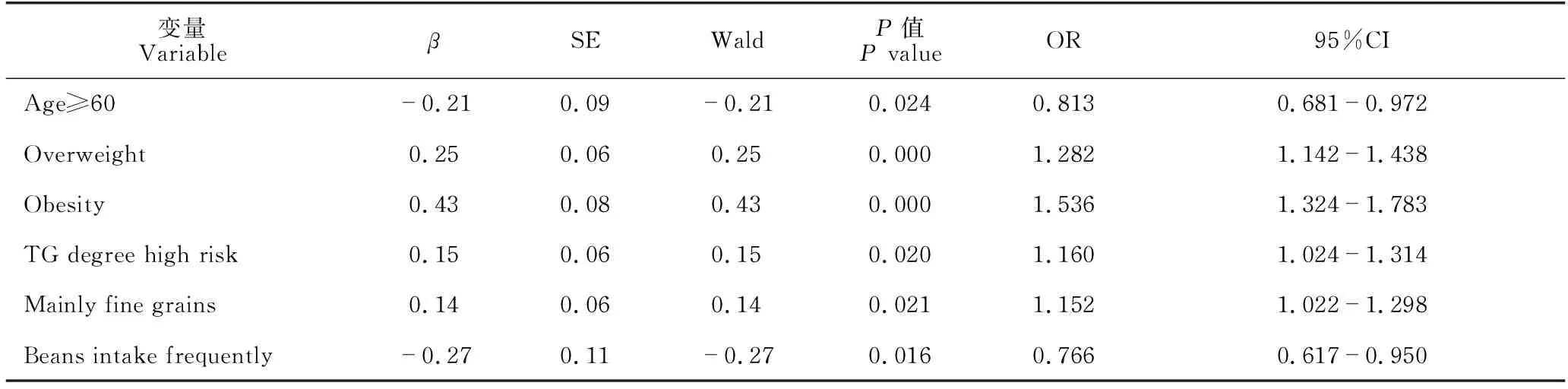
表4 男性NAFLD相关影响因素logistic回归分析
2.4 女性NAFLD患者与非NAFLD群体各指标比较及逻辑回归分析
女性患者在BMI(P=0.000)、FBG分级(P=0.038)、TC(t=71.357,P=0.020)、TG分级(χ2=33.017,P=0.000)、HDL(t=38.724,P=0.000)和LDL(t=48.486,P=0.009)方面差异显著; 其他指标均无显著差异(P均大于0.05,因篇幅所限未列出),详见表5。多因素逻辑回归分析显示,超重(P=0.007,OR=1.152,95%CI:1.039-1.276)、肥胖(P=0.000,OR=1.452,95%CI:1.239-1.702)、TG水平边缘升高(P=0.016,OR=1.229,95%CI:1.041-1.450)与TG高危水平(P=0.010,OR=1.219,95%CI:1.050-1.416)是女性NAFLD独立危险因素(表6)。
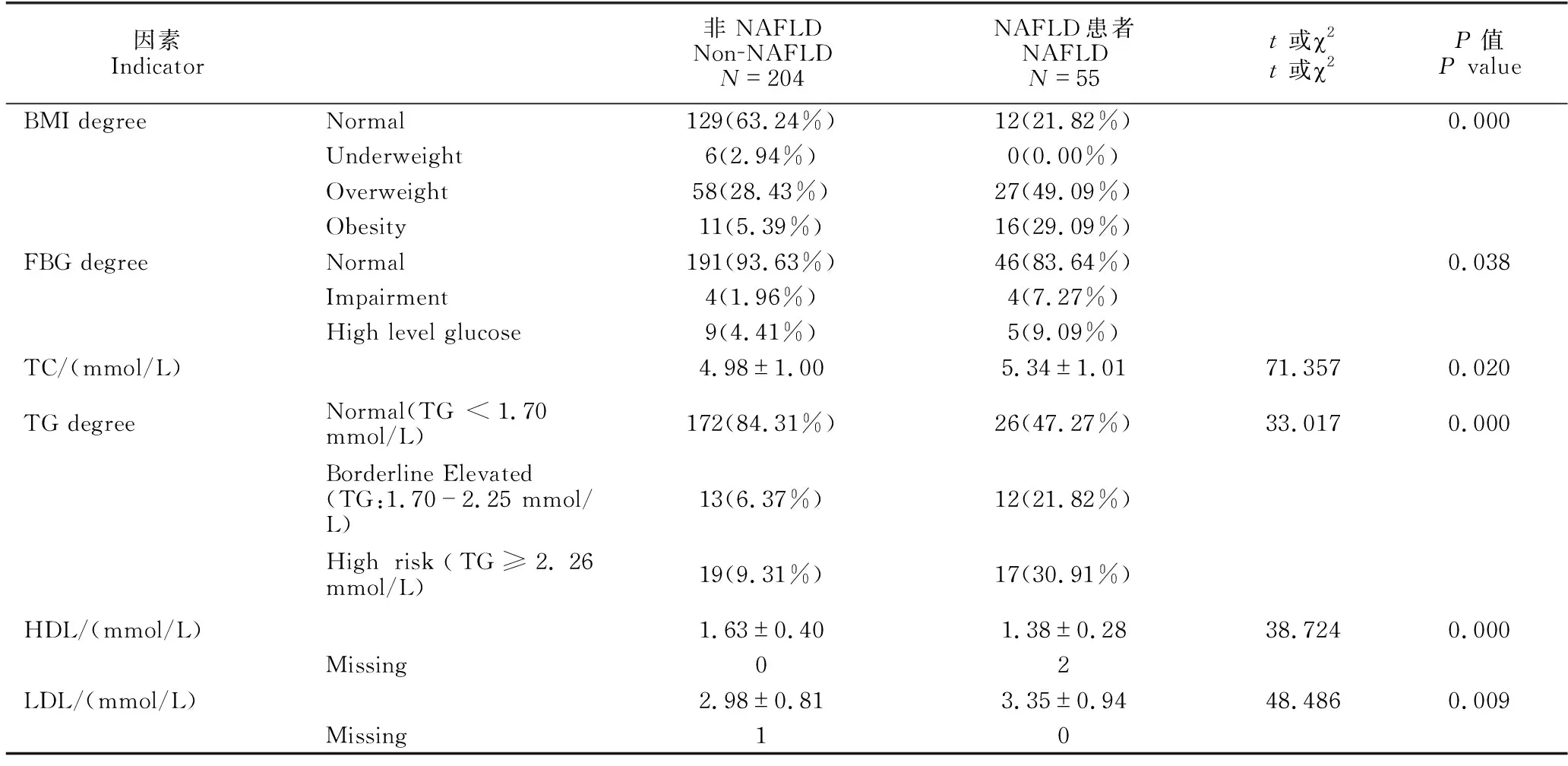
表5 女性非NAFLD群体与NAFLD对象各指标组间比较
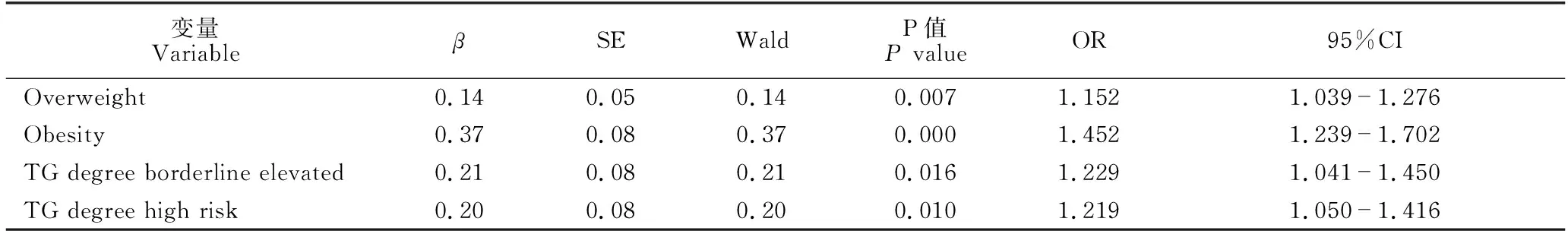
表6 女性NAFLD相关影响因素logistic回归分析
3 讨论
当前全球NAFLD的总体患病率约为25.2%[3]且呈明显上升趋势,如何降低NAFLD的患病率已成为全球公共卫生一大难题[10]。我国2018年NAFLD防治指南公布的国人的患病率超过25%[8],但不同地区报道的NAFLD患病率存在一定差异,从19.7%到32.2%不等[11,12]。在本研究中,研究对象的NAFLD患病率为31.89%,与上述研究结果[12]接近。
在发病影响因素方面,单因素研究结果显示,NAFLD患者在男性占比、超重和肥胖占比、血TC水平、TG水平边缘升高和高危占比、LDL水平与细粮为主的主食构成上显著高于非NAFLD群体;而HDL水平显著低于非NAFLD群体。多因素逻辑回归结果显示,超重、肥胖、TG高危水平与细粮为主的主食结构是NAFLD发病的独立危险因素。这说明控制好体重与TG水平并且改善主食结构是预防NAFLD的有效措施。上述指标是关于患者生活方式的研究结果,但从本研究使用的问卷调查结果来看,NAFLD患者和非NAFLD群体在反映生活方式的问卷调查项目中未体现出具有统计学意义的显著性差异,这可能与性别等问卷调查项目不够细化有关。此外,从反映肝细胞生理功能的常用指标ALT与AST来看,虽然NAFLD群体的ALT与AST水平显著高于非NAFLD群体,但是在多因素逻辑回归中未发现其有独立影响,且在不同性别的分层研究中也未发现二者水平与NAFLD发病存在相关性,这与尹慧君等[13]的研究结果相符;但曾子露等[14]认为ALT与AST是NAFLD发病的独立危险因素,研究结果不同的原因可能是本研究样本例数过少以及研究对象的年龄层次与前人研究不同。
由于NAFLD患者和非NAFLD群体在性别上存在差异,因此本研究对性别进行分层研究。单因素研究显示,男性NAFLD患者的年龄小于60岁占比、超重和肥胖占比、TG高危水平者占比、主食构成细粮为主占比与不运动者占比显著高于男性非NAFLD群体,而HDL水平、不饮酒者占比与经常摄入豆类占比显著低于非NAFLD群体。多因素逻辑回归分析显示,超重、肥胖、TG高危水平、细粮为主的主食构成是男性NAFLD发病的独立危险因素;年龄大于等于60岁、经常摄入豆类是男性NAFLD发病的保护性因素。同时,单因素研究显示,NAFLD女性患者的超重与肥胖占比、FBG受损与高血糖占比、血TC水平、TG边缘升高和高危占比、LDL水平显著高于女性非NAFLD群体,而HDL水平显著低于女性非NAFLD群体;多因素逻辑回归分析显示,超重、肥胖、TG水平边缘升高与TG水平高危是女性NAFLD发病的独立危险因素。
通过性别分层的研究结果来看,控制好体重与TG水平在正常范围内是女性预防NAFLD 发病的有效措施。而对于男性,虽然研究结果显示年龄小于60岁是NAFLD发病的保护性因素,但是这不符合实际,可能是60岁及以上的男性样本过少造成的;此外,经常摄入豆类有助于预防NAFLD。国内近年未见豆类摄入与NAFLD发病相关性的研究,而Bahrami等[15]发现,豆类摄入量的增加与NAFLD的风险降低有关,这可能是因为豆类食物是高蛋白质、高纤维和高植酸食品,因此摄入豆类有以下好处:增强饱腹感从而减少摄食;改善血糖;改善脂质分布,减少脂质过氧化;增加粪便中的脂肪和类固醇排泄以及结肠中的短链脂肪酸形成,降低血脂。对于女性,本研究的结果仅显示BMI与TG对NAFLD发病有独立影响,生活方式方面的因素的影响未能体现,这极有可能是问卷调查项目不够细化造成。
4 结论
综上,本文认为控制好BMI与TG水平有助于预防NAFLD发病。对于男性来说,改变细粮为主的主食结构并增加豆类的摄入有助于预防NAFLD。本研究的局限有以下几点:①样本量较小,对象来源于单中心,研究结果还有待多中心来源样本验证;②本研究采用的生活方式调查问卷制作时间较早(2014年),部分项目不够细化;③在执行问卷调查的过程中,有些数据未能完成收集,导致存在数据删失的现象。以上局限均可能对研究结果造成影响,在后续研究中还应根据当前大众的社会及家庭生活,制定更为细化的调查条目并进行更加系统的收集。
