电针预处理对脓毒症小鼠肠黏膜屏障功能保护作用及MLCK/MLC信号通路的调节作用
2023-10-24季春莲占靓卉郑静茹孟建标刘昊富丹婷庞丽莎
季春莲,占靓卉,郑静茹,孟建标,刘昊,富丹婷,庞丽莎
(1.浙江省立同德医院,杭州 310012;2.浙江省中医药研究院,杭州 310012;3.浙江中医药大学,杭州 310051)
足三里穴治疗胃肠病已有数千年历史,其穴名解释为“三理”即理上、理中及理下,意思是可治疗腹上部、中部和下部疾病,取足三里穴以通降胃之腑气以达通则不痛的目的[8]。课题组前期临床数据表明电针足三里穴可显著减轻脓毒症肠功能障碍患者的炎症反应并恢复肠黏膜屏障功能[9]。关于电针足三里穴是如何改善脓毒症诱发的肠黏膜屏障损伤仍需要进一步探究。故本研究旨在探讨电针足三里穴预处理对脓毒症肠黏膜损伤的保护作用,希望为脓毒症的治疗提供新的思路与选择。
1 材料与方法
1.1 实验动物
40只SPF级雄性美国癌症研究所(Institute of Cancer Research,ICR)小鼠,体质量(20±2)g,购于浙江实验动物中心[许可证号为SYXK(浙)2016-0022],动物合格证号为20210510Abzz0100018953。小鼠饲养于浙江省中医药研究院动物房,环境温度23~25 ℃,湿度70%~80%,自由摄食饮水,12 h昼夜间断照明。实验由浙江省中医药研究院伦理专业委员会批准进行(伦理号2019-059)。
1.2 主要试剂
脂多糖(Sigma,12181202);白细胞介素-1(interleukin-1,IL-1)(上海酶联免疫生物有限公司,m11063132-C)、白细胞介素-6(interleukin-6,IL-6)(上海酶联免疫生物有限公司,m1002293-C);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)(上海酶联免疫生物有限公司,m1002095-C)、降钙素原(procalcitonin,PCT)(上海酶联免疫生物有限公司,m1002192-C);C-反应蛋白(C-reactive protein,CRP)(上海酶联免疫生物有限公司,1038364-C);连接蛋白-5(claudin-5)抗体(Affinity Bioscience,AF5216);山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)(H+L)(Proteintech,SA00001-2);山羊抗小鼠IgG(H+L) (Affinity Bioscience,SA00001-1);β-actin抗体(Proteintech,660009-1-Ig);IL-6抗体(Proteintech,66146-1-Ig);TNF-α抗体(Proteintech,17590-1-AP);胞质紧密粘连蛋白-1(zonula occludens-1,ZO-1)抗体(Proteintech,21773-1-AP);闭合蛋白(occludin)抗体(Proteintech,27260-1-AP);Alexa Fluor 488标记山羊抗兔IgG(H+L)(Beyotime,P1076);BCA蛋白测定试剂盒(Beyotime,Lot No.082820210119);总RNA提取试剂(total RNA extraction reagent,TRIZOL) (Invitrogen,15596026);抗体染料法定量聚合酶链式反应(polymerase chain reaction,PCR)预混液(Monad,MQ10601S);去基因组与逆转录组一管化三代预混液(Monad,MR05101)。
1.3 分组与干预
ICR小鼠适应性喂养7 d后随机分为4组:正常组、模型组、电针组和非经非穴组,每组10只。电针组小鼠进行电针预处理。小鼠双下肢备皮后常规消毒,固定小鼠,选取0.25 mm×25 mm一次性针灸针于膝关节后外侧、腓骨小头下约3.5 mm处选取足三里穴[10],直刺进针3 mm左右,连接韩氏电针仪并持续30 min(疏密波,2.5 mA,频率2~100 Hz),以小鼠双下肢出现轻微颤动且不挣扎为度;非经非穴组小鼠电针刺激足三里穴旁开5 mm处,采用同样刺激参数,其余操作同电针组;电针组和非经非穴小鼠连续干预5 d,模型组与正常组小鼠不作干预。末次干预结束后,模型组、电针组和非经非穴小鼠腹腔注射脂多糖(lipopolysaccharide,LPS)溶液(10 mg/mL)进行脓毒症模型制备,依据文献及前期预实验结果发现造模3 h后小鼠出现精神萎靡、竖毛等表现表明造模成功[11],正常组小鼠腹腔注射相同体积生理盐水。造模3 h后通过眼眶取血收集小鼠血浆,后续通过离心获得上清,然后将所有小鼠腹腔注射戊巴比妥钠溶液[30 mg/(kg·bw)]进行麻醉处死,收集小鼠粪便以及将小鼠结肠组织在生理盐水中洗净残留粪便,样本均置于-80 ℃冰箱储存备用,另外取末端回肠组织1 cm固定于福尔马林中,以备后续检测。
1.4 指标检测
1.4.1 苏木精-伊红(hematoxylin-eosin,HE)染色和肠组织损伤评分
回肠组织固定于福尔马林溶液中48 h后,进行组织脱水,石蜡包埋,切片、HE染色和中性树胶封片,最后在光学显微镜下观察回肠组织病理形态,并根据肠黏膜损伤标准[12]对回肠组织进行病理评分。
1.4.2 酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测细胞因子表达
称取0.1 g左右结肠组织置于1.5 mL EP管中,并加入9倍量磷酸缓冲盐溶液(phosphate buffered saline,PBS),在30 Hz条件下进行超声破碎2 min,12 000 r/min离心5 min,取上清用于检测IL-1β、IL-6、TNF-α含量;另外取出-80 ℃冰箱中的血清样本用于检测CRP和PCT。将IL-1β、IL-6、TNF-α、CRP和PCT的ELISA试剂盒进行室温平衡60 min,然后加入50 µL待测组织上清液和100 µL辣根过氧化物酶标记的检测抗体,并于37 ℃恒温箱中温育60 min;接着弃去液体,洗板5次后每孔加入底物A和B各50 µL,于37 ℃恒温箱中避光孵育15 min;最后加入50 µL终止液,在450 nm波长处测定各孔OD值。
两者的设计理念不同,G9追求旗舰级单反的操控和使用体验。而E-M1 II则是正统的无反思路。如果你倾向于旅行、街头拍摄,E-M1 II显然用起来更加方便。但如果你专注体育题材拍摄,或者手比一般人都大,G9的设计会更加适合你。
1.4.3 蛋白印迹(Western blot,WB)法检测蛋白表达
称取80 mg左右的结肠组织置于1.5 mL EP管中,并加入9倍量放射免疫沉淀法(radio immunoprecipitation assay,RIPA)裂解液,用以提取组织中蛋白,利用BCA蛋白测定试剂盒确定蛋白浓度,在10%聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)凝胶中分离蛋白裂解物,通过转膜使其电转至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜上,在5%脱脂牛奶中封闭2 h后与IL-1β(1:1 000)、IL-6(1:6 000)、TNF-α(1:1 000)、β-actin(1:10 000)、claudin-5(1:2 000)、occludin(1:600)抗体在4 ℃条件下共孵育过夜,次日与二抗于室温下共孵育2 h后,利用化学发光试剂盒再进行成像检测,并利用Image J软件对其灰度值进行定量分析。
1.4.4 逆转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)技术检测肌球蛋白轻链激酶(myosin light chain kinase,MLCK)、肌球蛋白轻链(myosin light chain,MLC)、ZO-1、claudin-5、occludin基因表达量称取50 mg左右结肠组织置于1.5 mL EP管中,加入9倍量TRIZOL用以提取总RNA,然后通过RT-PCR试剂盒将其反转录为cDNA,采用SYBR Green检测MLCK、MLC、ZO-1、claudin-5、occludin在结肠组织中的表达,反应条件为95 ℃预变性30 s,95 ℃变性10 s,60 ℃退火及延伸30 s,40个循环。然后采用2-Ct法计算个基因的相对表达量,并以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为参照基因。各基因序列如表1所示。
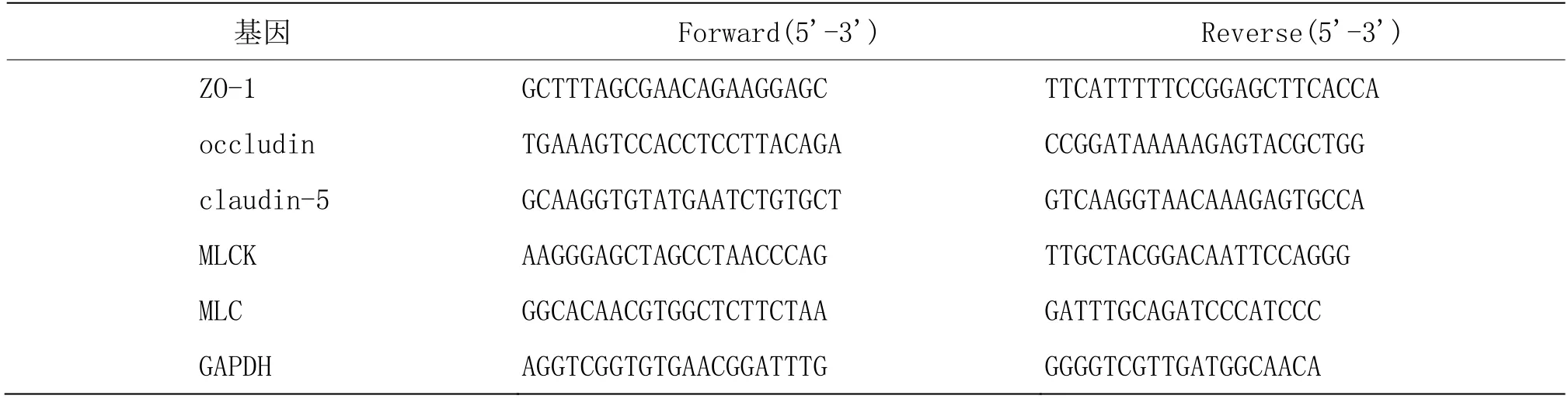
表1 各检测指标引物序列
1.4.5 免疫荧光法检测蛋白表达
4 µm荧光回肠组织石蜡切片经过脱蜡、水化和抗原修复后在固定液中固定10 min,洗涤3次后在封闭液中封闭60 min,然后在4 ℃的条件下与ZO-1(1:1 000)和claudin-5(1:1 000)抗体进行结合过夜,次日与荧光标记的二抗避光孵育60 min,然后加入少量DAPI染色液室温放置5 min,最后在玻片上滴加抗荧光淬灭剂后盖上玻片,在荧光显微镜下观察。
1.5 统计学方法
采用SPSS25.0软件对各组数据进行统计分析。符合正态分布的计量资料用均数±标准差表示,采用单因素方差分析比较数据,进一步两两比较采用LSD法。以P<0.05表示差异有统计学意义。
2 结果
2.1 电针预处理对脓毒症小鼠回肠组织病理学的影响
正常组小鼠肠道组织黏膜未见明显糜烂与缺失,且腺体排列规整和无炎症细胞浸润;模型组小鼠结肠组织出现细胞排列紊乱与缺失、结构被破坏、腺体变形,有显著的病理损伤;电针组小鼠回肠上皮细胞基本完整,腺体排列整齐,病理损伤较模型组有所减轻;非针非穴组小鼠回肠组织病理则与模型组小鼠相似。详见图1。与正常组比较,模型组小鼠回肠组织病理评分显著升高(P<0.05);与模型组比较,电针组小鼠回肠组织病理评分显著降低(P<0.05)。详见图2。提示电针足三里预处理可显著改善LPS诱导的肠黏膜组织病理损伤。

图1 4组小鼠回肠组织HE染色图(HE×40)

图2 4组小鼠回肠组织病理评分比较(±s,n=10)
2.2 电针预处理对脓毒症小鼠炎症因子的影响
ELISA结果显示,与正常组比较,模型组小鼠结肠组织中IL-1β、IL-6和TNF-α的含量显著增高(P<0.05);与模型组比较,电针组IL-1β、IL-6和TNF-α的含量降低(P<0.05)。详见图3。WB结果显示,与正常组比较,模型组IL-1β、IL-6和TNF-α蛋白表达显著上调(P<0.05);与模型组比较,电针组IL-1β、IL-6和TNF-α蛋白的表达明显下调(P<0.05)。详见图4和图5。提示电针预处理可通过降低促炎因子的表达抑制LPS引起的炎症反应。

图3 4组小鼠结肠组织中IL-1β、IL-6和TNF-α的含量比较(±s,n=10)

图4 WB检测4组小鼠结肠组织中IL-1β、IL-6和TNF-α蛋白表达条带图(n=10)
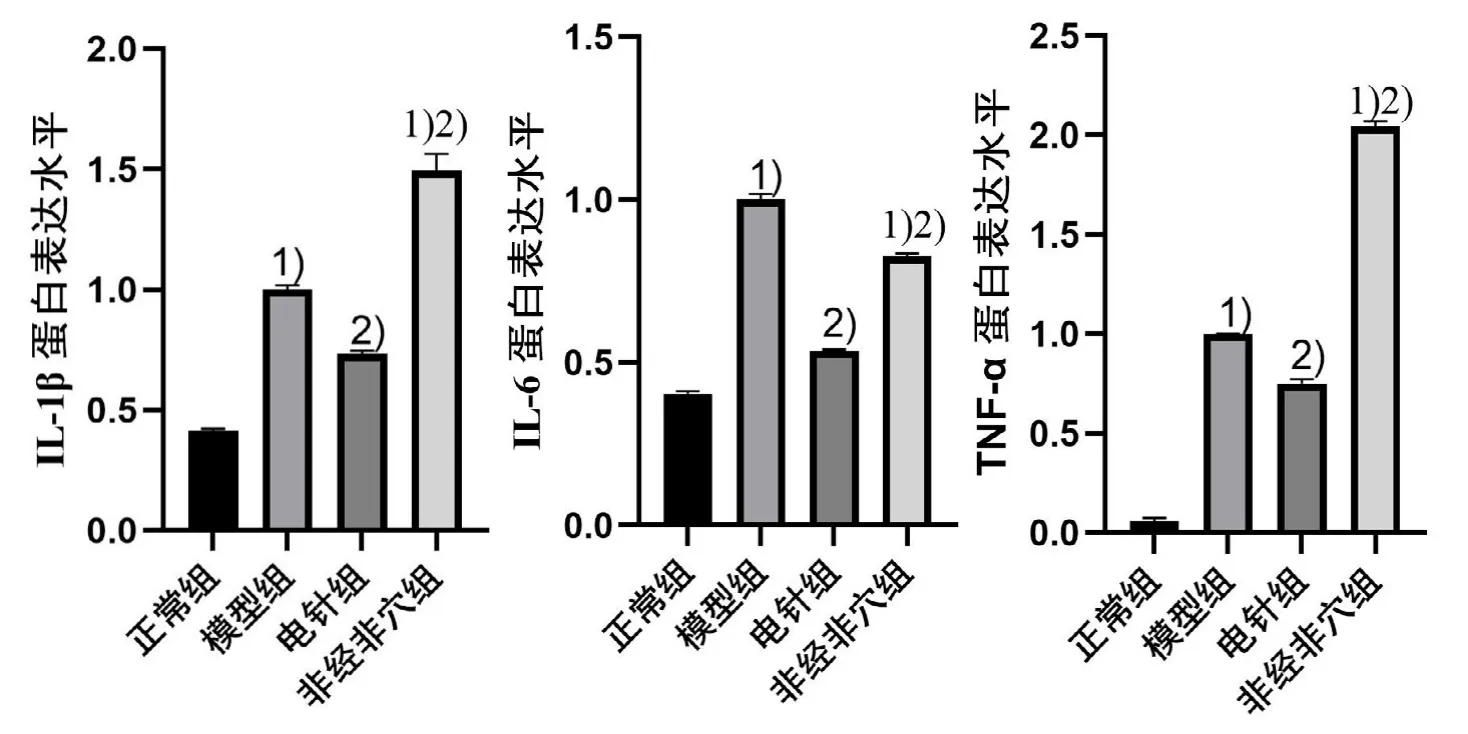
图5 4组小鼠结肠组织中IL-1β、IL-6和TNF-α蛋白表达比较(±s,n=10)
2.3 电针预处理对脓毒症小鼠血清CRP和PCT的影响
与正常组比较,模型组小鼠血清中CRP与PCT含量显著升高(P<0.05);与模型组比较,电针组血清中CRP与PCT含量明显下降(P<0.05)。详见图6。

图6 4组小鼠血清CRP与PCT含量比较(±s,n=10)
2.4 电针预处理对脓毒症小鼠紧密连接蛋白表达的影响
与正常组比较,模型组小鼠结肠组织中occludin蛋白、occludin mRNA、claudin-5 mRNA和ZO-1 mRNA的相对表达量显著降低(P<0.05);与模型组比较,电针组occludin蛋白、occludin mRNA、claudin-5 mRNA和ZO-1 mRNA的相对表达量显著提高(P<0.05)。详见图7和图8。模型组在LPS的作用下表达claudin-5和ZO-1蛋白的蓝绿色荧光强度较正常组弱,而电针组蓝绿色荧光强度较模型组强,详见图9和图10。提示电针足三里预处理可通过提高紧密连接蛋白的表达修复LPS引起的脓毒症肠黏膜损伤。

图7 4组occludin-5蛋白条带图
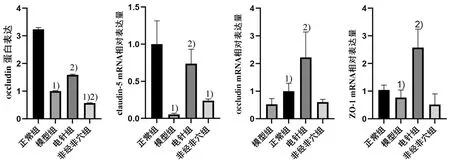
图8 4组小鼠结肠组织中occludin、occludin mRNA、claudin-5 mRNA和ZO-1 mRNA蛋白表达比较(±s,n=10)

图9 4组claudin-5免疫荧光蛋白图(×40)

图10 4组ZO-1的免疫荧光蛋白图(×40)
2.5 电针预处理对脓毒症小鼠MLCK/MLC信号通路的调节作用
与正常组比较,模型组小鼠MLCK和MLC mRNA相对表达量显著增加(P<0.05);与模型组比较,电针组小鼠MLCK和MLC mRNA相对表达量显著降低(P<0.05)。详见图11。提示电针足三里预处理可下调MLCK/MLC信号通路的表达,从而发挥肠黏膜损伤保护作用。

图11 4组小鼠MLCK和MLC mRNA相对表达量(±s,n=10)
3 讨论
脓毒症是一种机体对感染的反应失调导致的多器官功能障碍综合征(MODS),具有高发病率和死亡率[13]。由于胃肠道是MODS的始动器官,因此肠黏膜屏障功能在脓毒症发生发展过程中的作用早已引起广泛的关注[14]。目前临床针对肠黏膜功能的保护措施主要有益生菌、谷氨酰胺和肠黏膜保护剂等,但是脓毒症患者由于肠黏膜屏障功能损伤较重造成胃肠动力差,胃肠内给药容易出现潴留、腹泻,增加误吸风险等,效果均不尽如人意[15]。而足三里穴作为治疗胃肠疾病的经典穴和首选穴,在治疗脓毒症肠黏膜屏障功能损伤中具有明显的优势。因此本实验通过建立LPS诱导的脓毒症肠黏膜屏障功能损伤模型探讨了电针足三里预处理对其的治疗作用及潜在机制。实验数据表明电针足三里显著减轻脓毒症肠黏膜病理损伤和肠道炎症反应,并且可通过抑制MLCK/MLC信号通路上调紧密连接蛋白的表达修复肠黏膜屏障功能。
炎症失衡是脓毒症发病的关键基础,当机体发生脓毒症时肠道内的革兰氏阴性菌细胞壁会占据主导地位,而其主要成分LPS会刺激单核细胞或巨噬细胞产生IL-1β、IL-6、TNF-α等一系列促炎因子,引发炎症风暴[16-17]。CHEN L等[18]的研究表明在脓毒症模型中促炎因子显著增加,在引发炎症反应的同时也导致了肠源性感染。本实验数据也表明模型组小鼠肠组织中的上述促炎因子表达明显升高,肠黏膜也有明显的病理损伤。此外,临床研究表明电针足三里可减轻脓毒症患者的炎症反应,改善其肠功能障碍[19]。本研究中电针足三里的预处理不仅显著逆转了这些细胞因子的变化并且也减轻了LPS引起的肠黏膜组织损伤,这表明电针足三里可通过降低炎症反应保护脓毒症肠黏膜屏障损伤。
CRP和PCT作为响应炎症反应而产生的蛋白质,一直以来也是临床诊断脓毒症的关键指标和生物标志物[20]。CRP是在肝脏中被IL-6上调合成的蛋白质,在脓毒症急性炎症期间显著升高,可通过与微生物磷脂成分结合而促进巨噬细胞将其清除[21]。PCT是在LPS等内源性和外源性刺激下分泌的急性期蛋白,在脓毒症感染期间比其他炎症因子更早作为临床诊断标志物[22]。本实验结果也发现模型组小鼠在LPS的刺激下血清中PCT和CRP水平急剧上升,但是电针足三里逆转了其水平的增加。这进一步说明了电针足三里对脓毒症急性期引发的炎症风暴有显著的调控作用。
脓毒症肠黏膜屏障功能损伤一直被认为引发全身炎症反应启动的关键环节[23]。肠道紧密连接蛋白的破坏是导致肠道通透性增加、肠黏膜屏障损伤和功能障碍的主要原因之一[24]。紧密连接蛋白由ZO-1、occludin和claudin组成,ZO-1是一种可调控肠上皮细胞紧密连接蛋白的组装和逆转细胞间连接蛋白表达而对肠道通透性产生影响的支架蛋白[25]。occludin则是一种可与ZO-1连接的跨膜蛋白,其水平的改变可反映肠黏膜屏障破坏的程度,且有研究表明在肠上皮细胞系和动物模型中其表达的增加有助于肠黏膜屏障功能损伤的修复[26]。claudin-5通过形成紧密连接蛋白链在肠上皮细胞间形成屏障,当其异常表达时会导致肠上皮结构损伤和功能障碍,引发肠上皮细胞间隙通透性增加,最终使得LPS等物质透过肠黏膜屏障进入体循环导致脓毒症的发生[27]。在本研究中发现模型组小鼠ZO-1、occludin和claudin-5的表达均显著降低,相比之下电针足三里组小鼠紧密连接蛋白的表达有明显的逆转。这表明电针足三里可通过上调紧密连接蛋白的表达修复脓毒症肠黏膜损伤屏障并防止脓毒症进一步恶化。
研究表明MLCK是调控紧密连接蛋白的关键物质,当MLCK启动转录后增加MLCK蛋白的表达,又进一步促进MLC的激活,这促使了ZO-1、occludin和claudin-5等紧密连接蛋白的重新分布,导致肠黏膜屏障损伤[28]。YE X等[29]证明抑制MLCK/MLC信号通路的激活可增强紧密连接蛋白的表达从而抑制肠道通透性增加。本研究为进一步探究电针足三里对紧密连接蛋白的调控机制,对MLCK/MLC信号通路进行检测发现电针足三里抑制了LPS引起的MLCK和MLC的激活,提示该信号通路可能是电针足三里发挥肠黏膜屏障损伤保护作用的关键机制。
综上所述,电针足三里预处理可通过抑制炎症因子(IL-1β、IL-6、TNF-α)的分泌和上调紧密连接蛋白(ZO-1、occludin和claudin-5)的表达发挥对LPS诱导的脓毒症肠黏膜屏障功能损伤的保护作用,其调控机制可能与MLCK/MLC信号通路有关。但是本实验仍存在一定的缺陷,后续需对肠道损伤引发的细菌易位以及MLCK/MLC信号通路进行深入研究,并进一步探讨非经非穴部位在脓毒症发展过程中的作用。