长期施有机肥对设施番茄土壤稀有和丰富细菌亚群落的影响
2023-10-23刘蕾史建硕张国印郜静李玭任燕利王丽英
刘蕾,史建硕,张国印,郜静,李玭,任燕利,王丽英
长期施有机肥对设施番茄土壤稀有和丰富细菌亚群落的影响
刘蕾,史建硕,张国印,郜静,李玭,任燕利,王丽英
河北省农林科学院农业资源环境研究所/河北省肥料技术创新中心,石家庄 050051
【目的】将稀有和丰富细菌亚群落从整体群落中加以区分并探索两者分别对长期施肥的响应特征,为解析农业活动对微生物多样性与土壤功能稳定性之间的关系提供新视角。【方法】基于设施番茄长期定位试验,采集4个不同处理土壤样品:不施肥(M0)、低量有机肥5.68 t·hm-2(M1)、中量有机肥8.52 t·hm-2(M2)和高量有机肥11.36 t·hm-2(M3),利用Illumina MiSeq高通量测序技术,分析稀有和丰富细菌亚群落多样性、群落组成、共现网络和潜在功能差异,阐明两者对长期施肥的响应规律,并探讨驱动稀有和丰富细菌亚群落多样性和施肥响应差异的关键环境因素。【结果】稀有细菌亚群落α和β多样性均显著高于丰富细菌亚群落,且物种组成和潜在功能也与丰富细菌差异明显。功能预测结果显示丰富细菌负责设施农田主要生态系统功能,如养分和能量代谢,而稀有细菌更多体现在辅助功能上(例如辅酶代谢),为微生物群落功能冗余做出贡献。不同细菌亚群落多样性和组成对长期施肥响应差异较大,其中,与不施肥相比,长期施用有机肥和化肥使稀有细菌亚群落丰富度显著提高19.8%—53.8%、多样性显著提高5.8%—8.0%,总相对丰度显著提高1.1—1.2倍,改变稀有细菌亚群落组成和结构,并且随着有机肥施用量增加,稀有细菌丰富度显著提升,亚群落组成和结构也发生显著变化;与之相比,长期施肥并未显著改变丰富细菌亚群落多样性,仅群落组成受到影响。同时,细菌共现性网络复杂度随有机肥施用显著增加,且稀有细菌更敏感。非度量多维度分析(NMDS)和Mantel检验结果均显示,影响稀有和丰富细菌亚群落的关键环境因子不同,其中,土壤有机质、全量氮磷有效磷、速效钾、pH、大中团聚体等多种与确定性过程相关的土壤因子显著影响丰富细菌亚群落,结构方程模型(SEM)进一步显示土壤有机质和全磷直接驱动丰富细菌多样性变化;而稀有细菌亚群落受环境过滤的影响程度明显下降,且群落分散性更强,暗示两种亚群落构建机制可能存在差异。【结论】与丰富细菌和整体群落相比,稀有细菌亚群落呈现更高的多样性和独特的群落组成,提高微生物群落功能冗余;长期施肥主要通过影响稀有细菌(即提高多样性、改变群落组成、增加网络复杂度)而非丰富细菌,从而改变细菌整体群落,并且介导稀有和丰富细菌亚群落构建的环境因素也不相同。
稀有细菌;丰富细菌;有机肥;设施番茄;多样性;群落构建;生态系统功能
0 引言
【研究意义】土壤微生物对维持土壤生态系统功能和服务至关重要[1],其群落具有典型的物种丰度分布偏斜特征,表现为少数相对高丰度的优势(dominant)物种和大量相对低丰度的稀有物种共存,分别被称为“丰富生物圈(abundant biosphere)”和“稀有生物圈(rare biosphere)”[2],而后者的群落特征及对环境变化的响应机制基本处于认知盲区[3]。随着高通量测序技术快速发展,“稀有生物圈”构成的微生物“隐藏”多样性及“生态保险”功能才逐渐引发关注[2]。设施农业对解决我国耕地资源短缺、推进农业结构调整和实现乡村振兴具有重要意义,然而高集约化生产模式,特别是过量施肥极易引起土壤退化等一系列生态环境问题[4],而相较于传统理化指标,土壤微生物对环境变化更敏感,因此,通过土壤微生物性状的变化评估土壤受损程度和质量变化对长期施肥的响应已成为探索设施土壤质量保持和功能恢复的热点[5-6]。然而,现阶段有机肥和化肥对土壤微生物的影响结果多建立在丰富类群基础上,对稀有微生物群落分布和响应特征仍知之甚少。因此,将稀有和丰富亚群落从整体群落中加以区分,分别研究两者群落特征、潜在功能和对长期施肥的响应差异,并探讨驱动其多样性和施肥响应差异的关键环境因素,可以为解析农业活动对微生物多样性与土壤功能稳定性之间的关系提供新视角,并为人口压力带来的农业强度不断增加背景下,制定以保护农田土壤微生物多样性和减少集约施肥对陆地生态系统影响的施肥策略提供科学依据。【前人研究进展】理解稀有微生物多样性、群落组成及其背后的群落构建机制和生态系统服务功能,探索“稀有生物圈”对环境变化(或扰动)的响应规律,是目前微生物生态学的前沿[7]。基于现有少量的水体生态系统[3,8-10]和有限的草地[11]、冰川[12]、茶果园[7]、玉米[13]和石油污染[14]等土壤中的研究证实,与丰富微生物相比,稀有微生物呈现独有的群落特征和环境变化响应机制。目前普遍认为稀有微生物系统发育多样性和功能多样性显著高于丰富微生物,作为“种子库(seedbank)”和“功能池(pool)”在增强生态系统稳定性和保持土壤健康方面具有重要作用和意义[15-17]。但驱动稀有和丰富微生物群落分布的因素及两者对环境扰动的响应特征仍存在争议,例如有研究认为介导两者群落构建的因素不同[13-14,18],因此面对环境扰动,两者呈现差异性响应。但也有研究显示两者受相同因素驱动[19],只是影响强度不同引起了两者对扰动响应的不均衡(unequally)[20]。当环境变化时,一般认为稀有微生物对扰动敏感性更强,较丰富微生物更为脆弱[19,21],但也有结果相反[13]。然而,对于陆地生态系统中人为干扰最强烈、生态环境更脆弱的半开放特殊农业生境,设施土壤“稀有生物圈”相关信息仍未见任何报道。施肥作为一种重要的农业措施,会加速土壤退化进程[22],但近年来研究表明,与化肥相比,合理施用有机肥可以通过提高土壤微生物多样性和多功能性,减少集约施肥的负面效应,并且相对于丰富微生物,稀有微生物是土壤多功能性的主要驱动力[23]。但总体上,我们对农田生态系统中有机肥和化肥施用对土壤微生物影响的大量研究结果均基于优势物种,而对于长期施肥如何影响稀有微生物群落构建及功能发挥却所知有限,鉴于稀有微生物可能在土壤功能和生态系统服务中发挥着超比例的作用,这种认知局限性极大地降低了我们对生态系统响应预测的准确性。【本研究切入点】虽然现阶段对稀有微生物群落的关注与日俱增,但大部分研究仍以优势物种为基础,特别是在我国设施高集约化生产下,与丰富微生物相比,稀有微生物是否呈现不同的多样性模式和施肥响应规律尚不明确。【拟解决的关键问题】本研究基于设施番茄长期定位试验,采集不同有机肥施用量下的土壤样品,利用Illumina MiSeq高通量测序技术分析稀有和丰富细菌亚群落多样性、群落组成、共现网络和潜在功能差异,阐明两者对长期施肥的响应规律,并探讨驱动稀有和丰富细菌亚群落特征和施肥响应差异的关键环境因素,为保护农田土壤微生物多样性和科学施肥提供依据。
1 材料与方法
1.1 试验设计
试验位于河北省农林科学院大河试验园区(38°08′24″,114°23′38″),地处石家庄市鹿泉区大河镇大河村,地貌为太行山山前平原,土壤为黏壤质石灰性褐土,年均温13.3 ℃,降水量550 mm,属于温带半湿润大陆性季风气候。试验开始于2013年,种植冬春茬番茄(3—7月),一年一茬。试验开始前土壤基础理化性质:容重1.44 g·cm-3、pH 8.20、有机质15.94 g·kg-1、全氮0.85 g·kg-1、硝态氮14.77 mg·kg-1、有效磷12.94 mg·kg-1、速效钾91.25 mg·kg-1。
试验设置4个处理:(1)不施肥(M0);(2)低量有机肥5.68 t·hm-2(M1);(3)中量有机肥8.52 t·hm-2(M2);(4)高量有机肥11.36 t·hm-2(M3)。随机区组,每个处理3次重复(小区),小区面积12 m2。为防止长期大量施用有机肥引起磷素累积和淋失,有机肥采用“以磷定氮”施肥原则,依据番茄目标产量(130 t·hm-2)对应磷素带走量的1.0倍(88 kg P2O5·hm-2)、1.5倍和2.0倍分别确定低(M1)、中(M2)、高(M3)量有机肥施用量,3个处理化肥施用量相同。番茄于每年3月施用商品有机肥和复合肥作为底肥,每穗果坐果后追水溶肥一次,共6次,具体养分投入量见表1。

表1 不同施肥处理下养分投入量
1.2 样品采集与测定方法
1.2.1 土壤样品采集 于2021年7月番茄拉秧时在每个小区从东至西随机用土钻采集5个表层(0—20 cm)土壤并混合为一个样品,共获得12个土壤样品(4个处理,3次重复)。采集的土壤样品放入冰盒带回实验室,一部分土壤尽量保持原状风干用于土壤团聚体和机械组成测定,剩余土壤过2 mm筛后分成两份,一份保存于-20 ℃,用于微生物测定,一份保存于4 ℃,用于土壤化学性质测定。
1.2.2 土壤理化性质测定 土壤团聚体分组采用湿筛法。取100 g风干土壤样品置于由2.000、0.250、0.053 mm孔径组成的套筛最上层,加入蒸馏水淹没浸泡10 min,以振幅3 cm、频率30次/min持续振荡5 min,结束后将各孔径筛子上的土壤颗粒分别洗入铝盒中,60 ℃烘干称重,其中,> 2 mm、0.25—2 mm、0.053—0.25 mm、<0.053 mm分别对应大团聚体、中团聚体、微团聚体和矿质颗粒组分[24]。土壤机械组成采用比重计法(GB7845—87)测定。土壤化学性质测定参照《土壤农化分析》[25],pH用1 mol·L-1KCl浸提(土水比1﹕2.5)电位法测定,有机质用油浴加热重铬酸钾氧化-容量法,全氮采用凯氏法,全磷采用氢氧化钠熔融-钼锑抗比色法,全钾用碱熔-火焰光度法,硝态氮和铵态氮用0.01 mol·L-1CaCl2溶液浸提(土水比1﹕10)后采用流动分析仪测定,Olsen-P用0.5 mol·L-1NaHCO3(pH=8.5)溶液浸提(土水比20﹕1)钼锑抗比色法,速效钾采用1 mol·L-1NH4OAc(pH=7.0)浸提(土水比1﹕10)火焰光度法,水溶性盐采用电导法测定。
1.2.3 土壤高通量测序和序列处理 采用E.Z.N.A.® soil DNA kit(Omega Bio-tek,Norcross,GA,美国)试剂盒提取土壤DNA,用NanoDrop 2000测定DNA浓度和纯度。使用引物338F(5′-ACTCCTACGGGAGG CAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTA AT-3′)对细菌16S rDNA V3V4基因进行扩增,采用Illumina Miseq PE300平台进行测序(美吉, 上海)。测序获得的原始序列经过QIIME平台筛选和序列优化后,依据97%的相似度聚类成操作分类单元(operational taxonomic unit,OTU)(UPARSE 7.1),选取每个OTU 中丰度最高的序列作为代表序列,以RDP classifier贝叶斯算法对比SILVA数据库进行分类学信息注释。去除单序列(singletons)的OTU(只包含一条序列的OTU)[9]。然后基于序列数24 692进行抽平,对所有样本进行标准化,以抽平后的OTU丰度表进行后续分析[9]。
1.3 数据处理
基于OTU相对丰度分别在局域(local)和区域(regional)水平将其分为稀有和丰富细菌,划分阈值采用先前广泛发表的分类标准[3,8,10]:局域水平下(即一个样品中),相对丰度>1%的OTU被定义为丰富细菌,相对丰度<0.01%的OTU被定义为稀有细菌;区域水平下(即在所有样品中),平均相对丰度>0.1%的OTU被定义为丰富细菌,平均相对丰度<0.001%的OTU被定义为稀有细菌。
采用单因素方差分析(one-way ANOVA)比较不同施肥处理对土壤理化性质、细菌α多样性及相对丰度的影响,并用LSD检验进行多重比较,用Kruskal-Wallis检验比较整体、丰富和稀有细菌α和β多样性差异显著性,均在SPSS 18.0中进行。细菌α多样性采用OTU丰富度和Shannon多样性表征,用R软件vegan程序包“diversity”函数计算。采用“metaMDS”函数计算样本间Bray-Curtis相异性用以表征细菌β多样性[14],并通过基于Bray-Curtis距离算法的非度量多维度分析(NMDS)展示细菌群落分布特征[9],用“envfit”分析环境变量与细菌群落变化之间的关系,仅保留影响显著的因子(<0.05),多元分析之前群落数据进行平方根转化,环境变量进行lg(+1)转化。采用“anosim”函数进行置换多元方差分析(PERMANOVA)进一步统计不同施肥处理下细菌群落差异显著性,置换次数999。Mantel检验用于分析环境变量对细菌群落的影响,以及整体、丰富和稀有细菌群落的相似性[18]。进一步以结构方程(SEM)分析NMDS和Mantel检验中显著的环境因子对不同细菌亚群落分布的直接和间接作用,用丰富度代表多样性,环境变量进行lg(+1)转化,模型拟合结果判断标准:Chi-square/df<2,>0.05,Root mean square error of approximation(RMSEA)<0.05,计算在软件Amos 17.0中进行[26]。基于样本OTU之间Spearman系数进行共现性网络分析,仅保留稳健相关(>0.8,<0.01)的OTU对儿进行构建,每个节点代表一个OTU,节点大小与度(degree)相关,拓扑结构参数采用Cytoscape 3.9.0软件计算,可视化通过网络平台https:// www.omicstudio.cn/tool/实现[19]。采用Tax4Fun程序包对细菌进行功能预测,并用Wilcoxon秩和检验比较丰富和稀有细菌功能基因丰度差异显著性[18]。
2 结果
2.1 土壤理化性质
长期施肥显著改变了设施番茄土壤理化性质(表2)。与不施肥相比,有机肥和化肥施用显著提高了土壤有机质、全氮、全磷、有效磷、速效钾以及大、中团聚体含量,并显著降低了土壤pH。不同有机肥施用量之间,土壤有机质含量随有机肥施用量增加显著提升,高量有机肥处理(M3)的土壤全氮、全磷和速效钾含量显著高于低量有机肥处理(M1),中高量有机肥处理(M2、M3)的土壤有效磷含量显著高于低量有机肥处理(M1),高量有机肥处理(M3)的pH显著低于中、低量有机肥处理(M1、M2)。
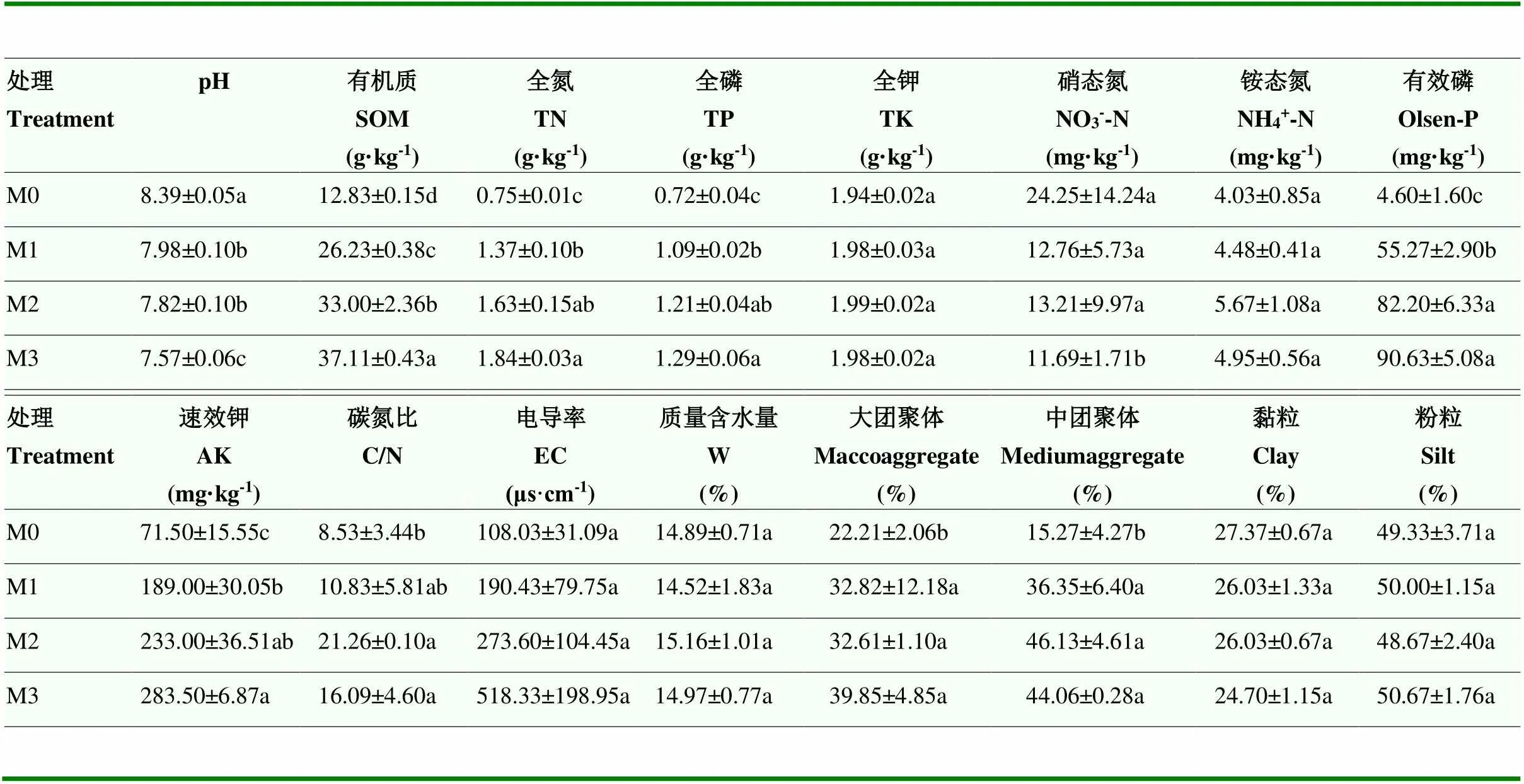
表2 不同有机肥施用量土壤理化性质
数据为平均值±标准误。同列不同字母表示差异显著(<0.05)。下同
Data are presented by mean±SE. Different letters in the same column indicate a significant difference at<0.05. The same as below
2.2 稀有和丰富细菌亚群落α多样性
高通量测序数据经过质量过滤和去除嵌合体后,共保留1 360 939条高质量序列(各样本34 492— 58 303),平均418 bp。去除单序列OTU并抽平后,共得到4 554个OTU。在每个样本中,平均46.5%(41.7%—50.3%)的OTU被鉴定为稀有细菌,平均相对丰度仅为6.0%(4.9%—6.5%)。相比之下,每个样本中所占比例很低的OTU被鉴定为丰富细菌(0.9%—1.5%),平均相对丰度却可达23.0%(16.5%—45.1%)。所有样本中,分别有381和206个OTU属于稀有和丰富细菌,平均相对丰度分别为0.2%和55.9%。
在局域水平下,稀有细菌亚群落呈现更高的α多样性(表3),其丰富度和多样性分别比丰富细菌亚群落平均高出45.1%和1.5%。长期施肥对设施番茄土壤稀有和丰富细菌亚群落α多样性的影响差异较大,其中,与不施肥相比,施肥处理下稀有细菌亚群落丰富度和多样性分别显著提高了19.8%— 53.8%和5.8%—80.0%,并且稀有细菌亚群落丰富度呈现随有机肥施用量增加显著上升的趋势,然而,丰富细菌亚群落α多样性受施肥影响不大(表3)。总体上,细菌整体群落(所有OTU)丰富度和多样性随有机肥施用分别显著提高20.7%—27.5%和12.1%—15.1%,但不同有机肥施用量之间差异不显著(表3)。
2.3 稀有和丰富细菌亚群落组成
丰富细菌亚群落组成和整体群落组成更为相似,门水平上,相对丰度前10名均为变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadota)、异常球菌-栖热菌门(Deinococcota)、甲基肌酐门(Methylomirabilota)、黏细菌门(Myxococcota)和拟杆菌门(Bacteroidota)(图1)。与丰富细菌相比,稀有细菌亚群落涵盖了更多类群,包含了25个细菌门分类水平,是丰富细菌亚群落的1.8倍,其组成也与丰富细菌有所差异,相对丰度排名前10的种群分别为绿弯菌门、变形菌门、厚壁菌门、拟杆菌门、髌骨菌门(Patescibacteria)、黏细菌门、酸杆菌门、蛭弧菌门(Bdellovibrionota)、放线菌门和浮霉菌门(Planctomycetota)(图1)。除此以外,装甲菌门(Armatimonadota)、蛭弧菌门、脱铁杆菌门(Deferrisomatota)、脱硫杆菌门(Desulfobacterota)、迷踪菌门(Elusimicrobiota)、食氢菌门(Hydrogenedentes)、匿杆菌门(Latescibacteria)、Margulisbacteria、浮霉菌门(Planctomycetota)和疣微菌门(Verrucomicrobiota)仅分布在稀有细菌亚群落,而甲基肌酐门(Methylomirabilota)和硝化螺菌门(Nitrospirota)仅分布在丰富细菌亚群落。
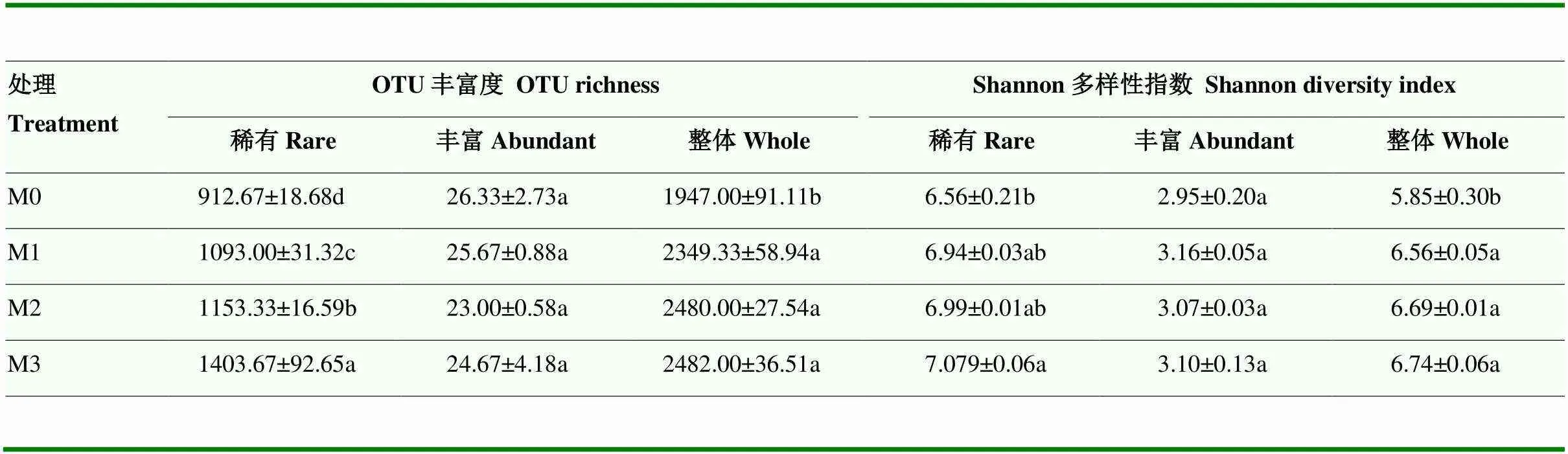
表3 不同施肥下细菌亚群落α多样性
稀有:稀有细菌亚群落;丰富:丰富细菌亚群落;整体:整体群落。下同
Rare: The rare bacterial sub-community; Abundant: The abundant bacterial sub-community; Whole: The whole bacterial community. The same as below

Rare:稀有细菌亚群落;Abundant:丰富细菌亚群落;Whole:整体群落。下同
丰富细菌亚群落和整体群落组成对于长期施肥的响应也更为相似,从图1可以看出,与不施肥相比,施肥处理下丰富细菌亚群落和整体细菌群落中变形菌门相对丰度分别显著提高了1.4—1.8倍和1.3—1.7倍,放线菌门相对丰度分别显著提高了1.8—1.9倍和约1.6倍;酸杆菌门和异常球菌-栖热菌门相对丰度分别显著下降了35.7%—49.6%、31.2%—51.4%以及86.8% —96.1%、86.8%—93.5%。丰富细菌总相对丰度(55.8%—59.1%)在施肥与不施肥处理之间差异不大,与此相比,有机肥和化肥处理下稀有细菌总相对丰度(0.2%)是不施肥处理的1.1—1.2倍。除此以外,不同有机肥施用量并未显著影响稀有细菌亚群落中变形菌门、放线菌门等相对丰度较高的类群,而是通过影响相对丰度更低的种群改变群落组成(即相对丰度排名11以后的门水平分类,图1中合并为其他Others),例如装甲菌门、脱硫杆菌门只分布在不施肥或者低量有机肥处理中,而食氢菌门只分布在中高量有机肥处理中。
2.4 稀有和丰富细菌亚群落β多样性
在区域水平下,稀有细菌亚群落β多样性显著高于丰富细菌和整体群落(图2),并且从NMDS结果可以看出,丰富细菌亚群落分布格局更接近整体群落,而稀有细菌亚群落分散性更强(图3),Mantel检验也证实该结果(丰富vs整体,=0.99,<0.01;稀有vs整体,=0.24,=0.03)。不同细菌亚群落对长期施肥响应差异较大,其中,稀有细菌亚群落结构随有机肥施用量增加发生显著变化(图3-a),与ANOSIM分析结果一致(M0 vs M1,=0.33,=0.02;M0 vs M2,=0.59,=0.01;M0 vs M3,=0.84,<0.01;M1 vs M3,= 0.39,=0.02;M2 vs M3,=0.66,=0.01),而丰富细菌亚群落结构受施肥影响不大(图3-b)。总体上,不施肥处理细菌整体群落结构显著差别于施肥处理(ANOSIM,M0 vs M1,=0.37,=0.02;M0 vs M2,=0.59,=0.01;M0 vs M3,=0.81,<0.01),但不同有机肥施用量之间群落结构差异不显著(图3-c)。

图2 不同细菌亚群落基于Bray-Curtis相异性的β多样性差异
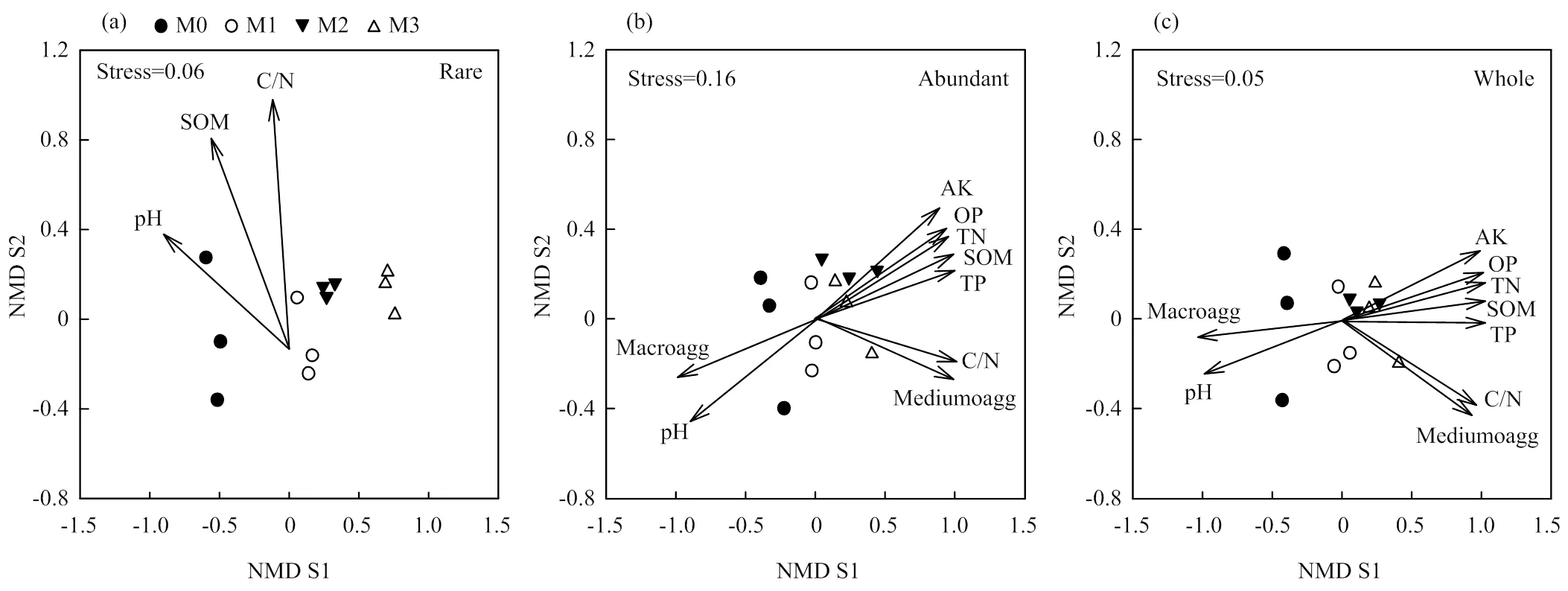
图3 不同细菌亚群落非度量多维度分析(NMDS)分布图
2.5 稀有和丰富细菌亚群落共现模式
采用共线性网络分析确定细菌潜在相互作用和不同亚群落对长期施肥的响应规律,分别在356(M0)、502(M1)、538(M2)和580(M3)个OTUs(节点)中捕获了1 056、2 271、2 109和2 364个关联(Edges),其中大多数OTUs是稀有细菌(图4)。与M0相比,M1—M3节点数、关联数、度和节点间正相关比例分别显著增加了1.4—1.6倍、2.0—2.2倍、1.0—1.2倍和1.0—1.1倍,且随有机肥施用量增加,节点数和节点间正相关比例(M1:83.9%、M2:86.7%、M3:92.4%)不断提升,说明有机肥施用显著增加了群落共现性网络复杂度,并促进细菌间相互作用。其中,稀有细菌节点数、度和节点间正相关比例随有机肥用量升高增加幅度(44.4%—75.2%、3.5%—23.1%、4.8%—13.3%)大于丰富细菌(35.9%—45.1%、-3.7%—-15.8%、0—12.2%),即施肥对稀有细菌群落稳定性影响更大。

图4 不同细菌亚群落共现性网络分析
2.6 影响稀有和丰富细菌亚群落的环境因素
非度量多维度分析(NMDS)结果显示,土壤有机质(丰富,2=0.94,<0.01;整体,2=0.94,<0.01)、全氮(丰富,2=0.93,<0.01;整体,2=0.94,<0.01)、全磷(丰富,2=0.91,<0.01;整体,2=0.94,<0.01)、pH(丰富,2=0.87,<0.01;整体,20.88,<0.01)、有效磷(丰富,2=0.86,<0.01;整体,2=0.87,<0.01)、速效钾(丰富,2=0.82,<0.01;整体,2=0.84,<0.01)、大团聚体含量(丰富,2=0.81,<0.01;整体,2=0.75,<0.01)、碳氮比(丰富,2=0.57,=0.02;整体,2=0.54,=0.02)和中团聚体含量(丰富,2=0.57,<0.01;整体,2=0.54,<0.01)是显著影响丰富细菌亚群落和整体群落结构的关键环境因素(图3-b,3-c),与Mantel检验结果完全一致(表4)。然而,NMDS结果显示仅土壤有机质(2=0.67,<0.01)、碳氮比(2=0.58,=0.02)和pH(2=0.56,=0.04)显著影响稀有细菌亚群落分布(图3-a)。Mantel检验也表明显著影响稀有细菌亚群落分布的环境因素数量少于丰富细菌亚群落和整体群落,并且相关性值也明显降低(表4),说明相对于丰富细菌,稀有细菌亚群落受环境过滤(Filtering)影响程度降低。
进一步采用SEM模型分析施肥及其引起的土壤性质变化对不同细菌亚群落多样性的直接和间接影响,模型对稀有和丰富细菌多样性变化的解释度分别为92.3%和85.5%(图5)。与NMDS和Mantel检验结果一致,SEM模型也显示影响稀有和丰富细菌亚群落多样性的环境因素及其作用的直接/间接途径存在差异:施肥对稀有细菌多样性有显著正效应,但土壤属性和稀有微生物多样性之间无显著联系,根据标准化总效应,施肥是调控稀有细菌多样性的首要因素;丰富细菌响应趋势相反,施肥主要通过显著改变土壤有机质和全磷,分别对丰富细菌多样性产生显著直接负效应和正效应,土壤有机质和全磷是影响丰富细菌多样性的重要因素(图5)。

表4 不同细菌亚群落与环境因子相关性(pearson)的Mantel检验
加粗字体表示显著相关 Bold fonts indicate significant correlation (<0.05)
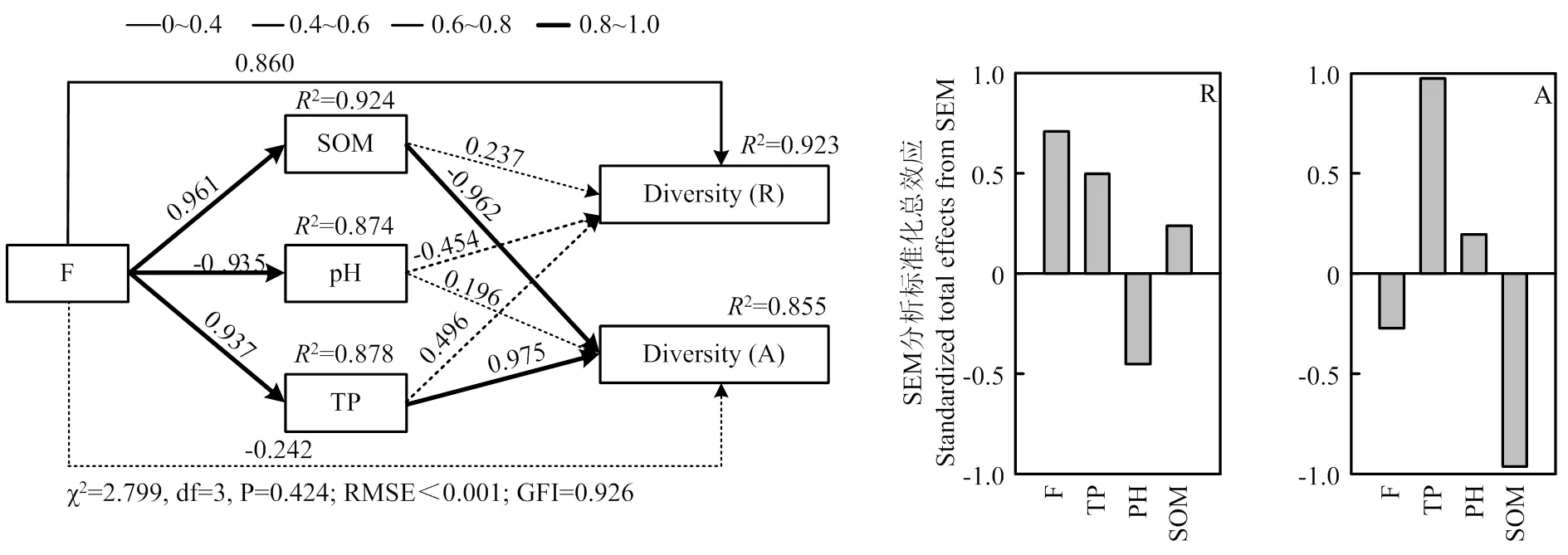
模型中实线和虚线分别表示显著和不显著的路径,路径上的数值表示标准化的路径系数。R2表示模型对该变量的解释量。R:稀有细菌亚群落;A:丰富细菌亚群落;F:施肥量
2.6 稀有和丰富细菌潜在功能
基于Tax4Fun对不同细菌亚群落进行潜在功能预测,结果显示稀有细菌亚群落KEGG一级代谢通路中遗传信息处理和细胞进程功能基因丰度(9.3%、4.2%)显著高于丰富细菌亚群落,但代谢功能基因丰度(57.6%)显著低于丰富细菌(63.9%)。进一步基于KEGG二级代谢通路分析可以看出,与辅酶和维生素代谢、信号转导和细胞运动等功能相关的基因丰度在稀有细菌亚群落中显著更高,而与碳水化合物代谢、脂代谢、膜传输相关的功能基因丰度在丰富细菌亚群落中显著更高(图6),因此稀有和丰富细菌亚群落在功能上也存在差异。
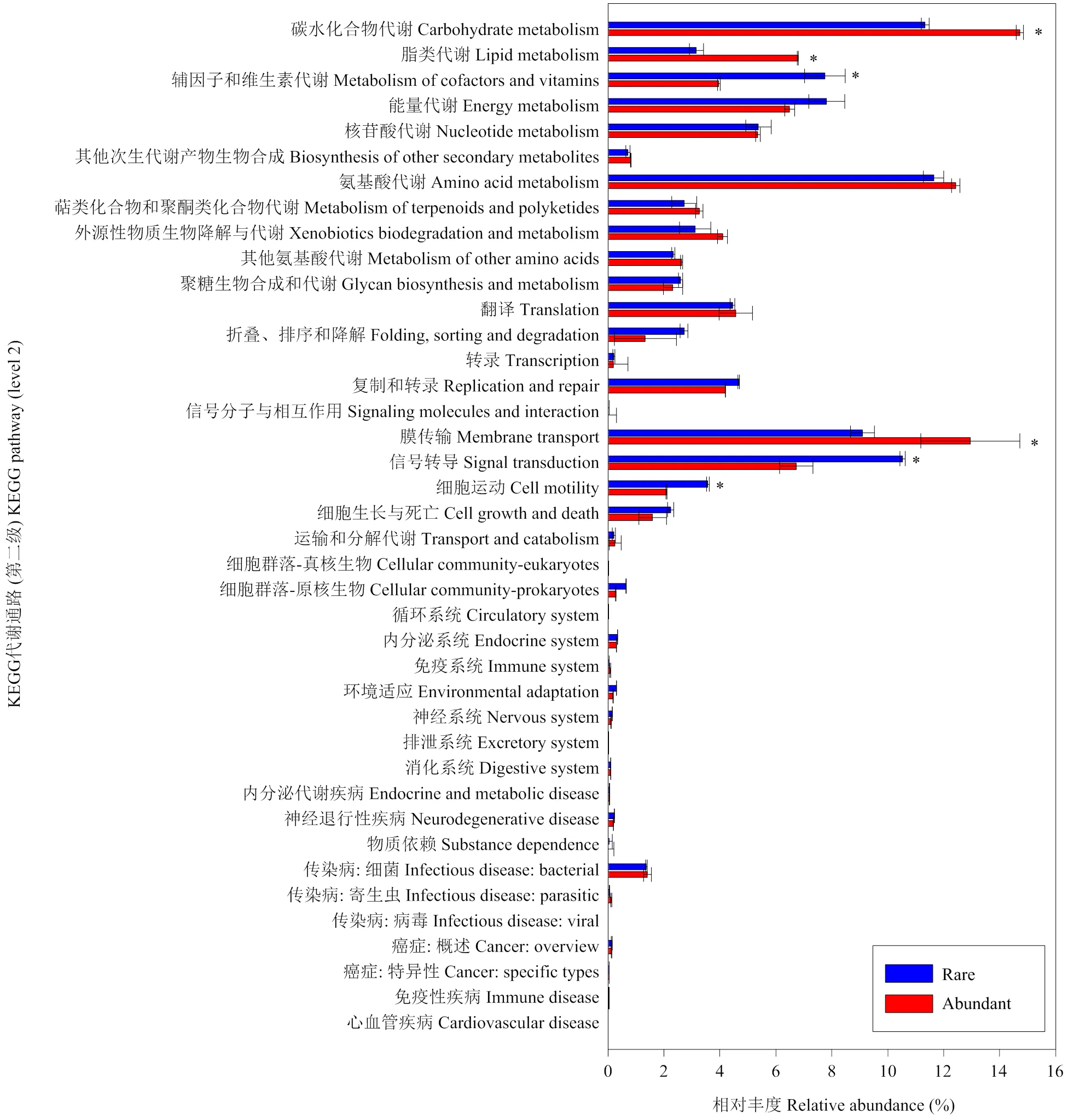
*:P<0.05
3 讨论
3.1 稀有和丰富细菌多样性和群落组成差异及其对潜在功能的影响
在多数生态系统中,土壤“丰富生物圈”有助于微生物生物量产生和有机质流动,而“稀有生物圈”则作为“种子库”提供巨大的遗传多样性和功能多样性储备,维持生态系统健康[12],因此,将稀有和丰富亚群落从整体群落中加以区分,并探索其分布特征及驱动因素有助于我们加深对微生物生态学的理解和研究,尤其对于长期以来处于认知盲区的稀有微生物[8,15]。本研究中,稀有细菌亚群落α和β多样性均显著高于丰富细菌亚群落(表3,图2),与以往研究一致[14,18-19,27],再次印证了稀有类群是微生物多样性的主要贡献者这一观点[28],一方面因为稀有类群的低丰度特性有助于其免于病毒裂解和捕食造成的物种损失[29],另一方面由于稀有微生物作为“种子库”拥有更高的新物种输入[30]。除了多样性,稀有细菌亚群落物种组成也与丰富细菌差异明显(图1),一方面体现在稀有细菌亚群落涵盖更多且独有(即门水平上只分布在稀有细菌亚群落的类群)的物种类群,另一方面体现在主要的细菌门在稀有和丰富亚群落之间相对丰度差异显著,例如变形菌门(稀有12.0% vs丰富20.6%)、拟杆菌门(稀有8.0% vs丰富1.0%)。物种的稀有性可能是随机过程、生命史策略的内在权衡以及生物与非生物相互作用的结果[31],例如本研究中仅分布在稀有细菌亚群落的脱硫杆菌门在先前研究也被鉴定为稀有细菌[18],最新研究显示该门中部分类群可利用底物十分有限[32],生存策略导致生态位狭窄,属于永久稀有类群;而另外一些类群既包含稀有细菌也包含丰富细菌,例如本研究中拟杆菌门,在以往研究中也有时被鉴定为稀有细菌[19,27],有时被鉴定为丰富细菌[8,18],这类微生物属于r-策略者,其相对丰度随周期或随机的环境变化(如温度、降水等)而波动,是有条件的稀有类群[15]。微生物功能的发挥高度依赖其多样性及群落组成,因此,稀有细菌亚群落功能也显著差别于丰富细菌(图6)。其中,与基础功能相关的养分和能量代谢(例如碳水化合物代谢)更多分布在丰富细菌亚群落,表明设施农业中丰富细菌可能负责主要的生态系统功能,而本研究发现丰富细菌亚群落更接近整体群落(图1、3)也从侧面证实了该推断。与之相比,稀有细菌亚群落更多体现在辅助功能上(例如辅酶代谢),从而为微生物群落功能冗余做出贡献,许多研究表明稀有细菌是保障土壤多功能性和提高微生物群落抵御环境扰动能力的关键[13,23],当环境条件发生变化时不适应环境的丰富细菌丰度下降,而更适应新环境的稀有细菌丰度升高,最终使生态系统结构和功能一直保持稳定健康状态。
3.2 长期施肥对稀有和丰富细菌分布模式的影响及关键环境因子
阐明长期施肥对设施土壤稀有和丰富微生物亚群落的影响可以为解析农业活动对微生物多样性与土壤功能稳定性之间的关系提供新视角,为降低集约施肥对陆地生态系统的影响提供科学依据。本研究表明,长期施肥并未显著改变丰富细菌亚群落多样性,仅群落组成受到影响,表现为富营养型细菌相对丰度随有机肥施用量增加显著提高,例如变形菌门和放线菌门[33],而寡营养型细菌则相反,例如酸杆菌门[33]。在自然陆地生态系统[19]和水体系统[9]中也发现丰富细菌亚群落对环境变化的敏感性较低,这可能是由于丰富细菌所占生态位更宽,能竞争利用更广泛的资源,从而在环境扰动中保证其优势地位[34]。与丰富细菌相比,稀有细菌低丰度和高多样性的特性使其在面临扰动时表现出更高的活性和周转[9],做出快速响应以适应新环境[21]。本研究中,与不施肥相比,长期施用有机肥和化肥显著提高稀有细菌α多样性(表3)和总相对丰度(图1),改变稀有细菌亚群落组成和结构(图1、3);并且,随着有机肥施用量增加,稀有细菌丰富度显著提升(表3),亚群落组成和结构也发生显著变化(图1、3)。最新研究也表明长期施用有机肥主要通过影响稀有微生物类群而非丰富类群增加土壤微生物多样性[23],与本研究结果一致。一方面,有机肥中含有丰富的氨基酸、蛋白质、维生素和无机盐等营养物质,施入土壤后为狭窄生态位和资源利用种类单一的稀有细菌提供了更多底物,显著提高了该类群稀有细菌相对丰度和多样性;另一方面,有机肥施用可以重塑根际土壤微生物群落[35],从而激活因生物相互作用(例如资源竞争能力弱)导致稀有的微生物。本研究显示长期施用有机肥显著增强了细菌生态网络的交互度和稳定性,特别是稀有细菌(图4),可能正是由于有机肥改善了化肥施用或番茄连作导致的土壤微生物群落结构失衡[36],例如激发土著有益菌,抑制病原菌增殖并降低其生存能力,为稀有细菌留下生存空间。有趣的是本研究还发现9年番茄平均产量与稀有细菌丰富度相关性(=0.77,=0.03)高于丰富细菌(=0.50,=0.05),与LIANG等[13]在玉米试验中观察到的规律一致,但都低于整体群落(=0.89,<0.001),然而前面提到稀有细菌主要负责辅酶、维生素代谢等辅助功能,丰富细菌才是养分、能量代谢等基础功能的主体参与者(图6),这说明对于经济作物,长期大量有机肥和化肥供应使得碳水化合物、氮磷等养分不再是产量的限制因子,反而是辅酶、维生素代谢等途径的增强可能对产量做出更大潜在贡献,并且稀有细菌辅助功能更大的价值可能体现在番茄品质的提升,但仍需要后续试验进行验证。同时也强调了稀有和丰富细菌之间复杂的相互作用和功能互补形成的健康区系是微生物生态功能发挥的保障。
本研究还发现,影响稀有和丰富细菌亚群落的关键环境因子也不相同(图3、5,表4),其中,多种与确定性过程相关的土壤因子(有机质、养分、pH、大中团聚体等)被证实显著影响设施土壤丰富细菌亚群落分布(图3),与先前在玉米[13]、茶园[7]、草地[19]和石油污染土壤[14]中得到的结果一致。这种确定性过程主导下,群落演替是定向且收敛的,即群落间相异性随着环境筛选逐渐降低[37],因此丰富细菌亚群落在不同处理间差异并不显著(图3)。相比之下,随机性过程强调物种间相对丰度的随机变化、不由环境决定其适应度(即生态漂移),其主导的群落构建缺乏收敛性,更为发散[18]。而本研究中稀有细菌亚群落受环境过滤的影响程度明显下降(图5,表4),且群落分散性更强(图3),暗示了两种亚群落构建机制可能存在差异。群落构建过程决定了微生物组成和多样性,进而影响其生态功能和服务[2,33],因此揭示微生物群落构建机制(或确定性过程和随机性过程的相对重要性)一直是生态学研究的中心议题,然而关于稀有和丰富细菌亚群落构建驱动因素的研究仍处于起步阶段,且结果不尽相同。多数研究表明土壤丰富细菌亚群落构建受确定性过程的支配作用更强[7,13-14,18],与本研究一致,而稀有细菌因高度多样化从而占据更多样化的生态位,因此受环境过滤/筛选强度明显低于丰富细菌亚群落,其分布更多受扩散限制等中性过程或更为复杂的生态过程与机制的影响[3]。
4 结论
与丰富细菌和整体群落相比,稀有细菌亚群落呈现更高的多样性和独特的群落组成,提高微生物群落功能冗余,其“种子库”和“功能池”作用对生态系统稳定至关重要。在设施土壤中,长期施肥主要通过影响稀有细菌(即提高多样性、改变群落组成、增加网络复杂度)而非丰富细菌从而改变细菌整体群落,并且介导稀有和丰富细菌亚群落构建的环境因子也不相同,其中,土壤有机质、全量氮磷、有效磷、速效钾、pH、大中团聚体等多种与确定性过程相关的土壤因子显著影响丰富细菌亚群落,而稀有细菌亚群落受环境过滤的影响程度明显下降,且群落分散性更强,暗示两种亚群落构建机制可能存在差异。
[1] FALKOWSKI P G, FENCHEL T, DELONG E F. The microbial engines that drive Earth’s biogeochemical cycles. Science, 2008, 320(5879): 1034-1039.
[2] JIA X, DINI-ANDREOTE F, FALCÃO SALLES J. Community assembly processes of the microbial rare biosphere. Trends in Microbiology, 2018, 26(9): 738-747.
[3] MO Y Y, ZHANG W J, YANG J, LIN Y S, YU Z, LIN S J. Biogeographic patterns of abundant and rare bacterioplankton in three subtropical bays resulting from selective and neutral processes. The ISME Journal, 2018, 12(9): 2198-2210.
[4] 王敬国. 设施菜田退化土壤修复与资源高效利用. 北京: 中国农业大学出版社, 2011.
WANG J G. Management of Degraded Vegetable Soils in Greenhouses. Beijing: China Agricultural University Press, 2011. (in Chinese)
[5] ZHANG X M, ZHANG Q, LIANG B, LI J L. Changes in the abundance and structure of bacterial communities in the greenhouse tomato cultivation system under long-term fertilization treatments. Applied Soil Ecology, 2017, 121: 82-89.
[6] TIAN T, CHEN Z Q, TIAN Y Q, GAO L H. Microbial diversity in solar greenhouse soils in Round-Bohai Bay-Region, China: the influence of cultivation year and environmental condition. Environmental Science and Pollution Research, 2017, 24(29): 23236-23249.
[7] XU Q C, LING N, QUAISER A, GUO J J, RUAN J Y, GUO S W, SHEN Q R, VANDENKOORNHUYSE P. Rare bacteria assembly in soils is mainly driven by deterministic processes. Microbial Ecology, 2022, 83(1): 137-150.
[8] ZHANG Y M, WU G, JIANG H C, YANG J, SHE W Y, KHAN I, LI W J. Abundant and rare microbial biospheres respond differently to environmental and spatial factors in Tibetan hot springs. Frontiers in Microbiology, 2018, 9: 2096.
[9] XUE Y Y, CHEN H H, YANG J R, LIU M, HUANG B Q, YANG J. Distinct patterns and processes of abundant and rare eukaryotic plankton communities following a reservoir cyanobacterial bloom. The ISME Journal, 2018, 12(9): 2263-2277.
[10] LIU L M, YANG J, YU Z, WILKINSON D M. The biogeography of abundant and rare bacterioplankton in the lakes and reservoirs of China. The ISME Journal, 2015, 9(9): 2068-2077.
[11] ZHANG Y, DONG S K, GAO Q Z, GANJURJAV H, WANG X X, GENG W. “Rare biosphere” plays important roles in regulating soil available nitrogen and plant biomass in alpine grassland ecosystems under climate changes. Agriculture, Ecosystems & Environment, 2019, 279: 187-193.
[12] JIANG Y L, SONG H F, LEI Y B, KORPELAINEN H, LI C Y. Distinct co-occurrence patterns and driving forces of rare and abundant bacterial subcommunities following a glacial retreat in the eastern Tibetan Plateau. Biology and Fertility of Soils, 2019, 55(4): 351-364.
[13] LIANG Y T, XIAO X, NUCCIO E E, YUAN M T, ZHANG N, XUE K, COHAN F M, ZHOU J Z, SUN B. Differentiation strategies of soil rare and abundant microbial taxa in response to changing climatic regimes. Environmental Microbiology, 2020, 22(4): 1327-1340.
[14] JIAO S, CHEN W M, WEI G H. Biogeography and ecological diversity patterns of rare and abundant bacteria in oil-contaminated soils. Molecular Ecology, 2017, 26(19): 5305-5317.
[15] LYNCH M D J, NEUFELD J D. Ecology and exploration of the rare biosphere. Nature Reviews Microbiology, 2015, 13(4): 217-229.
[16] YACHI S, LOREAU M. Biodiversity and ecosystem productivity in a fluctuating environment: the insurance hypothesis. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(4): 1463-1468.
[17] LEITÃO R P, ZUANON J, VILLÉGER S, WILLIAMS S E, BARALOTO C, FORTUNEL C, MENDONÇA F P, MOUILLOT D. Rare species contribute disproportionately to the functional structure of species assemblages. Proceedings Biological Sciences, 2016, 283(1828): 20160084.
[18] JIAO S, LUO Y T, LU M M, XIAO X, LIN Y B, CHEN W M, WEI G H. Distinct succession patterns of abundant and rare bacteria in temporal microcosms with pollutants. Environmental Pollution, 2017, 225: 497-505.
[19] PAN C C, FENG Q, LI Y L, LI Y Q, LIU L D, YU X Y, REN S L. Rare soil bacteria are more responsive in desertification restoration than abundant bacteria. Environmental Science and Pollution Research, 2022, 29(22): 33323-33334.
[20] 邢肖毅, 倪绯, 张亚丽, 黎颖惠, 杨贤均, 尹丹红. 增温对土壤丰富和稀有微生物的差异性影响. 环境科学与技术, 2022, 45(5): 70-76.
XING X Y, NI F, ZHANG Y L, LI Y H, YANG X J, YIN D H. Effects of warming on diversity of abundant and rare microbial communities in soil. Environmental Science & Technology, 2022, 45(5): 70-76. (in Chinese)
[21] LOGARES R, AUDIC S, BASS D, BITTNER L, BOUTTE C, CHRISTEN R, CLAVERIE J M, DECELLE J, DOLAN J R, DUNTHORN M, EDVARDSEN B, GOBET A, KOOISTRA W H C F, MAHÉ F, NOT F, OGATA H, PAWLOWSKI J, PERNICE M C, ROMAC S, SHALCHIAN-TABRIZI K, SIMON N, STOECK T, SANTINI S, SIANO R, WINCKER P, ZINGONE A, RICHARDS T A, DE VARGAS C, MASSANA R. Patterns of rare and abundant marine microbial eukaryotes. Current Biology: CB, 2014, 24(8): 813-821.
[22] GUO J H, LIU X J, ZHANG Y, SHEN J L, HAN W X, ZHANG W F, CHRISTIE P, GOULDING K W T, VITOUSEK P M, ZHANG F S. Significant acidification in major Chinese croplands. Science, 2010, 327(5968): 1008-1010.
[23] CHEN Q L, DING J, ZHU D, HU H W, DELGADO-BAQUERIZO M, MA Y B, HE J Z, ZHU Y G. Rare microbial taxa as the major drivers of ecosystem multifunctionality in long-term fertilized soils. Soil Biology and Biochemistry, 2020, 141: 107686.
[24] 姜灿烂, 何园球, 刘晓利, 陈平帮, 王艳玲, 李辉信. 长期施用有机肥对旱地红壤团聚体结构与稳定性的影响. 土壤学报, 2010, 47(4): 715-722.
JIANG C L, HE Y Q, LIU X L, CHEN P B, WANG Y L, LI H X. Effect of long-term application of organic manure on structure and stability of aggregate in upland red soil. Acta Pedologica Sinica, 2010, 47(4): 715-722. (in Chinese)
[25] 鲍士旦. 土壤农化分析. 3版. 北京: 中国农业出版社, 2000.
BAO S D. Soil and Agricultural Chemistry Analysis. 3rd ed. Beijing: China Agriculture Press, 2000. (in Chinese)
[26] CHAI Y X, JIANG S J, GUO W J, QIN M S, PAN J B, BAHADUR A, SHI G X, LUO J J, JIN Z C, LIU Y J, ZHANG Q, AN L Z, FENG H Y. The effect of slope aspect on the phylogenetic structure of arbuscular mycorrhizal fungal communities in an alpine ecosystem. Soil Biology and Biochemistry, 2018, 126: 103-113.
[27] ZHENG W, ZHAO Z Y, LV F L, WANG R Z, WANG Z H, ZHAO Z Y, LI Z Y, ZHAI B N. Assembly of abundant and rare bacterial and fungal sub-communities in different soil aggregate sizes in an apple orchard treated with cover crop and fertilizer. Soil Biology and Biochemistry, 2021, 156: 108222.
[28] ZHOU Q, ZHANG X M, HE R J, WANG S R, JIAO C C, HUANG R, HE X W, ZENG J, ZHAO D Y. The composition and assembly of bacterial communities across the rhizosphere and phyllosphere compartments of. Diversity, 2019, 11(6): 98.
[29] PEDRÓS-ALIÓ C. Marine microbial diversity: can it be determined? Trends in Microbiology, 2006, 14(6): 257-263.
[30] DINI-ANDREOTE F, STEGEN J C, VAN ELSAS J D, SALLES J F. Disentangling mechanisms that mediate the balance between stochastic and deterministic processes in microbial succession. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(11): E1326-E1332.
[31] 关健飞, 沈智超, 曹阳. 稀有微生物群落研究进展. 湖北农业科学, 2020, 59(15): 5-11.
GUAN J F, SHEN Z C, CAO Y. Research progress on rare microbial community. Hubei Agricultural Sciences, 2020, 59(15): 5-11. (in Chinese)
[32] MURPHY C L, BIGGERSTAFF J, EICHHORN A, EWING E, SHAHAN R, SORIANO D, STEWART S, VANMOL K, WALKER R, WALTERS P, ELSHAHED M S, YOUSSEF N H. Genomic characterization of three novel Desulfobacterota classes expand the metabolic and phylogenetic diversity of the Phylum. Environmental Microbiology, 2021, 23(8): 4326-4343.
[33] XUN W B, ZHAO J, XUE C, ZHANG G S, RAN W, WANG B R, SHEN Q R, ZHANG R F. Significant alteration of soil bacterial communities and organic carbon decomposition by different long-term fertilization management conditions of extremely low-productivity arable soil in South China. Environmental Microbiology, 2016, 18(6): 1907-1917.
[34] JIAO S, WANG J M, WEI G H, CHEN W M, LU Y H. Dominant role of abundant rather than rare bacterial taxa in maintaining agro-soil microbiomes under environmental disturbances. Chemosphere, 2019, 235: 248-259.
[35] TAO C Y, LI R, XIONG W, SHEN Z Z, LIU S S, WANG B B, RUAN Y Z, GEISEN S, SHEN Q R, KOWALCHUK G A. Bio-organic fertilizers stimulate indigenous soilpopulations to enhance plant disease suppression. Microbiome, 2020, 8(1): 137.
[36] WANG X F, WEI Z, YANG K M, WANG J N, JOUSSET A, XU Y C, SHEN Q R, FRIMAN V P. Phage combination therapies for bacterial wilt disease in tomato. Nature Biotechnology, 2019, 37(12): 1513-1520.
[37] ANDERSON K J. Temporal patterns in rates of community change during succession. The American Naturalist, 2007, 169(6): 780-793.
Effects of Long-Term Application of Organic Fertilizer on Rare and Abundant Bacterial Sub-Communities in Greenhouse Tomato Soil
LIU Lei, SHI JianShuo, ZHANG GuoYin, GAO Jing, LI Pin, REN Yanli, WANG LiYing
Institute of Agricultural Resources and Environment, Hebei Academy of Agriculture and Forestry Sciences/Hebei Fertilizer Technology Innovation Center, Shijiazhuang 050051
【Objective】The objective of the present study was to distinguish the rare and abundant bacteria from the whole community and to explore their responses to long-term application of organic fertilizer respectively, so as to provide new insights into the relationships between soil biodiversity and ecosystem functioning under major agricultural activities. 【Method】Based on the long-term fertilization experiment of greenhouse tomato, soils were collected under four different treatments, including no fertilizer (M0), low organic fertilizer 5.68 t·hm-2(M1), medium organic fertilizer 8.52 t·hm-2(M2), and high organic fertilizer 11.36 t·hm-2(M3). Illumina MiSeq platform was used to analyze the diversity, community composition, co-occurrence network and potential functions differences of the rare and abundant bacterial sub-communities, and their various responses to long-term fertilization, to illustrate the key factors driving the distinct distribution patterns and responses for rare and abundant bacteria. 【Result】Compared with the abundant bacterial sub-community, the rare bacterial sub-community showed higher α- and β-diversity and distinct community composition, as well as potential functions. A functional prediction detected that abundant bacteria contributed primary functions in the greenhouse ecosystem, such as nutrient and energy metabolism, meanwhile rare bacteria contribute a substantial fraction of auxiliary functions (e.g., metabolism of cofactors), which indicated they played important roles in the functional redundancy of microbial communities. Contrasting responses of rare and abundant bacterial sub-communities to long-term fertilization were revealed in this study, in which the rare bacteria was more sensitive. Compared with no fertilizer, the long-term application of organic and chemical fertilizer significantly increased the OTU richness, Shannon diversity, and total relative abundance by 19.8%-53.8%, 5.8%-8.0%, and 1.1-1.2 times, respectively, and changed the community composition and structure of rare bacterial sub-communities. In addition, with the increased application rates of organic fertilizer, the OTU richness of rare bacteria also increased significantly, accompanied by obvious changing in community composition and structure. However, the abundant bacteria exhibited less sensitivity to long-term fertilization, with only the community composition altered. Besides, the co-occurrence network complexity increased with organic fertilizer rates, especially in rare sub-communities. Both the results of the NMDS and mantel test revealed that the controlling factors affecting rare and abundant bacterial sub-communities were different. A variety of soil factors associated with deterministic processes, i.e., SOC, soil nutrients of total N and P, Olsen-P and available K, and pH, as well as macro- and medium-aggregate, significantly influenced abundant bacteria. Structural equation model (SEM) further showed that soil organic matter and total phosphorus directly drove abundant bacterial diversity. On the other hand, less effects of environmental filtering and more scattered distribution patterns were found in rare bacteria, indicating different assemblies of rare and abundant sub-communities. 【Conclusion】Compared with the abundant bacteria and the whole community, the rare bacteria sub-community showed higher diversity and unique community composition, which improved the functional redundancy of the microbial community. Long-term fertilization altered the whole bacterial community mainly by affecting rare bacteria (i.e., increasing diversity, changing community composition, increasing co-occurrence network complexity) rather than the abundant bacteria. The controlling factors that mediated the assembly of the rare and abundant bacterial sub-communities were also different.
rare bacteria; abundant bacteria; organic fertilizer; greenhouse tomato; diversity; community assembly; ecosystem function
10.3864/j.issn.0578-1752.2023.18.010
2022-10-09;
2023-03-20
河北省重点研发计划项目重大专项(21326904D)、河北省农林科学院科技创新专项(2022KJCXZX-ZHS-1)
刘蕾,E-mail:liuleihbnky@163.com,史建硕,E-mail:sjzjianshuo@126.com,刘蕾和史建硕为同等贡献作者。通信作者王丽英,E-mail:wangliying5@163.com
(责任编辑 李云霞)
