早期胃癌分化程度与临床特征的关系研究
2023-10-21刘博文殷云勤高宇辉
刘博文, 殷云勤, 高宇辉
(1.山西医科大学, 山西 太原 030001; 2. 山西医科大学第一医院 消化内科,山西 太原 030001)
根据2020 年全球癌症数据统计报告[1],全球胃癌新发病例超过100 万例,发病率全球排名第5,接近80 万人死亡,病死率全球排名第4;我国新发47.9 万例,居我国恶性肿瘤发病率第4 位,死亡37.4 万例,居我国恶性肿瘤死亡率第3 位。20 世纪60 年代,日本提出早期胃癌的概念,是指肿瘤局限于黏膜层与黏膜下层,无论是否伴有淋巴结转移,其最大的特点是比进展期胃癌预后更好。《中国早期胃癌筛查及内镜诊治共识意见(2014 年4 月·长沙)》[2]表明,进展期胃癌患者即使接受了外科手术等治疗,5 年生存率仍<30%;而早期胃癌大多可在内镜下达到治愈性切除,5 年生存率>90%。胃癌的早期诊治很大程度上可以延长患者的生存时间,是改善预后的重要因素。但早期胃癌患者通常无明显症状或症状无特异性。早期胃癌的发现非常依赖内镜筛查,随着内镜技术的发展,早期胃癌的检出率越来越高,但目前中国早期胃癌的诊治率与胃癌患者5 年生存率都远低于日本与韩国[2-3],这意味着我国仍需加强胃癌高危人群的筛查与早期诊治。
早期胃癌的治疗方式主要包括内镜下切除和外科手术。内镜下切除相比于外科手术,有创伤小、并发症少、费用低、住院时间短等优势,随着内镜诊断与治疗技术的发展,选择内镜下切除的早期胃癌越来越多。日本《胃癌处理规约》[4]将早期胃癌分为分化型癌与未分化型癌。内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)的绝对适应证为:①UL0 cT1a 分化型癌;②UL1 cT1a 分化型癌,直径≤ 3 cm;③UL0 cT1a 未分化型癌,直径≤ 2 cm[5]。可以看出,未分化型癌内镜切除的适应证相较于分化型癌极其有限。未分化型癌有着更高的淋巴结转移率[6],也代表着更差的预后。有研究比较未分化型癌与分化型癌的疗效发现,未分化型癌的短期与长期疗效均差于分化型癌[7]。因此,准确评估早期胃癌的分化程度对患者的后续治疗会产生很大影响。本文回顾性分析143 例早期胃癌患者的临床资料,探讨早期胃癌分化程度的影响因素,为临床制订合适的治疗方法提供参考。
1 资料与方法
1.1 一般资料
回顾性分析2018 年5 月1 日—2022 年12 月31 日就诊于山西医科大学第一医院行ESD 或外科手术后经病理诊断为早期胃癌的143 例患者的临床资料。纳入标准:①术前行胸片、胸腹部CT、腹部超声等检查,证实无远处转移;②病理资料完整;③如有多次ESD 或手术治疗史,只纳入首次治疗;④均为完整切除,无切缘阳性。排除标准:①转移性胃癌或特殊类型胃癌;②因其他疾病曾经接受过胃部分切除术;③术前3 个月内进行过放化疗;④合并有其他的原发性恶性肿瘤;⑤合并感染、其他部位炎症、自身免疫性疾病、血液系统疾病;⑥3 个月内有皮质类固醇药物治疗史和输血史。
根据《胃癌处理规约》[4]、《早期胃癌内镜黏膜下剥离和内镜黏膜切除术指南(第2 版)》[5]、《胃癌的日本分类:第3 版英文版》[8]、《胃癌诊疗指南(2022 年版)》[9],将143 例早期胃癌分为分化型组112 例和未分化型组31 例。
1.2 方法
收集两组患者的临床资料,包括年龄、性别、肿瘤位置、肿瘤大小、大体形态、色调变化、浸润深度、合并溃疡、脉管浸润、淋巴结转移、萎缩、吸烟史、饮酒史、身高、体重、体质量指数(body mass index, BMI)、中性粒细胞计数、淋巴细胞计数、血小板计数、中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio, NLR)、血小板计数与淋巴细胞比值(platelet to lymphocyte ratio, PLR)。分化型癌包括高分化或中分化管状腺癌、乳头状腺癌,未分化型癌包括低分化腺癌、印戒细胞癌、黏液腺癌;通过连接胃小弯和胃大弯三等分点的连线将肿瘤位置分为胃上部、胃中部、胃下部;肿瘤大小以肿瘤最大直径计算;大体形态分为Ⅰ型(隆起型)、Ⅱa 型(浅表隆起型)、Ⅱb 型(平坦型)、Ⅱc 型(浅表凹陷型)、Ⅲ型(凹陷型),本研究中Ⅱ型不再细分;溃疡为内镜下所观测,定义为至少UL-Ⅱ深度的黏膜缺损(比黏膜肌层更深),不包括浅表糜烂,在病变内发现溃疡或溃疡瘢痕为合并溃疡,无溃疡和溃疡瘢痕时为不合并溃疡;在内镜下观测肿瘤的色调变化,并与周围非癌黏膜相比较,分为发红与发白;脉管浸润、浸润深度、淋巴结转移等根据术后病理结果结合超声胃镜、CT 等检查确定。
1.3 统计学方法
数据分析采用SPSS 26.0 软件统计。计数资料以构成比或率(%)表示,比较采用χ2检验;计量资料以均数±标准差(±s)或中位数(四分位数)[M(P25,P75)]表示,比较采用t检验或秩和检验;影响因素的分析采用多因素一般Logistic 回归模型;绘制受试者工作特征(receiver operating characteristic,ROC)曲线。P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床资料的比较
分化型组与未分化型组患者的年龄、色调变化、浸润深度、合并溃疡、淋巴结转移、血小板计数和NLR 比较,差异均有统计学意义(P<0.05);两组的性别、身高、体重、BMI、吸烟史、饮酒史、肿瘤位置、肿瘤大小、大体形态、脉管浸润、萎缩、中性粒细胞计数、淋巴细胞计数和PLR 比较,差异均无统计学意义(P>0.05)。见表1。

表1 分化型组与未分化型组患者临床资料的比较
2.2 早期胃癌分化程度与临床特征的多因素一般Logistic回归分析
以分化程度为因变量,以年龄、色调变化、浸润深度、合并溃疡、淋巴结转移、血小板计数、NLR 为自变量,进行多因素一般Logistic 回归分析(α入=0.05),赋值见表2。结果显示:年龄大[O^R =0.928(95% CI:0.879,0.980)]是早期胃癌未分化的保护因素(P<0.05);肿瘤色调发白[O^R =10.747(95% CI:2.325,49.686)]、浸润深度深[O^R =7.259(95% CI:2.241,23.512)]、合并溃疡[O^R =4.463(95% CI:1.201,16.589)]、淋巴结转移[O^R =9.346(95% CI:2.144,40.732)]是未分化型早期胃癌的危险因素(P<0.05)。见表3。

表2 赋值表
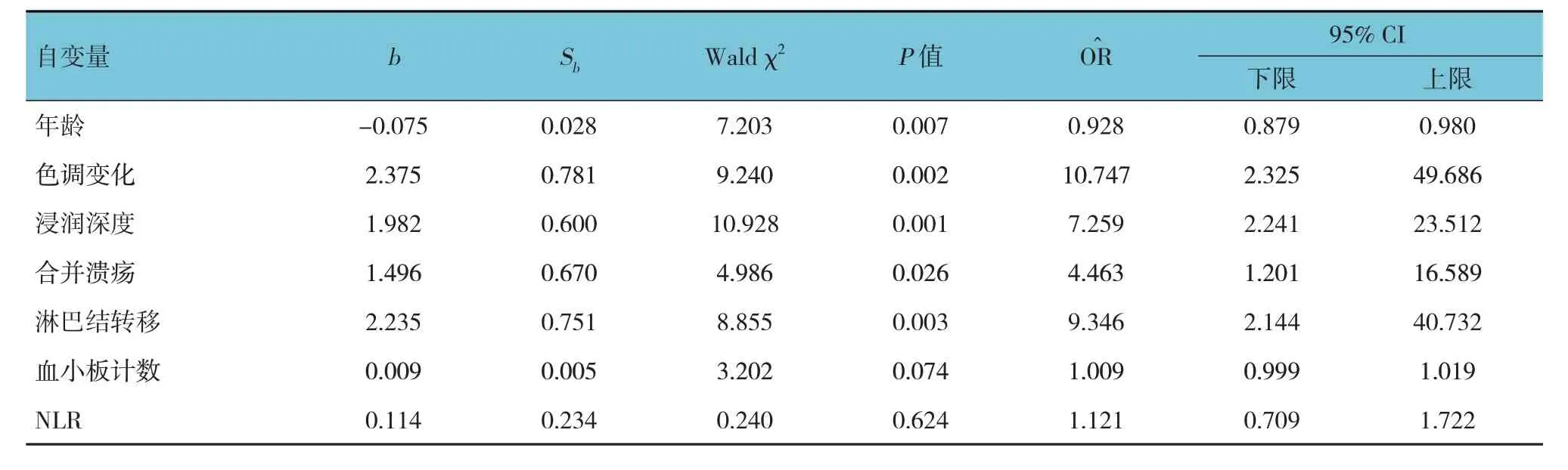
表3 多因素一般Logistic回归分析参数
2.3 相关因素对未分化型早期胃癌的预测效能
ROC 曲线分析结果显示,浸润深度为黏膜下层的曲线下面积(area under the curve, AUC)为0.674(95% CI: 0.566,0.781),敏感性为67.7%(95% CI: 0.486,0.833),特异性为67.0%(95% CI: 0.574,0.756);合并溃疡的AUC 为0.677(95% CI: 0.579,0.774),敏感性为87.1%(95% CI: 0.701,0.963),特异性为48.2%(95%CI: 0.387,0.579)。肿瘤浸润深度达黏膜下层、合并溃疡可作为未分化型早期胃癌发生的预测指标。年龄、色调变化、淋巴结转移无预测价值。见图1。

图1 相关因素预测未分化早期胃癌的ROC曲线
3 讨论
我国是胃癌的高发国家。胃癌已造成我国巨大的社会负担。随着高清晰度白光内镜(white light endoscopy, WLE)、色素内镜、窄带成像(narrowband imaging, NBI)和放大内镜(magnifying endoscopy, ME)的广泛应用,早期胃癌的检出率逐渐提高。早期胃癌的治疗方法关乎患者的预后。胃癌手术后出现的腹痛、腹泻、进食受限和疲劳等并发症严重影响患者的生活质量[10]。而ESD 作为一种微创治疗,不损害整体解剖结构,对患者的生活质量几乎没有影响。因此,在术前尽可能准确地确定早期胃癌的分化程度,为患者选择最合适的治疗方法很有必要。目前,评估分化程度的方式主要有术前活检及放大内镜联合窄带成像(magnifying endoscopy with narrowband imaging, ME-NBI),但准确性都并不高。有研究报道,内镜下钳夹活检标本与内镜下切除术后标本的组织学差异发生率为16.3%~53.7%[11]。造成差异的原因可能有以下几点:①胃中三分之一特殊的解剖位置导致取检困难,肿瘤病变较大、浸润深度较深、组织混合、病变易碎、存在溃疡等也可能成为影响活检结果准确性的因素;②取检样本数较少;③医师取检水平不足,难以取到靶点组织或取检深度不够[11-12]。ME-NBI 主要是通过对微结构和微血管的观察判断病变的分化程度,目前理论主要有八尾建史、八木一芳、小山恒男三大理论,对判断组织学分化程度有重要价值。这些理论各有侧重,但是在未分化型早期胃癌的应用中都有很大局限性。有研究[13]表明,ME-NBI 对早期胃癌组织分化程度判断的准确性与WLE 没有显著差异,这可能是因为未分化型早期胃癌通常存在于非肿瘤性上皮下,表面微血管与微腺管变化不典型,易被误诊为分化型早期胃癌。日本《早期胃癌内镜诊断指南》[14]指出,早期胃癌组织学类型的诊断应通过内镜所见和活检标本的组织学检查综合进行,但是该证据等级很低。因此,还需要更多的方式来确定早期胃癌的组织分化程度。
早期胃癌分化程度与其他相关临床特征的研究较少,本研究结果发现,早期胃癌的分化程度与年龄、色调变化、浸润深度、合并溃疡、淋巴结转移有关,ROC 曲线分析结果提示肿瘤浸润深度达黏膜下层、合并溃疡可作为未分化型早期胃癌的预测指标。
根据最新的流行病学调查,胃癌主要发生在60~80 岁老年人[15]。但在过去几十年间,许多国家年轻人群胃癌发病率逐渐升高[16-17],但具体原因尚不清楚。既往有多项研究表明年龄与胃癌组织学分化程度相关。一项来自日本的多中心前瞻性研究纳入了343 例早期胃癌患者,其中分化型组平均年龄71 岁,未分化型组平均年龄67 岁,分析得出年龄是分化型早期胃癌的独立危险因素[18]。韩国一项近10 年的回顾性研究共纳入1 641 例早期胃癌患者,分化型组平均年龄(64.27±9.49)岁,未分化型组平均年龄(61.19±10.59)岁,分析得出年龄<65 岁[=1.75(95% CI:1.10,2.80)]是未分化型早期胃癌的预测因素[19]。RYU 等[20]研究发现年龄<55 岁是未分化型早期胃癌的预测因素。这些研究与本研究的结论相似。众所周知,萎缩性胃炎的发展与胃癌的发生密切相关[21]。1975 年,CORREA 等[22]提出分化型胃癌的发生模式,在胃黏膜萎缩的基础上,肠化、异型增生、癌症逐步发生,但这个过程是极其缓慢的。而在未分化型癌中不存在这个过程,其发生可能主要是基于其他遗传学病因[23]。这可能是未分化型胃癌进展更迅速、发病年轻化的原因。
黏膜的颜色变化对于判断早期胃癌的分化程度也很重要。黏膜表面颜色变化取决于黏膜血管分布的差异,分化型癌常伴有肿瘤间质组织内血管增生而表现为表面发红,而未分化型癌的癌细胞分散浸润并破坏正常黏膜血管结构,无间质组织增生,表现为表面发白,这可能与两种肿瘤细胞释放的血管生成因子数量相关。此外,表面溃疡和活动性炎症等因素也可能影响胃黏膜的血管分布[24]。已有研究表明,分化型癌与周围非癌黏膜颜色相比,通常较为发红,而未分化型癌相比周围非癌黏膜通常发白[19,24],这与本研究结论一致。
KANESAKA 等[18]研究发现浸润深度是分化型早期胃癌的独立预测因素,这与本研究结果一致。未分化型癌表现出与分化型癌不同的生物学行为,浸润性生长和淋巴结转移的概率更高[6]。分化型癌通常会沿着基底膜的方向生长,利用腺管原有的框架进行置换性增殖,表现为扩张性生长,早期对基底膜很少有破坏,穿透性较低,出现黏膜下层浸润也较晚;未分化癌的增殖带出现在黏膜中层,在发生的最初始阶段就与腺管本身的构造无关,癌细胞会很容易突破基底膜,浸润到间质,表现为浸润性生长,穿透性高,易向黏膜下层浸润[25-26]。
本研究发现合并溃疡是未分化型早期胃癌的独立危险因素,既往也有类似报道和本研究结论相同。一项韩国的大型回顾性研究发现内镜下发现合并溃疡组的未分化型癌比率(51.2%)显著高于无溃疡组(43.3%)[27]。由于未分化型癌的生长模式多为浸润性,大部分未分化型癌都是按照溃疡浸润型胃癌这个方向发展的。曾有日本学者提出恶性循环的概念来解释早期胃癌的自然病程,在早期胃癌的发展过程中,癌细胞可能通过胃酸和胃蛋白酶的作用从黏膜表面清除从而形成溃疡[28]。分化型癌的发生通常在萎缩型胃炎的黏膜背景之下,由此推测萎缩性胃炎造成的胃酸缺乏、胃蛋白酶原活性下降可能是分化型癌不易合并溃疡的原因。但目前大多数研究结果都显示溃疡与早期胃癌组织学分化程度无相关性,这可能是由于不同内镜医师在溃疡的判断上存在差异,尤其是溃疡瘢痕;同时有研究发现,未分化型癌在瘢痕期最常见,在活动期并不常见,这也可能是造成上述结果的原因之一[27];另外,难以区分溃疡与活组织检查造成的破坏或纤维化,也可能是原因之一[29]。
淋巴结转移是内镜下治疗早期胃癌的最大制约因素,代表着更差的预后。有研究表明相比于无淋巴结转移的早期胃癌(0.6%~0.7%),有淋巴结转移的早期胃癌复发率更高(7%~20%)[30]。既往已有研究发现组织分化程度是未分化型早期胃癌的危险因素[31-33]。这可能因为未分化型癌较分化型癌异质性更明显,生长方式也更具有浸润性,更容易引起深部浸润和侵犯血管、淋巴管,从而通过脉管系统发生转移。因此,即使病变符合内镜治疗的标准,在未分化型早期胃癌的治疗中仍不能忽视淋巴结转移的风险。
NLR、PLR 是两个简便易得的血清学指标。既往有研究表明NLR、PLR 是包括胃癌在内全身各种实体肿瘤的不良预后因素[34]。也有报道NLR 和PLR升高与肿瘤淋巴结转移和分期相关,在胃癌的早期诊断中优于CEA 和CA19-9 等常规肿瘤标志物[35]。但NLR、PLR 与早期胃癌组织分化程度相关的研究很少。全身炎症反应已被证明与多种类型的肿瘤有关,包括胃癌[36]。炎症反应是肿瘤微环境的重要组成因素[37]。已有研究表明,当肿瘤发生时,肿瘤微环境会募集血循环中的中性粒细胞,中性粒细胞可以通过产生各种细胞因子促进肿瘤增殖、侵袭和血管生成,抑制免疫系统启动的抗肿瘤反应,特别是在癌症早期,免疫系统应答和监测依赖于循环中的淋巴细胞的时候[35,38-39]。血小板也参与了肿瘤的进展,肿瘤可诱导血小板活化和凝集,通过促进血管生成和转化等关键过程促进肿瘤进展;除此以外,血小板也是炎症的调节因子,其可以通过激活血管内皮细胞,将白细胞招募到肿瘤发生部位[40]。总的来说,NLR、PLR 反映了肿瘤微环境中炎症反应与免疫反应的平衡,未分化癌恶性程度更高,淋巴结转移率更高,所以推测未分化癌的炎症反应较强而免疫反应较弱。本研究结果显示,单因素分析示NLR 与早期胃癌分化程度有关,但多因素分析中NLR 被排除,推测可能与样本含量较低和混杂因素多等有关。尽管本研究排除了大多数可能影响这些血清学指标的疾病与行为,但在回顾性收集病例资料的过程中仍可能存在未知的混杂因素,从而造成影响。
本研究的创新性在于探究了NLR 与PLR 与早期胃癌分化程度的关系,虽然在研究过程中两者均被排除,但NLR 在单因素分析中显示差异有统计学意义,仍具有一定参考价值,当然这需要更多大样本试验来证实。但是,本研究是一项单中心回顾性研究,可能存在信息收集偏倚和其他偏倚,而且所纳入的样本量较少,还需要进行更多大型、前瞻性、多中心研究来验证本研究结果;有文献表明性别、肿瘤大小、大体形态也是肿瘤分化程度的影响因素[18-20],但本研究结果显示,分化型与未分化型两组这些因素的差别无统计学意义,可能是样本量太小的原因。
综上所述,早期胃癌的分化程度主要与年龄、色调变化、浸润深度、合并溃疡、淋巴结转移有关,肿瘤浸润深度达黏膜下层、合并溃疡可作为未分化型早期胃癌发生的预测指标。未来的临床工作应高度重视上述影响因素,对早期胃癌分化程度作出准确判断,为患者提供个性化的治疗方法。
