卵巢未成熟畸胎瘤后生长性畸胎瘤综合征一例并文献复习
2023-10-20万桃俞萍源杨永秀
万桃,俞萍源,杨永秀
生长性畸胎瘤综合征(growing teratoma syndrome,GTS)于1982 年由Logothetis 等首次提出,用于描述未成熟畸胎瘤(immature teratoma,IMT)或混合性生殖细胞肿瘤术后给予适当的辅助化疗,肿瘤标志物恢复正常后,体内发现成熟畸胎瘤的现象[1]。GTS 诊断时的中位年龄为15.5~22.0 岁,肿块位置常见于腹膜后、睾丸和卵巢,但在肺、纵隔、淋巴结、肠系膜、网膜、肝脏、膀胱、骶骨和松果体中也有描述[2]。卵巢GTS 发病率低,缺乏大样本研究,发病机制尚不明确,对其自然病程和治疗管理报道较少。现报告兰州大学第一医院(我院)1 例IMT 患者综合治疗后随访期间发生GTS 的病例。
1 病例报告
患者 女,34 岁,孕2 产1。主因卵巢IMT 术后7 年,发现盆腔肿物4 个月余,于2023 年4 月24 日收住我院治疗。患者自诉于2016 年8 月9 日因左侧卵巢IMT 于外院行左侧附件切除术+大网膜活检术。术前甲胎蛋白(alpha fetoprotein,AFP)5.91 U/mL(0~5.80 U/mL)。术后病理结果:瘤组织由分化成熟的皮肤及其附件组成,其间可见较多神经胶质细胞及不典型神经管组织,中胚层不成熟骨、软骨组织,内胚层肠组织,部分呈乳头状瘤生长,伴有坏死,网膜未见瘤组织。免疫组织化学结果:神经元特异性烯醇化酶(NSE,++),S100(++),突触小泡蛋白(Syn,++),神经胶质细胞原纤维酸性蛋白(GFAP,++),Ki-67(约3%+)。诊断为:左侧卵巢未成熟畸胎瘤ⅠC1 期(Ⅰ级,低级别)。术后行顺铂+依托泊苷静脉化疗4 个周期。术后定期复查,前两年每4 个月一次,后每年一次。2022 年12 月10 日患者在武威市人民医院复查超声示:右侧附件区见一大小约32 mm×22 mm 无回声区,可见多个分隔和高回声区。未予处理。2023 年4 月20 日在武威市凉州医院复查超声示:右侧附件区可见大小约78 mm×41 mm 的混合回声,壁厚,形态规则,可见数个分隔。患者无腹痛、腹胀等不适,为进一步治疗就诊于我院。
入院后查体:外阴发育正常,已婚已产型,阴道畅,黏膜光滑,宫颈肥大,可见数枚宫颈腺囊肿,子宫前位偏左,正常大小,右侧附件区可触及一大小约5 cm×4 cm 的囊性肿物,表面规则,活动度欠佳,与周围组织界限尚清,无触痛及压痛,左侧附件区触诊不满意。盆腔磁共振成像(magnetic resonance imaging,MRI)示:右侧附件区可见囊实性长T1 长T2 混杂信号影,中心部位呈混杂短T1 短T2 信号影,最大截面积约75 mm×57 mm,可见分隔,边界尚清,左侧附件缺如,见图1。腹部CT 示:右侧附件区见大小约73.6 mm×58.3 mm混杂密度肿块,可见软组织、液体及脂肪密度影,其内可见点状钙化灶,边界清,增强实性成分可见持续强化,见图2。外周静脉血糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)269 U/mL(0~34 U/mL);AFP 为2.06 U/mL(0~5.80 U/mL),其余肿瘤标志物正常。排除手术禁忌证后患者于2023 年4 月27 日在气管插管全身麻醉下行腹腔镜探查术,术中见右侧输卵管与右侧卵巢粘连,右侧卵巢可见大小约7 cm×5 cm 的占位,活动度尚可,左侧输卵管、卵巢缺如,余未见明显异常,见图3。完整剥离右侧卵巢肿物,肉眼观:切面可见灰红间淡黄色囊性组织,囊内可见油脂牙齿及毛发,部分区域为实性。术中冰冻:形态学支持畸胎瘤。家属坚持保留右侧卵巢,术毕。术后病理结果:纤维囊壁,瘤组织由分化成熟的鳞状上皮、皮脂腺、毛囊等成熟皮肤组织及其附属组织构成,另见部分脑组织、小脑组织、支气管、软骨和骨组织等;符合成熟囊性畸胎瘤,见图4。术后患者恢复好,肿瘤标志物正常,现随访中。

图1 盆腔MRI 横断面图
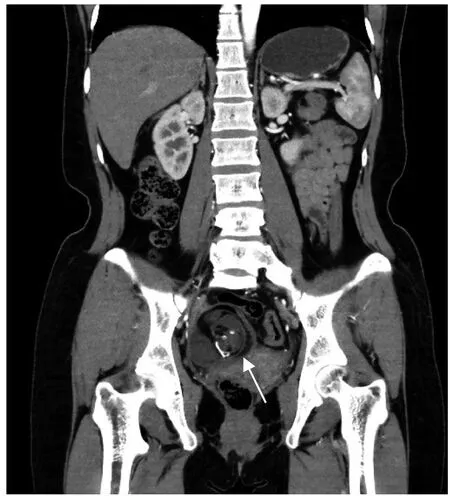
图2 全腹CT 冠状面图

图3 腹腔镜探查术术中图

图4 右侧卵巢成熟畸胎瘤病理图
2 讨论
2.1 发病机制卵巢IMT 由3 个胚层(外胚层、中胚层、内胚层)组成,含不等量的未成熟组织(原始或胚胎神经外胚层组织),AFP 水平通常显著升高[3-4]。目前GTS 的病因仍不确定,主要有以下假说。①肿瘤竞争性抑制和休眠假说,未成熟和成熟畸胎瘤细胞共存于原发性恶性卵巢畸胎瘤及其转移灶中,由于恶性细胞的攻击行为,良性细胞停止生长,而化疗选择性杀死未成熟畸胎瘤细胞,成熟畸胎瘤细胞被抑制到隐匿状态,而GTS 是对化疗存在抵抗力的成熟畸胎瘤细胞发生增殖的结果[5]。②化疗刺激细胞动力学改变,将全能恶性生殖细胞转化为成熟畸胎瘤[1,6]。③化疗延长了患者的总生存期,允许“自发进化”的发生,使恶性细胞自发地分化为良性细胞。④原发肿瘤的良性转移灶未被早期发现[7],其中转移灶通过淋巴管、血管或腹膜播散,而肿块的生长是由细胞因子和生长因子调节的结果[2]。此外,Tullius 等[8]首次报道了1 例PTEN 基因突变的2 岁GTS 患者,其发病或与该基因突变有关。
2.2 诊断及鉴别诊断据报道,卵巢IMT 患者中GTS 的发生率为12%~22%,二者诊断的中位间隔时间为7 个月[9]。Logothetis 等1982 年最初定义GTS:化疗期间或化疗之后观察到肿块增大或出现新的肿块;先前升高的肿瘤标志物(AFP、人绒毛膜促性腺激素、乳酸脱氢酶)恢复正常;病理学检查仅存在成熟畸胎瘤成分[10]。近年研究发现,GTS 肿块不一定增大,可以是IMT 化疗后的稳定状态,而AFP 水平在治疗后逐步下降,可高于正常[4,11]。因此,GTS 的诊断应更为灵活,其中成熟畸胎瘤组织是必要条件。本例患者在卵巢IMT 术后随访期间发现新肿块,除CA19-9 升高外,其余肿瘤标志物正常,结合术后病理符合成熟囊性畸胎瘤,最终诊断为GTS。
GTS 需要与卵巢IMT 复发和腹膜神经胶质瘤病(gliomatosis peritonei,GP)相鉴别。①卵巢IMT 复发:盆腹腔肿块是二者的共性,机械性压迫可导致疼痛、肠梗阻、肠穿孔、肾衰竭和组织坏死等[12]。由于GTS中存在比IMT 更多的脂肪和钙化,因此CT/MRI 检查中,病变表现为局限性、壁光滑、密度增加的肿块伴钙化和(或)囊性成分,通常不会侵犯周围结构[2]。因此,肿块与原发肿瘤相比,脂肪成分的多少及肿瘤标志物是否升高有助于鉴别GTS 和IMT 复发[4,9]。②GP:二者均为良性疾病,且具有转移性生长潜力[13]。GP 在遗传学上与畸胎瘤无关,是多能腹膜干细胞在畸胎瘤分泌的物质的影响下分化成成熟的神经胶质细胞,通过神经胶质组织沿血管淋巴系统播散而来,分布较广,且仅由成熟神经胶质组织组成;而GTS至少包含三种胚层中的一种[14]。此外,GP 可在未行化疗的情况下出现,而GTS 是全身治疗的结果[12]。
发生GTS 的危险因素有原发肿瘤切除不完全、原发肿瘤中存在成熟畸胎瘤成分、组织学分级为2级和3 级、临床分期Ⅲ期和Ⅳ期、肿瘤对辅助化疗不敏感[7]。此外,初始手术时腹膜受累和神经-外胚层肿瘤是GTS 发生的独立危险因素[9]。本例患者原发肿瘤中存在成熟畸胎瘤成分是此次GTS 发生的危险因素。
2.3 治疗及预后目前尚无针对GTS 的标准治疗方案,GTS 对放化疗均不敏感,因此早期手术切除是治疗的首选方式,其他治疗包括免疫调节剂、化疗药物和经皮射频消融术。据报道,GTS 不完全切除的复发率为13%~83%,完全切除的复发率为0~4%[2]。在某些情况下,应行根治性手术和多器官切除术(如肠、腹膜、膈肌、脾、胰腺及肝切除术等),实现肿瘤细胞减灭术[7]。虽然手术治疗是GTS 治疗的基础,但重组人干扰素α-2b、贝伐珠单抗、全反式维甲酸、周期蛋白依赖性激酶4/6(cyclin dependent kinase 4/6,CDK4/6)抑制剂[哌柏西利(Palbociclib)]和PD0332991等免疫调节剂已被证明是阻止GTS 进展的有效药物,为无法完全切除的卵巢GTS 提供了新的治疗策略[2,15-16]。此外,GTS 对化疗不敏感,但博来霉素、依托泊苷和顺铂的辅助化疗可以预防GTS 复发[2,15]。因本例患者自身意愿及肿块已完全切除复发率较低而未行辅助化疗,术后需密切随访。
GTS 通常发生在育龄期女性,其生育能力的保留值得关注。Bentivegna 等[17]的报告中53%(20/38)的患者行保留生育术,其中4 例患者自然妊娠,1 例患者经辅助生殖技术妊娠。Wang 等[9]研究中77%(27/35)的患者行保留生育手术,其中4 例患者5 次成功妊娠,且与根治性手术复发患者(4/8)相比行保留生育手术患者(7/27)的复发风险未增加(P=0.198)。因此,对于年轻有生育要求的患者,可保留生育功能后转诊至生殖内分泌专家进行咨询评估。本例患者为育龄期女性,因此行保留生育能力手术,以期成功妊娠。
据报道,3%~5%的GTS 患者术后转化为非精原细胞瘤(nonseminomatous germ cell tumor,NSGCT)、肉瘤、鳞状细胞癌、腺癌、类癌或原始神经外胚层肿瘤等恶性肿瘤[13]。虽然没有关于GTS 术后监测的共识指南,但术后0.5~1 年应至少每3 个月随访一次,包括自觉症状、体格检查、影像学检查和肿瘤标志物。若术后6~12 个月没有新发肿块或残留肿块生长迹象,则每6 个月复查一次。若病变生长且有症状的情况下,则应考虑再次手术。即使肿块较小、病情稳定,也应继续随访,以防数年后开始生长[12]。行完全性手术切除的GTS 患者预后良好,5 年生存率为89%~90%[9]。
综上所述,GTS 诊断并不困难,但需与IMT 复发及GP 鉴别。首选治疗方式为完全性手术切除,以减少术后复发,对于无法完全切除的GTS 患者,免疫调节剂可阻止GTS 进展。此外,虽然GTS 对化疗不敏感,但可预防复发。GTS 预后良好,建议育龄期女性行保留生育能力的手术,定期随访对监测病变恶化至关重要。GTS 临床罕见,临床医生对其病因和临床行为了解甚少,未来有必要进行多中心研究,以期在分子病理、手术和治疗方面有所突破。
