钆塞酸二钠增强MRI功能性影像评分评估慢性肝病患者肝功能的临床价值
2023-10-20于澜俞灿王欣欣黄涛
于澜,俞灿,王欣欣,黄涛
慢性肝炎、肝硬化及其他慢性肝脏疾病常伴随着肝脏功能的异常,随着疾病的演变最终可进展为肝细胞癌或肝衰竭,已成为肝脏相关死亡的主要原因,对全球健康造成了严重负担[1,2]。对于慢性肝脏疾病的治疗,精准评估肝功能具有重要的临床意义,可确定患者个体化治疗策略并且预测肝部分切除或失代偿期肝硬化患者预后,进而降低患者死亡率。钆塞酸二钠(gadolinium-ethoxybenzyl-diethylenetriamine pentaacetic acid,Gd-EOB-DTPA)作为一种肝细胞特异性磁共振对比剂可在检测肝脏弥漫或局灶性病变的同时评估全肝或肝段的肝功能[3,4],拓展了其临床应用价值。Bastati等[5]基于Gd-EOB-DTPA增强MRI肝胆期肝实质增强、胆道对比剂排泄以及门静脉征象研发了一种评估肝功能的简单方式,即功能性肝脏影像评分(functional liver imaging score,FLIS)。
目前,研究证实FLIS与Child-Pugh评分之间具有明显相关性[6,7]。然而,Child-Pugh评分包含主观因素,如腹水、肝性脑病,其评估准确性有待进一步提高。因此,需要进一步的研究来探索FLIS与其他临床肝功能评估方式之间的相关性。白蛋白-胆红素(albumin-bilirubin,ALBI)分级作为一种临床常用评估方式,仅由总胆红素和白蛋白进行计算,更为简单、客观,鲜有应用其和FLIS共同评估肝功能的研究。先前已有研究证实Gd-EOB-DTPA增强MRI评估肝功能的多种参数,但其均需额外的测量及计算使其临床应用复杂化,因而选取两项基于信号强度(signal intensity,SI)测量的经典参数,即肝-脾信号强度比(liver-to-spleen ratio,LSR)及肝-门静脉信号强度比(liver-to-portal vein ratio,LPR),将其肝功能评估能力与FLIS进行比较,以便于临床工作中选择最佳评估方案。本研究通过比较不同ALBI分级患者Gd-EOB-DTPA增强MRI肝胆期FLIS的差异,分析肝功能对FLIS结果的影响,在此基础上进一步分析FLIS与LSR及LPR鉴别ALBI分级系统相邻级别的诊断性能,探讨FLIS对于评估慢性肝脏疾病患者肝功能的临床价值。
材料与方法
1.临床资料
本研究为回顾性研究,经医院医学伦理委员会审核并通过。搜集从2020年6月至2022年5月在本院行Gd-EOB-DTPA增强MRI检查的患者相关资料。纳入标准:慢性肝炎和肝硬化患者;MRI检查前后10 d内进行肝功能实验室检查。排除标准:①图像伪影严重影响观察者;②门静脉栓塞或胆道梗阻;③肝脏巨块型病变;④肝脏、脾脏切除病史。58例慢性肝炎及肝硬化患者纳入研究,男38例,女20例,年龄30~72岁,平均(55±10)岁。其中,慢性肝炎患者7例,肝硬化患者51例。肝硬化诊断按照《肝硬化诊治指南》的诊断标准[8]。据患者实验室检查结果计算ALBI评分,其计算公式为ALBI=(-0.085×ALBg/L)+(0.66×log10TBiL μmol/L)。ALBI评分可分为3级:1级≤-2.60;-2.60<2级≤-1.39;3级>-1.39。本研究中ALBI 1、2、3级分别为30、25、3例。
2.检查方法
使用Philips Ingenia 3.0T磁共振扫描仪进行MR扫描。患者在检查前保持空腹状态,并进行呼吸训练。取仰卧位,扫描范围从膈顶至肝脏下缘。增强扫描对比剂为Gd-EOB-DTPA(德国拜耳医药保健有限公司),采用高压注射器经肘前静脉以1.0 mL/s的流率注射0.025 mmol/kg,随后以相同流率注射20 mL生理盐水冲洗导管。采用m-DIXON序列行平扫及增强扫描,分别于注射对比剂后17 s、60~80 s、90 s行动脉期、门静脉期和过渡期扫描,于注射对比剂后20 min行肝胆期扫描。磁共振扫描仪参数:层厚2.5 mm,TR 3.7 ms,TE 1.32 ms,FOV 390 mm×299 mm,反转角 15°。
3.图像分析
由两名具有腹部MRI图像诊断经验的放射科医师在对患者的临床信息不知情的前提下进行图像的分析与处理。两名放射科医师之间的分歧以协商一致的方式进行解决。据FLIS标准(表1),两名医师对肝胆期图像的肝实质增强、胆道对比剂排泄及门静脉征象3个征象进行评分。每个征象的得分为0、1或2分,FLIS为上述3个征象得分之和(图1~4)。由1名放射科医师在工作站横断面肝胆期图像上行肝脏、脾脏及门静脉SI的测量。分别在肝脏左外叶、左内叶、右前叶、右后叶画取1个感兴趣区(region of interest,ROI),在脾脏画取3个ROI,ROI大小约100~200 mm2,画取时注意避开局灶性病变、血管、胆管以及成像伪影。在门静脉主干及左、右支的中心位置分别画取1个ROI,ROI大小约10~40mm2(图5)。取测量值的平均值分别作为肝脏SI(SI肝脏)、脾脏SI(SI脾脏)及门静脉SI(SI门静脉),并计算LSR和LPR。LSR计算公式:LSR=SI肝脏/SI脾脏;LPR计算公式:LPR=SI肝脏/SI门静脉。
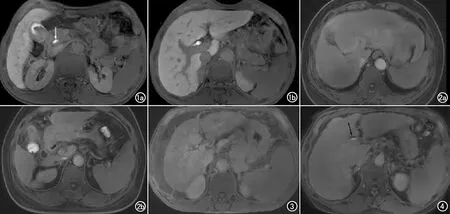
图1 69岁,男,ALBI 1级肝硬化患者。a)显示肝实质相对于肾实质呈高信号,评分为2,胆道对比剂排泄至胆总管(箭),评分为2;b)显示门静脉相对于肝实质呈低信号,评分为2。FLIS总分为6分。 图2 60岁,女,ALBI 3级肝硬化患者。a)显示门静脉与肝实质信号强度相等,评分为1,胆道系统无对比剂,评分为0;b)显示肝实质与肾实质信号强度相等,评分为1。FLIS总分为2分。 图3 58岁,男,ALBI 3级肝硬化患者。肝实质相对于肾实质呈低信号,评分为0,门静脉相对于肝实质呈高信号,评分为0。 图4 51岁,男,ALBI 2级肝硬化患者。胆道对比剂排泄至肝内胆管(箭),评分为1。

图5 肝脏、门静脉及脾脏放置ROI示意图。a) 肝脏左外叶、左内叶、右前叶、右后叶前置ROI; b) 门静脉主干放置ROI; c) 门静脉右支放置ROI; d) 门静脉左支放置ROI;e) 脾脏放置ROI。

表1 FLIS影像征象含义及评分标准
4.统计学方法

结 果
1.FLIS与ALBI分级系统和实验室相关生化指标的相关性
58例患者中对FLIS及其3个征象与ALBI分级系统进行了相关性分析(表2)。FLIS、肝实质增强及门静脉征象都与ALBI分级系统呈强相关性,其中以FLIS相关性最强。胆道对比剂排泄仅呈中度相关。FLIS与实验室相关生化指标的分析结果显示FLIS与白蛋白、总胆红素及球蛋白分别呈高度正相关(r=0.78,P<0.001)、中度负相关(r=-0.52,P<0.001)及中度负相关(r=-0.45,P<0.001)。
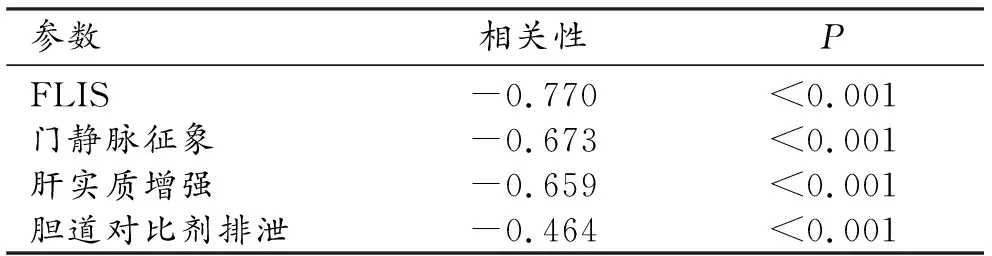
表2 FLIS及其3个征象与ALBI分级系统的相关性
2.LSR和LPR与ALBI分级系统的相关性
图6总结了行信号强度测量的51例患者LSR和LPR与ALBI分级系统之间的相关性。结果表明ALBI分级系统不同组别之间LSR值和LPR值差异有统计学意义(P<0.05)。随着肝功能损害严重程度的进展,肝胆期LSR值和LPR值逐渐降低。
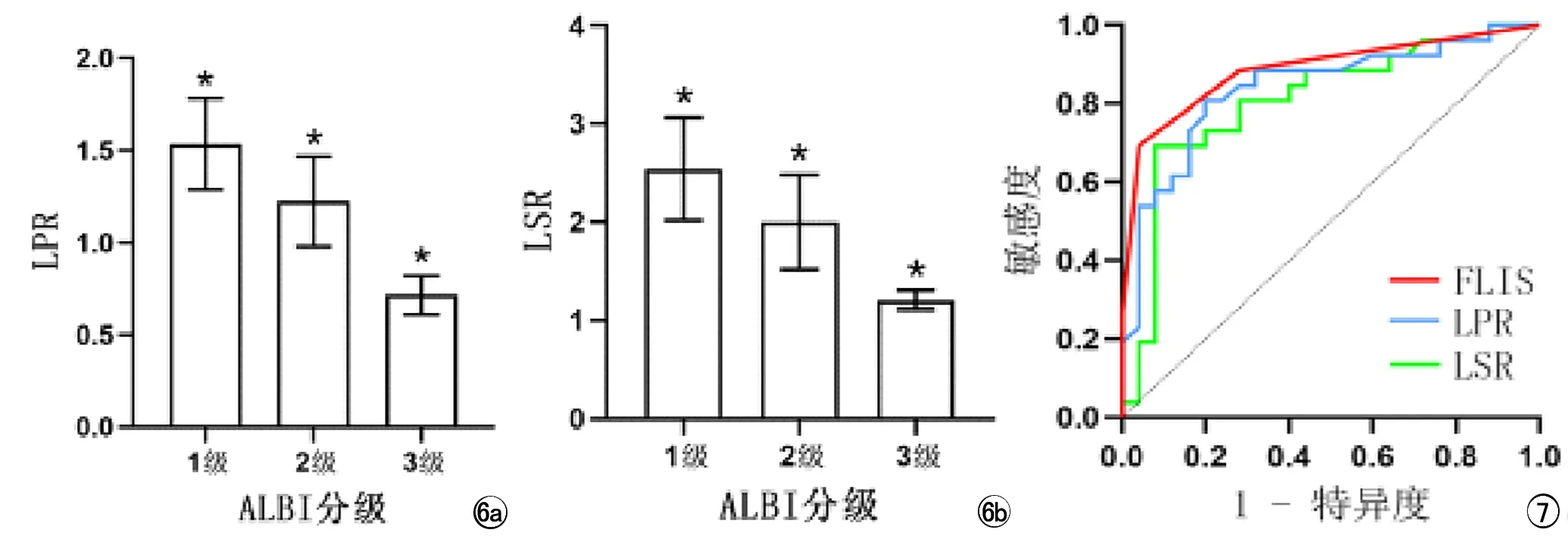
图6 Gd-EOB-DTPA增强MRI 20min肝胆期不同ALBI分级患者a) LPR; b) LSR数值差异条形图。 图7 FLIS、LSR及LPR鉴别ALBI 1级和ALBI 2~3级患者的ROC曲线。
3.FLIS、LSR及LPR鉴别ALBI分级系统相邻级别的诊断效能
FLIS、LSR及LPR区分ALBI 1级和ALBI 2~3级的ROC曲线分析如表3和图7。其曲线下面积(area under the curve,AUC)的顺序从大至小依次为FLIS、LPR及LSR,FLIS对于鉴别ALBI 1级和ALBI 2~3级诊断效能最高,阈值为5分,AUC为0.887,敏感度为0.96、特异度为0.69。
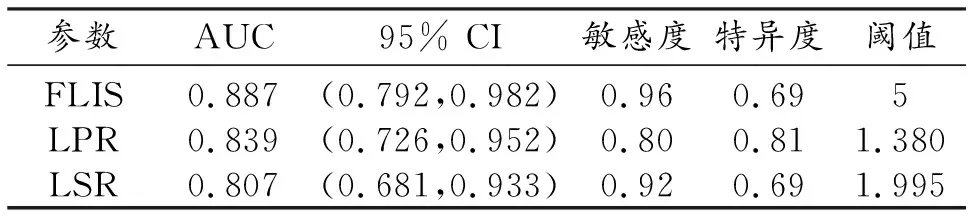
表3 FLIS、LSR及LPR的ROC曲线分析
讨 论
Gd-EOB-DTPA作为一种肝细胞特异性磁共振对比剂,50%对比剂可被有功能的肝细胞摄取并排泄到胆道系统,而另外50%经过肾小球滤过由肾脏排出[9,10]。研究表明肝炎或肝硬化会导致肝细胞内转运蛋白的表达能力下降[11,12]。同时,当肝实质间质组织被纤维化浸润,肝细胞的相对面积下降,功能性肝细胞数量就会相应减少。这两个因素不仅影响肝细胞对Gd-EOB-DTPA的摄取,也影响其排泄到胆道系统。此外,肾脏作为Gd-EOB-DTPA排泄的另一种途径,当其通过肝脏排泄受阻时,经肾小球滤过由肾脏排出则会增加,因其血浆半衰期延长,进而导致肝胆期门静脉高信号[13,14]。这种特殊的排泄机制是Gd-EOB-DTPA增强MRI评估肝功能的理论基础,也为本研究中评估肝功能的参数选择提供了可靠依据。
本研究结果显示FLIS与ALBI分级系统之间存在显著相关性,随着肝功能损害严重程度的进展,FLIS值逐渐降低,可用于评估肝脏功能受损患者的肝功能。Lee等[6]使用Child-Pugh评分验证了FLIS的评估能力,与本研究结果相符。本研究肝实质增强及门静脉征象都与ALBI分级系统呈强相关性,而胆道对比剂排泄仅呈中度相关。研究表明在肝胆期对比剂经胆道排泄速度比肝细胞摄取速度慢[15,16],因此肝实质增强比胆道对比剂排泄更能反应肝细胞的摄取能力。肝功能正常的患者门静脉SI在门静脉期增强峰值后迅速降低,在20 min肝胆期恢复到未增强水平。然而,对于严重肝功能障碍患者肝胆期门静脉相对于肝实质仍呈高信号[13]。
本研究结果表明慢性肝炎及肝硬化患者LSR及LPR与ALBI分级系统呈显著负相关,与之前的研究结果相一致。Kudo等[17]研究表明LSR可以量化肝脂肪变性及肝纤维化,并且显示LSR与肝脂肪变性、肝纤维化及肝功能分级系统之间呈负相关。Takatsu等[18]证实LPR可作为LSR的替代物,用于肝胆期图像中肝脏增强程度的评估。考虑到在肝胆期细胞外液的分布,门静脉的SI比脾脏更能反应血池。此外,当发生脾脏纤维化或者脾脏切除时,LPR具有更高的实用性。
本研究中FLIS、LSR及LPR 3项参数与ALBI分级系统之间均具有显著相关性,随着ALBI分级系统等级的增高,数值逐渐降低。此外,ROC曲线分析表明在3项参数中FLIS对于评估慢性肝脏疾病患者肝功能的准确性最高。此外,FLIS作为一种基于MRI定性特征的视觉评分系统,无需如上述两项SI参数进行额外的测量和复杂的计算。其他定量方式需依赖于特定序列以及扫描仪器场强使其不易应用于临床实践,而FLIS这种简单的评估方式更易于在临床实践中实施。本研究是首次使用ALBI分级系统验证FLIS的评估能力,并与基于SI测量的常用指标进行了诊断效能的比较,在临床工作中对于肝脏储备功能评估的方式选择提供了帮助。
与ALBI分级等临床常用评分系统相比,Gd-EOB-DTPA增强MRI可提供肝脏的解剖信息及进行肝脏体积的测定,进而对肝脏整体或局部的功能情况进行更加全面而准确的评估。这种作用效果使得其在评估肝硬化严重程度、肝脏占位的疾病诊断及评估肝癌术前肝脏储备功能,进而避免术后肝衰竭的发生和减少肝硬化相关并发症致死方面具备显著的应用价值。此外,多项研究表明FLIS可预测慢性肝脏疾病患者首次肝脏失代偿,代偿性进展期慢性肝脏疾病患者的5年死亡率风险仅为1.5%~10%,随着肝脏失代偿的首次发生,5年风险增加到20%~30%,因此使用FLIS预测肝脏失代偿具有重要的临床意义。FLIS对于慢性肝脏疾病患者移植物存活率以及无移植生存率也均具有预测作用,进而为临床工作提供额外的预后信息并指导个体化治疗方案的制定[5,6,19],这也是笔者需进一步研究探索的方向。
本研究的局限性:①本研究为回顾性研究,可能会存在选择偏倚。②本研究中ALBI 3级及慢性肝炎患者数量偏少,需要多中心研究进一步完善。③本研究尚未对肝硬化的病因进行分类,不同病因肝硬化患者对比剂的摄取和排泄机制存在差异。
综上所述,Gd-EOB-DTPA增强MRI肝胆期FLIS与实验室肝功能相关生化指标和ALBI分级系统之间具有相关性。与基于信号强度测量的常用参数相比,FLIS对于鉴别不同ALBI分级患者具有较高的准确性,该评分系统操作简单、结果可靠并易于推广,对于评估慢性肝脏疾病患者的肝功能具有较好的临床价值。
