图像引导肝肿瘤热消融治疗介入导航系统的研究现状
2023-10-20宋姿伟吴薇薇吴水才
宋姿伟,吴薇薇,吴水才*
(1.北京工业大学生物医学工程系,北京 100124;2.首都医科大学生物医学工程学院,北京 100069)
0 引言
原发性肝癌是全球第七大常见的癌症,严重危害人类的生命和健康。最新数据统计显示,肝癌已经成为我国死亡率第二、发病率第四的癌症[1]。肝切除、肝移植和局部消融术是目前临床中最有效的肝癌根治性方法[2-3]。手术切除是治疗肝癌的首选方法,但由于肝癌病症隐蔽、早期发现困难、极易发生转移,会导致手术切除困难或无手术适应证;肝移植是治疗晚期肝癌的唯一有效手段,但临床肝源缺乏、配型困难,术后也可能出现排斥反应[4-5]。据统计,只有约20%的肝癌患者可以通过肝切除、肝移植进行治疗[6]。
随着医学成像技术的进步,早期肝癌的可检测性得到提高,局部热消融技术用于治疗肝癌的方法也得到大力发展[7]。目前热消融技术主要包括微波消融[8]、射频消融[9]和激光消融[10],治疗过程可分为术前规划、术中实施(穿刺)和术后评估3 个阶段。图像引导肝肿瘤(微波/射频)热消融治疗已广泛应用于临床,在医学影像数据(CT、MRI 等)的引导下将热消融针经皮穿刺介入到肿瘤中心作为热源,在一定时间内将肿瘤组织加热到较高温度达到肿瘤的完全性凝固坏死,从而在原位直接杀灭肿瘤。确保消融针精确介入肿瘤内部中心靶点是图像引导肝肿瘤热消融治疗的关键,它直接影响到治疗效果,但目前路径规划(消融针以何种最优路径介入)和穿刺引导(实时掌握消融针在体内的位置)都依赖于临床医生的个人经验,不仅规划过程费时费力,而且往往难以兼顾多项临床准则。另外,术中由医生手持消融针直接穿刺,这对医生专业技能也有较高要求。因此,减少在术前规划中对医生的过度依赖、提高在术中穿刺中的定位精度,是肝肿瘤热消融治疗中需要解决的问题。
近几十年来,针对临床治疗中存在的问题,研究人员开发出影像引导手术、穿刺路径规划、立体定向导航、机器人辅助穿刺等诸多热消融辅助技术和方法。这些辅助技术和方法一定程度上降低了消融手术对医生穿刺经验的依赖,避免了反复进针,从而减少了手术时间和辐射暴露,提高了热消融的治疗效果,有助于消融技术的推广和发展。整合这些关键技术和方法构建热消融穿刺治疗介入导航系统,是该领域内的一个研究热点[11]。
为此,本文综述国内外图像引导肝肿瘤热消融治疗介入导航系统的研究现状及亟须解决的问题,并对近年来的发展趋势进行展望,为相关研究提供新思路。
1 介入导航系统的研究现状
介入导航系统是医生在术前利用医学影像设备获取患者的医学影像数据(CT、MRI 等),再对患者的多模态图像进行处理获得三维模型,从而制订合理的手术计划。在术中通过配准操作,将三维模型与患者的实际体位、手术器械的实时位置统一在一个坐标系下,再利用光学或电磁等定位系统,实时采集手术器械在空间中的位置并显示在计算机设备上,医生通过观察三维模型中手术器械与病变部位的相对位置,对患者进行手术治疗(如图1 所示)。
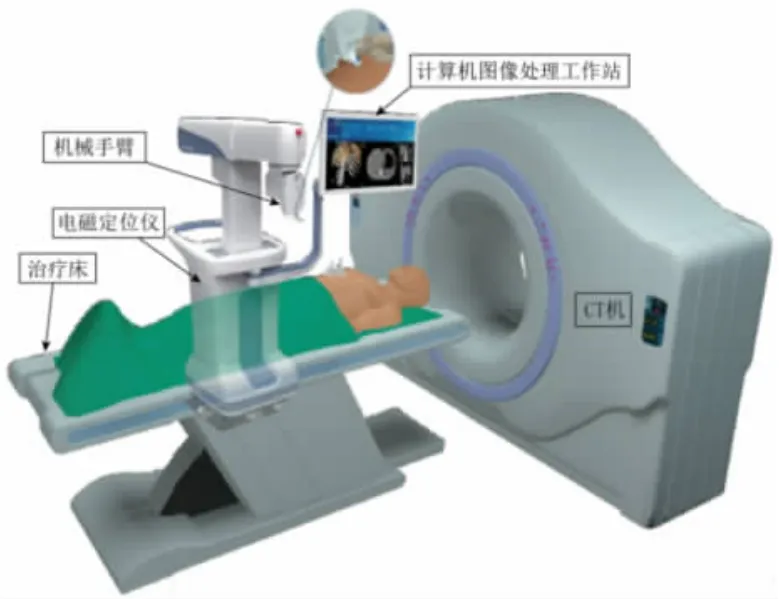
图1 CT 引导的电磁定位导航系统示意图
在对肝肿瘤穿刺的过程中,穿刺位置的选取以及穿刺的深度等都会影响消融结果和肿瘤边缘复发率,因此,需要保证精准的术中定位来实现热消融凝固区适形覆盖肿瘤。而且医生通过术中定位技术来追踪患者的手术部位、手术器械的物理坐标空间位置与姿态,提高了导航系统的精度。术中定位不仅为构建患者物理坐标打下了夯实的基础,也为实现术中配准和术中器械追踪定位创造了条件。
根据定位方式的不同,介入导航系统主要分为光学导航系统、电磁导航系统、超声导航系统和基于增强现实(augmented reality,AR)的导航系统。
1.1 光学导航系统
光学导航是基于单目或多目视觉的原理,通过二维图像信息计算物体空间的三维坐标实时对物体的空间位置进行定位,并对定位后的物体进行实时建模并在三维空间显示。如今光学导航技术成熟且精度高,但需要确保光线传播路径顺畅,操作者的活动范围可能有限。加拿大NDI 公司在1996 年推出了Polaris 光学定位和跟踪导航系统,该系统使用先进的光学测量技术来跟踪附在手术工具上的标记,从而确定三维方向和位置,为手术工具定位提供了准确性和可靠性。Polaris 光学定位和跟踪导航系统被超过90%的光学导航仪使用,该系统的平均误差为0.35 mm,已经被认定为国际标准[12]。另外,该系统可以有效集成到肝肿瘤热消融治疗介入导航系统中,或者用于实验验证的对照标准。以NDI 公司制造的最先进的Polaris Vega 系统为例[13],该系统的有效视场范围覆盖了整个人体,在定位装置位置不变的情况下,能够跟踪有效视场内所有的标记点,并通过分析和计算识别出每个仪器的位置,如图2所示。
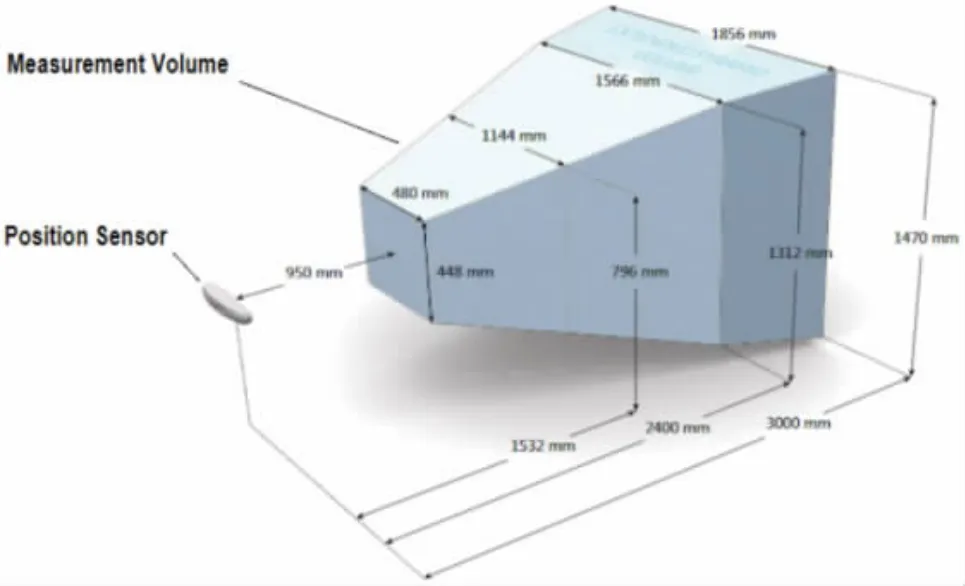
图2 NDI 公司的Polaris Vega 系统的有效视场[13]
2015 年,赵鹏[12]为解决光束遮挡期间的定位问题,设计了一种结合光学定位和惯性定位的系统,在光学定位系统的定位信息受到短时遮挡而无法对目标进行定位时,利用惯性定位系统的定位信息进行定位补偿,使定位信息不间断,可以用于肝肿瘤热消融治疗中,保证介入手术导航系统定位的连续性。
2016 年,林钦永[14]设计了基于近红外光学导航设备的肝肿瘤消融光学导航系统(如图3 所示),利用医学图像可视化技术和双目视觉定位技术实现了手术导航中的自动配准和精确定位。在体模、体外和体内动物上的实验表明,该系统具有较高的准确性和临床可行性。

图3 肝肿瘤消融光学导航系统[14]
2018 年,侯姣蛟等[15]研制了一种应用于肝肿瘤消融的光学定位导航系统(如图4 所示),该系统使用自行开发的近红外光学导航器进行术前模拟,在手术过程中,近红外相机动态跟踪穿刺针相对于患者解剖结构的位置,引导机器人在三维空间中精准定位并执行手术。定位定点和轨迹验证实验结果表明该系统具有一定的临床应用价值,但是在肿瘤热消融的手术过程中,呼吸运动对穿刺有一定影响,导致穿刺率低、疗效差等。

图4 光学定位导航系统[15]
2017 年,新博医疗技术有限公司(北京)研制了磁共振导航微创介入治疗系统(如图5 所示)[16],采用磁共振获取患者术中的解剖和功能图像,同时采用一套光学定位设备探测肝肿瘤热消融针的精确三维坐标。该系统可将消融针的方位信息与来自磁共振的患者图像依照其空间相对位置共同显示在手术室内的屏幕上,为医生进行热消融手术治疗的术前规划和术中精确导航提供所需信息。该系统实现了<2.5 mm的手术导航精度。另外,该公司研制的Alkaid 手术导航设备[17]开发并集成了实时三维成像、实时三维导航及实时控制技术,可在临床应用于肝肿瘤热消融治疗。手术过程中该导航设备接收CT 图像,并实时跟踪消融针的位置,将消融针和病灶的方位以一定的精度在同一个坐标系中显示。在治疗过程中,该导航设备能够接收医学成像系统的图像,帮助医生掌握重要的治疗信息(例如热消融区域的覆盖情况、病灶及其周围组织的信息等),从而可控制、调整治疗设备的参数。该导航设备具有精度高(最高可达到0.5 mm 的到位精度)、手术现场实时引导、可融合多种医学影像、可监控患者呼吸状态等优势,保证了微创手术的安全性和有效性。
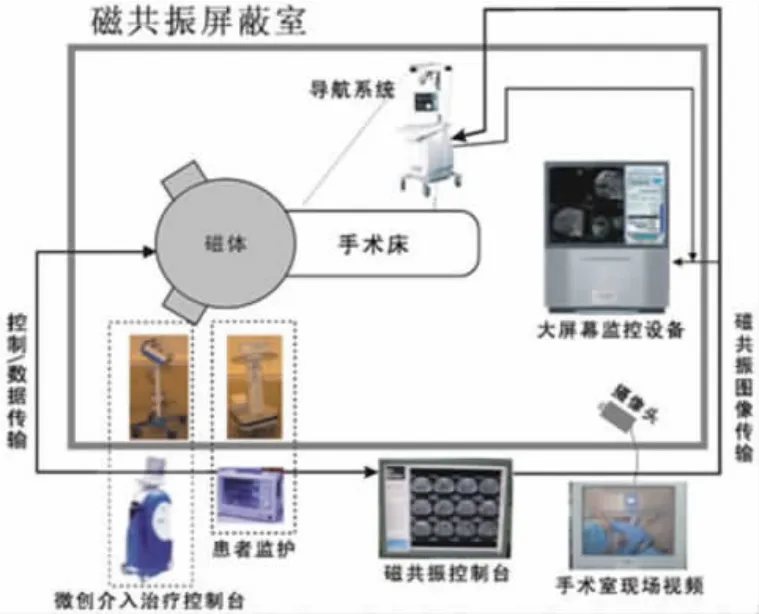
图5 磁共振导航微创介入治疗系统[16]
1.2 电磁导航系统
电磁导航是利用磁场、电场或者电磁场的方式对目标物进行跟踪定位和导航,是图像引导程序导航和可视化的核心平台技术。该技术在非视线环境中提供了高跟踪精度,允许在光学跟踪不可行的位置进行仪器导航。电磁跟踪(electromagnetic tracking,EMT)在应用中有许多优点,例如用于治疗肝脏病变的经皮射频消融,其中针尖可能由于困难的肝脏环境(例如皮下脂肪或消融伪影)而被遮挡,使用EMT技术可以准确获取针尖位置。
2003 年,NDI 公司生产了Aurora 电磁定位系统[18]。该定位系统广泛应用于医学图像引导的肝肿瘤热消融介入导航系统中,可以在手术过程中跟踪消融针,使其以虚拟探针的形式实时显示在患者影像上,具有定位精度高、使用灵活方便等特点。如图6 所示,该定位系统由针形或圆形等多种定位器、有多个定位器插口的接口单元、磁场发生器以及控制单元组成,其中定位器可以嵌入到消融针等手术器械中,控制单元从定位器接口单元收集信息,计算每个定位器的位置和方向,保持定位器与患者坐标系之间的配准。

图6 Aurora 电磁定位系统[18]
2015 年,Mauri 等[19]构建了具有US-CT/MRI 融合成像的实时虚拟电磁导航系统,并评估了该系统对超声无法检测到的肝肿瘤热消融治疗的可行性,结果显示295 个肿瘤中,共有282 个(95.6%)被正确靶向,其中266 个(90.2%)成功消融。如图7 所示,该系统由超声扫描仪、专用的内置硬件和软件组成,而集成在工作站中的电磁跟踪系统由一个磁场发射器(如图A 中黑色箭头所示)和2 个电磁传感器组成,其中1 个电磁传感器应用于凸性超声探头(如图B中白色箭头所示),另1 个电磁传感器安装在消融针上(如图C 中箭头所示)。
2017 年,Jaeger 等[20]设计了第一个用于图像引导穿刺(介入)导航系统的电磁定位开源平台Anser EMT,并将该平台的性能与使用Hummel 评估协议的其他商业定位平台进行客观比较,结果显示该平台具有1.14 mm 的定位精度和角旋转精度。但与其他EMT 平台一样,该平台也容易受到涡流和铁磁失真引起的跟踪误差的影响。Anser EMT 平台证明了使用开源技术在临床环境进行准确和低成本跟踪的可行性,可以用于图像引导的肝肿瘤热消融介入导航系统。
2018 年,Paolucci 等[21]设计了一种基于电磁腹腔镜超声(electromagnetic laparoscopic ultrasonography,ELUS)的肝肿瘤热消融动态导航系统,该系统扩展了用于仪器跟踪的电磁技术,使用桌面场发生器(field generator,FG)生成磁性工作空间,将带有柔性尖端的腹腔镜超声(laparoscopic ultrasonography,LUS)用于术中成像,并通过开发由不锈钢组成的腹腔镜超声跟踪器(laparoscopic ultrasonography tracker,LUT)来提供电磁技术,如图8 所示。除了在腹腔镜模型中准确有效地定位消融探针外,这是首次在导航系统中引入基于三维超声的术中靶向精度验证,而且不依赖于术前成像的配准,减少了由于器官变形而导致的潜在不准确性。但是该系统也存在一定的局限性,对沿消融针路径的潜在相关解剖结构的了解有限,因此不适用于肿瘤能见度改变或既往化疗后病变消失的治疗。

图8 基于ELUS 的动态导航系统[21]
2019 年,Hinds 等[22]提出了一个用于EMT 的开源框架,并在Anser EMT 平台上进行了测试。该研究使用CustusX 导航平台(一个图像引导治疗的开源研究平台,致力于术中导航和超声成像)的跟踪框架和市售的电磁跟踪针头进行肝肿瘤靶向,肿瘤的消融是用市售的消融系统进行的,实验结果证明对5 mm以内的肿瘤都可完全消融。
2020 年,医达极星医疗科技(苏州)有限公司研制了一种实时交互型计算机辅助精准肿瘤治疗术中导航系统(IQQA-Guide 导航)[23],该产品为国内首个用于成人肺及腹部软组织实体器官的穿刺手术导航设备。与常规CT 引导方式相比,可提高穿刺准确率,减少进针次数和CT 扫描次数,具有显著的临床应用价值。该产品术前基于患者CT 数据制订导航计划(手动规划),术中利用电磁定位原理进行手术导航,但不具备肝肿瘤热消融治疗手术路径的自动规划和导航功能。
2023 年,姚洁等[24]针对肝肿瘤热消融治疗过程中消融针的实时引导问题,开发了一套基于电磁定位装置(NDI 公司的Aurora)的热消融穿刺电磁导航系统。该系统根据电磁导航坐标系与三维影像坐标系对应标记点的坐标信息,使用奇异值分解完成空间配准并实时跟踪消融针的空间位置和姿态。实验结果显示该系统平均目标位置误差为3.10 mm,能够有效辅助医生进行手术操作。但是该系统对穿刺路径的规划是手动的,而且只使用了体模进行实验,存在一定的局限性,还需要进一步研究改进。
1.3 超声导航系统
超声波在医疗领域应用非常广泛,例如医疗诊断、医疗成像等。超声导航技术是基于超声波测距原理,将超声波发射传输和接收的装置固定,通过记录时间来计算距离,达到实时定位的目的[25]。该技术的优点是成本低、简单方便,但是由于超声波的传输距离短,在不同介质中衰减速度也不同,定位导航的范围有限,而且定位精度很容易受到环境温度、湿度、气流等的影响。
在神经外科手术中,最早使用术中超声定位技术要追溯到1965 年[26-28],当时研究人员设计使用A型超声,用以定位和描述脑内肿块病变。随着超声技术和设备的不断发展,超声分辨力、成像质量等都得到了提升,而且术中多是超声定位导航与其他导航技术相结合使用。
2020 年,Amalanesan 等[29]将超声图像引导和机电支持臂系统结合,医生使用由机电支持臂引导的超声波捕捉设备对人体腹部进行成像和检查,从而实现轨迹的预规划和半自动对准,具有足够的精度。经过临床医生检查和评估,证明了超声引导机电支持臂辅助治疗肝肿瘤热消融是高效可行的。但超声定位成像质量差、成像视野窄,在肝肿瘤热消融治疗中容易受到气体等遮挡,致使医生通过观察超声图像难以对肿瘤区域进行精准定位。为了解决传统超声图像对手术针跟踪困难的问题,毕津滔等[30]构建了一个基于电磁定位技术的超声引导穿刺系统,采用超声图像确定病变位置,采用电磁定位系统(NDI公司的Aurora)进行实时定位和跟踪手术针。为验证该系统的有效性及可行性,搭建了介入导航系统实验平台,进行了多种角度下的靶向穿刺定位实验,如图9 所示。结果显示假体穿刺实验中的平均准确度为1.62 mm,可满足肝肿瘤热消融介入导航手术的临床精度要求。
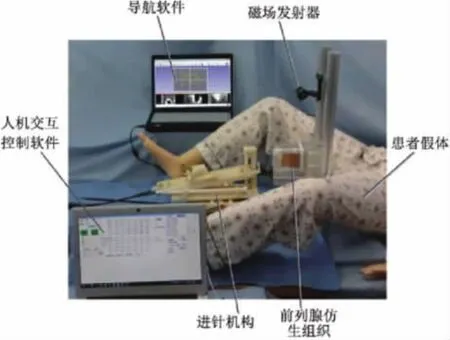
图9 介入导航系统实验平台[30]
1.4 基于AR 的导航系统
近年来,基于AR 和虚拟现实技术的医疗导航已经成为研究热点。AR 导航技术先进行图像三维建模,然后将三维模型与真实环境精确匹配,使真实手术场景与具有三维信息的虚拟场景相互关联,可以直观地帮助医生进行手术。
2018 年,Paolis 等[31]设计了一种用于肝肿瘤射频消融的AR 手术导航系统。该系统基于光学跟踪实现病患三维模型与病灶区完成三维配准,可用于支持更精准的术前规划与术中射频消融针引导。为评估该系统的准确性,研究人员在试验台和假人上进行了测试。结果表明使用该系统的准确率略低于有经验的医生,而且该系统中的三维模型未考虑由于患者呼吸而产生的形变。
2019 年,郭坚溪[32]研发了一款可用于肝脏肿瘤消融治疗的AR 手术导航系统,并通过腹部体模实验和动物实验验证了系统的导航精度和可视化效果。经实验证明,该系统能达到理想的导航精度要求,有效提高穿刺效率,减少穿刺次数和CT 扫描次数;同时,可实现穿刺操作过程“可视化”和实时跟踪导航,是CT 引导肝脏肿瘤穿刺消融的有效辅助手段。
2022 年,Solbiati 等[33]首次使用一种基于AR 的经皮介入手术导航系统Endosight(如图10 所示)进行肝肿瘤热消融治疗,该系统通过被动标记将CT 扫描重建的三维图像自动叠加在患者身上,也就是在医生的真实视线上实时叠加虚拟图像,同时以三维形式可视化患者的表面和内部解剖结构、目标病变和到目标的轨迹路径。实验结果表明该系统具有高靶向精度(平均3.4 mm),15 个病变治疗成功(即肝肿瘤完全消融)。
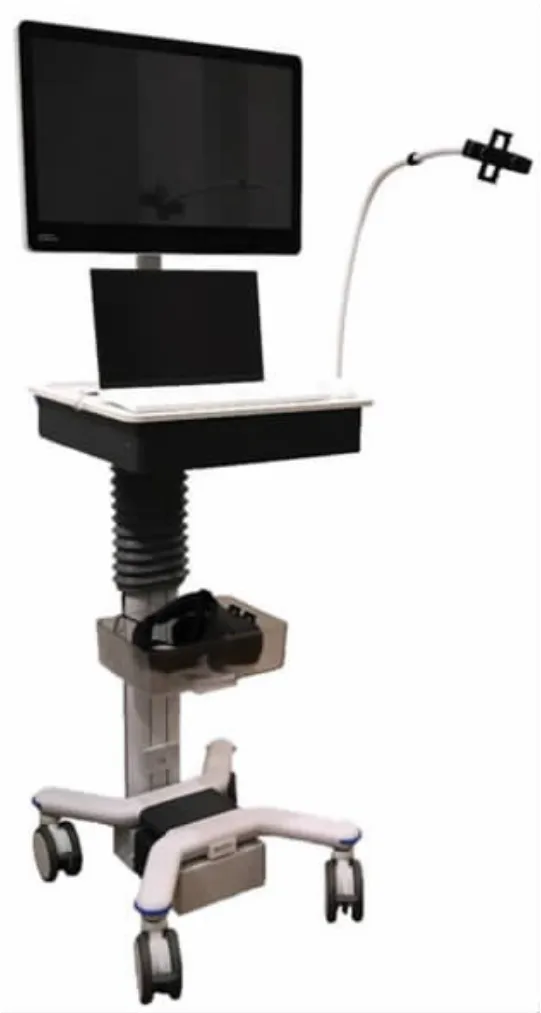
图10 经皮介入手术导航系统Endosight[33]
虽然AR 技术对导航系统的研究和应用具有重要价值,但尚未建立完善的评估体系,因此大多数研究仍处于实验室探索阶段[34-35]。
2 结语与展望
肝肿瘤在我国发病率很高,严重影响我国民众的身体健康。微波(射频)热消融术具有微创性和广泛的适用性,近年来已成为肝肿瘤的根治性手段之一。因此,研究人员开始开发热消融穿刺治疗介入导航系统来指导或辅助临床医生执行消融针穿刺手术,提高肝肿瘤热消融治疗的有效性与安全性。目前临床中的介入导航系统多采用电磁或光学定位导航,但基于图像引导、具有穿刺路径全自动规划和疗效评估功能的肝肿瘤热消融治疗介入导航系统还比较少。
目前,肝肿瘤经皮(微波/射频)热消融治疗介入导航系统还存在如下问题:(1)消融针穿刺路径规划集中在术前的手术规划,且普遍采用手动规划。而从临床实际需求来看,热消融要求术中实时的穿刺路径自动规划。(2)穿刺路径规划与手术导航未形成有效的统一,导航系统中各坐标空间应准确配准,确保导航精度。(3)目前的手术导航系统没有基于医学影像的疗效评估功能。(4)关于肝肿瘤消融术的各类导航系统大多处于实验研究阶段。
未来肝肿瘤经皮介入(微波/射频)热消融治疗介入导航系统可从以下几个方向进行改进:(1)设计基于临床多约束条件的热消融针穿刺路径自动规划新方法。(2)穿刺路径规划与手术导航形成有效的统一,导航系统中各坐标空间准确配准,实现实时跟踪定位,确保导航精度。(3)在手术导航系统中加入疗效评估模块,后续研究应与临床紧密结合,建立消融介入导航系统的完整评价体系和应用规范。(4)为了成功地实现各类导航系统的临床应用,还需进一步解决人体呼吸运动等因素对精准定位的干扰。
目前肿瘤经皮(微波/射频)热消融治疗介入导航系统的研究还处于初级阶段,距离广泛的临床应用还有一定的距离。如果介入导航系统能有更先进的技术、更高的精确度和更完善的体系,可有效推动肝肿瘤(微波/射频)热消融治疗技术的发展,给全国更多肝肿瘤患者带来福音,具有重要的经济和社会效益。
