重组人生长激素对棕榈酸诱导的HepG2细胞脂质沉积的影响
2023-10-20冉丽媛张金金吴英杰
张 芳 冉丽媛 张金金 吴英杰,,3
1.山东第一医科大学(山东省医学科学院)实验动物学院,山东 济南 250117;2.山东第一医科大学附属省立医院模式动物研究所,山东 济南 250012;3.山东第一医科大学(山东省医学科学院)医学科技创新中心,山东 济南 250117
代谢相关脂肪肝病(metabolic-dysfunctionassociatedfatty liver disease ,MAFLD)又称非酒精性脂肪肝病,是代谢相关疾病累及肝脏的表现,患者通常没有饮酒过量的既往不良生活史,并且伴有一定程度的肥胖或胰岛素抵抗[1]。MAFLD 是全球广泛分布的代谢性疾病,全球发病率约25%。随着我国城市化进程的加快,MAFLD 发病率也逐年攀升。在全球范围内,估计有2 000 万人最终会死于MAFLD,同时MAFLD 会增加2 型糖尿病和心血管疾病的患病风险[2]。尽管近年来针对MAFLD 的流行病学、发病机制和治疗靶点等方面的研究取得了一定进展,但目前临床治疗MAFLD 仅仅局限于对患者的生活方式进行干预[3],尚无有效治疗药物,而前者存在见效慢、易反复、患者依从性差等缺点,成为MAFLD 干预治疗的瓶颈。因此,开发一种安全有效的治疗药物,是突破临床MAFLD 治疗瓶颈的首要任务。
生长激素(growth hormone,GH)是由垂体前叶分泌的由191 个氨基酸组成的多肽类激素,是调节机体生长发育和新陈代谢的重要因子[4]。GH 通过与肝脏表面的生长激素受体(growth hormone receptor,GHR)结合,刺激肝细胞合成并分泌胰岛素样生长因子(insulin-like growth factor-1,IGF-1),在机体生长发育和代谢稳态调控中发挥关键的作用[4]。研究表明,循环GH 水平降低或GHR 功能缺失会增加MAFLD 和非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)的患病风险[5]。本研究拟通过体外高脂诱导建立脂肪肝细胞系模型,探讨重组人生长激素(recombinant human growth hormone ,rhGH)对细胞系模型中脂质代谢的影响,为rhGH用于MAFLD治疗提供理论基础。
1 材料与方法
1.1 实验细胞系
人肝癌HepG2 细胞系由大连医科大学基础医学院黄琳教授惠赠。
1.2 药品与试剂
DMEM培养基购自美国Biological公司,胎牛血清购自美国Gemini 公司,双抗、PBS、胰蛋白酶、4%多聚甲醛和苏木素染液购自中国Biosharp 公司,棕榈酸(palmitic acid,PA)购自美国Sigma 公司,饱和油红O染液、RIPA裂解液、PMSF磷酸酶抑制剂均购自北京索莱宝科技有限公司,CCK8 试剂盒购自美国MCE公司,5X蛋白上样缓冲液、快速封闭液和通用型抗体稀释液均购自赛文创新(北京)生物科技有限公司,蛋白Marker购自上海雅酶生物医药科技有限公司,Tween-20购自翌圣生物科技(上海)股份有限公司,AR 级甲醇购自国药集团化学试剂有限公司,PVDF 膜和ELC 发光试剂盒均购自美国Millipore 公司,GAPDH 抗体、ATGL 抗体、FASN 抗体、二抗购自美国ABclonal公司。rhGH由长春金赛药业有限公司提供。
1.3 主要仪器
倒置显微镜(日本Nikon公司),荧光定量PCR仪(美国Thermo公司),酶标仪(美国BIOTK公司),超微量分光光度计(美国Thermo 公司),电泳仪(BIORAD),电泳槽(BIO-RAD),转膜仪(BIO-RAD),荧光及化学发光成像系统(上海勤翔科学仪器有限公司)。
1.4 脂肪肝细胞系模型建立及培养
HepG2 细胞用DMEM 培养基(含10%胎牛血清、1%青霉素和链霉素)于37 ℃、5% CO2细胞培养箱中培养,每2天传代1次,0.25%胰蛋白酶进行消化、传代,取对数生长期的细胞进行实验。血细胞计数板进行计数,12 孔板的铺板浓度为3 × 105个/mL,每孔补加DMEM培养基至1 mL,混匀后置于培养箱中培养。待细胞长至80%以上时,实验组用0.2 mmol/L PA 诱导24 h,对照组用牛血清蛋白(bovine serum albumin,BSA) 诱导24 h。
1.5 CCK8实验
将细胞在96孔板培养24 h,向培养板中加入不同浓度的待测药物,孵育24 h 后,向每孔中加入10 μL CCK8 溶液,将培养板置于培养箱内孵育2 h,用酶标仪测定在450 nm处的吸光度。
1.6 油红 O 染色
细胞用4 ℃ 预冷的PBS 洗涤2次,每次30 s;然后用4%多聚甲醛固定30 min;油红染液避光染色15 min;吸走染液,PBS洗涤2遍;60%乙醇溶液将样本分化至间质清晰,PBS 洗涤2 遍;苏木素复染核5 min,PBS 洗涤至不变色后用苏木素分化液分化2~ 3 s,PBS清洗;显微镜观察,拍片。
1.7 RNA 提取及实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)
收集待检测细胞,使用试剂盒提取总RNA,检测RNA 浓度,反转录为cDNA,以此作为模板,进行RT-qPCR,所用的引物序列见表1。

表1 基因引物序列
1.8 Western Blot
收集待检测细胞,加入RIPA 裂解细胞,提取细胞总蛋白。使用10%的SDS-PAGE 凝胶电泳,分离蛋白,转印至PVDF 膜。膜用快速封闭液封闭1 h,一抗孵育4 ℃过夜。TBST 洗膜3 次后,二抗室温孵育2 h,结束后TBST洗膜3次,加入显影液,显影。
1.9 统计学处理
数据分析采用Graphpad Prism 8.0 统计软件,计量资料采用均数 ± 标准误(mean ± SEM),组间比较采用方差分析。检验水准α= 0.05。
2 结 果
2.1 成功建立脂肪肝细胞系模型
使用不同浓度的PA(0.1 mmol/L、0.2 mmol/L)诱导HepG2 细胞24 h,油红O 染色后,查看细胞质中脂质沉积的状况。与BSA组相比,加入0.1 mmol/L PA 即可引起HepG2 细胞中脂质积聚,且随着PA浓度升高,脂质含量逐渐增加;0.2 mmol/L PA 诱导条件下,HepG2 细胞形态变圆,胞浆内脂质积聚更加明显,见图1。本研究选择了0.2 mmol/L PA作为诱导条件进行后续实验。
2.2 PA及rhGH药物毒性的验证
通过CCK8 实验检测不同浓度的PA 和rhGH 对HepG2细胞存活率的影响。PA具有一定的细胞毒性,当PA 浓度 > 0.2 mmol/L 后,细胞存活率降低30%以上。加入rhGH后,加速了HepG2细胞的生长繁殖,当rhGH浓度 > 320 μg/L时,P< 0.01,差异具有统计学意义,见图2。当不同浓度的rhGH与0.2 mmol/L PA混合处理细胞时,可降低PA对细胞的毒性作用。

图2 不同浓度PA和rhGH对HepG2细胞存活率的影响
2.3 rhGH对HepG2细胞脂质积聚的影响
为了验证rhGH对HepG2细胞内脂质积聚的影响,在0.2 mmol/L PA 诱导脂肪肝细胞模型的同时,给予不同浓度(5,10,20,40,60,80,100 μg/L) rhGH处理细胞24 h ,油红O染色观测细胞内脂滴积聚情况。结果发现,rhGH 处理可导致HepG2 细胞内脂质积聚减少,并且呈剂量依赖性,rhGH 给药浓度大于40 μg/L时,细胞内脂质积聚明显减少,见图3。
2.4 rhGH 对HepG2 细胞脂质代谢相关基因表达的影响
如表2 所示,rhGH 0 μg/L 组(即脂肪肝细胞模型组)与BSA 组相比,脂质合成基因FAS、SCD1、ACC1表达量显著升高;脂肪酸β 氧化相关基因CPT1A和脂质分解相关基因ATGL表达量显著下降,差异均有统计学意义(P< 0.05);脂质分解相关基因HSL表达差异无统计学意义(P> 0.05)。给予不同浓度rhGH 刺激后,与rhGH 0 μg/L 组相比,脂质合成基因表达量呈下降趋势,脂质分解及脂肪酸β 氧化相关基因表达无明显变化。
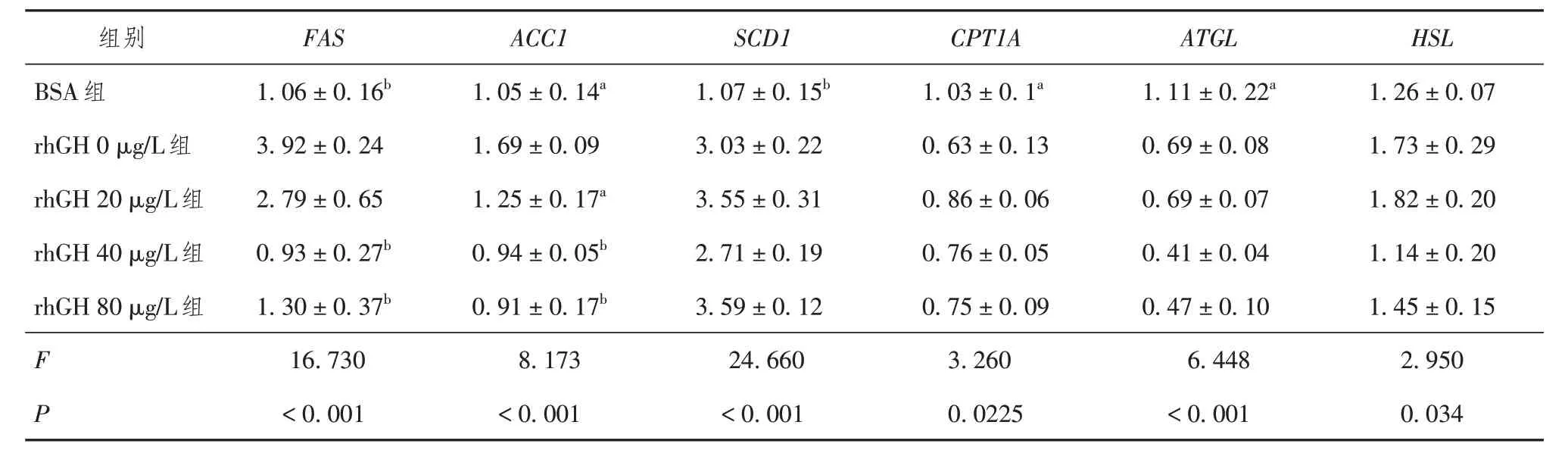
表2 RT-qPCR检测不同浓度rhGH对HepG2细胞脂质积聚的影响
2.5 rhGH 对HepG2 细胞脂质代谢相关蛋白水平的影响
如图4 所示,rhGH 0 μg/L 组与BSA 组相比,脂合成蛋白FASN 表达量显著升高,脂质分解蛋白ATGL没有变化。随着rhGH浓度升高,脂合成蛋白FASN表达量逐渐降低,脂质分解蛋白ATGL没有显著变化。以上结果表明,rhGH可能通过抑制脂质从头合成途径来改善PA 诱导的HepG2 细胞脂质积聚。
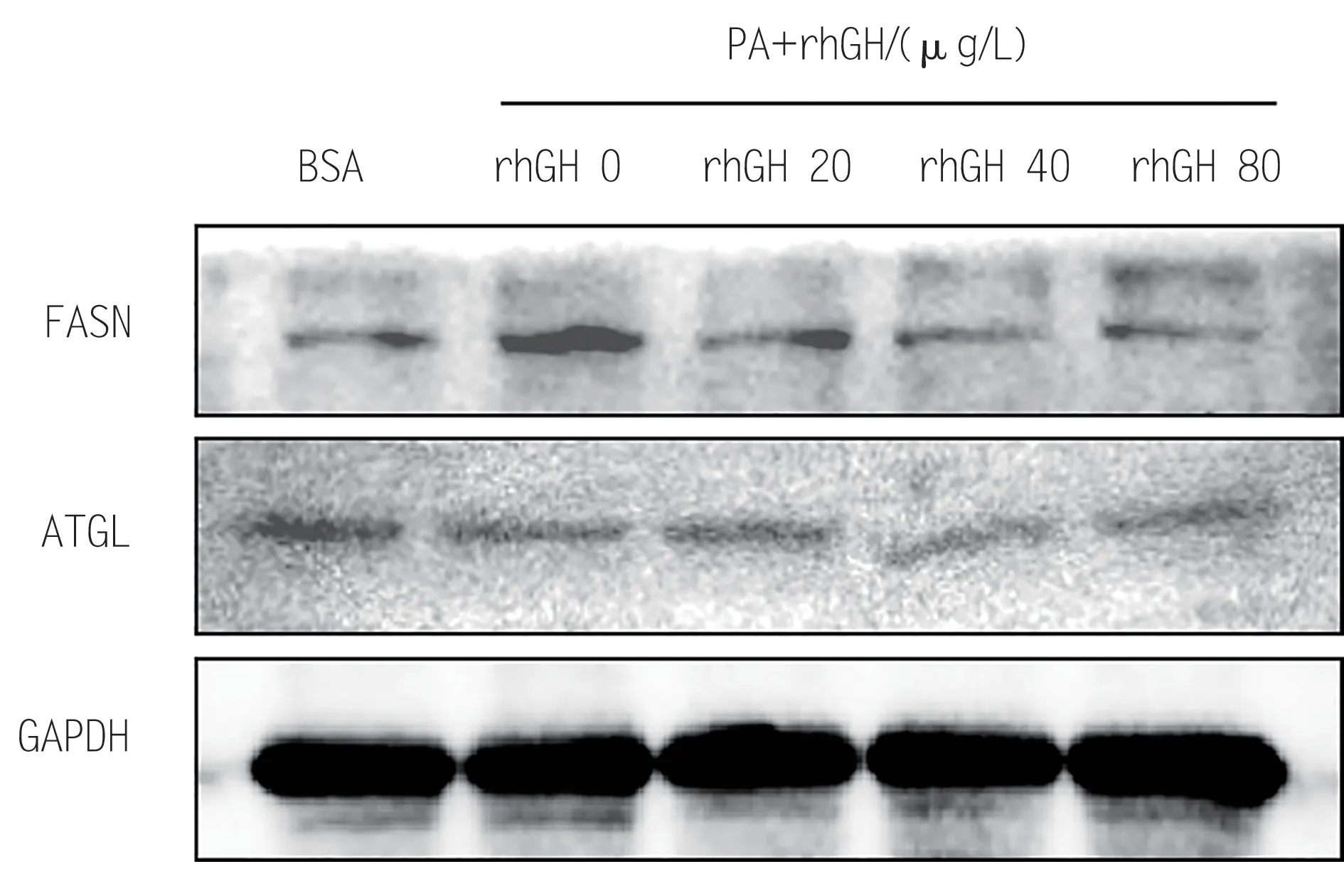
图4 不同浓度rhGH对HepG2细胞脂质代谢相关蛋白的影响
3 讨 论
近年来脂代谢紊乱相关疾病发病率逐年攀升,MAFLD 在全球患病率已达到25% 左右,我国MAFLD患病率亦高达15%,对医疗卫生带来很大的压力。相对于急速增长的患病率,目前针对MAFLD治疗尚无理想药物,因此,积极探索MAFLD防治的新手段和治疗的新药物迫在眉睫。
肝脏是人体最大的腺体,在脂类的消化吸收、分解、合成和运输中起重要作用。肝脏中脂质的产生和积累在很大程度上取决于脂质从头合成以及氧化代谢之间的平衡[6]。健康个体的肝细胞可利用饮食中的碳水化合物,通过脂质从头合成形成甘油三酯(triglyceride,TG)在肝脏中积累,肝脏中的TG可以极低密度脂蛋白(very low density lipoprotein,VLDL)的形式从肝脏输出到脂肪组织,在营养和胰岛素缺乏时,重新分解成脂肪酸并提供给包括肝脏在内的多个组织利用。但是当机体摄入过多营养物质和肥胖的情况下,会使得肝脏脂质从头合成增加,线粒体β-氧化减少,大量TG 在肝细胞中积累,导致脂质沉积、胰岛素抵抗等一系列与MAFLD 相关的病理表型[7]。本研究使用PA 模拟营养过剩条件,体外构建模拟MAFLD的脂肪肝细胞系模型,研究结果显示,HepG2 细胞内脂质积聚与PA 浓度正相关。
rhGH 在临床上用于治疗生长激素缺乏症(growth hormone deficiency,GHD)已有30多年历史,取得了良好的疗效。近年来还发现,rhGH在治疗非生长激素缺乏症的身材矮小、抗衰老和减肥等方面也有一定的效果。对肥胖儿童[8]、患有肥胖症和MAFLD的年轻成人[9]、健康的老年女性和男性进行rhGH 治疗[10],可有效降低患者血脂水平,改善患者的身体健康状况。临床数据表明,肥胖患者的GH分泌减少,肝脏IGF1 分泌水平相应降低[11],且患者GH/IGF1轴异常后,其肝脂肪变性向NASH、肝硬化和终末期肝病的转变速度加快[12]。成人GHD 患者通常伴随腹型肥胖、血脂异常、胰岛素抵抗及MAFLD[13]。对成人GHD 患者给予GH 补充治疗可显著改善其肝脏脂质沉积、纤维化及炎症等病理指标[14]。肝脏敲除GHR 增加小鼠肝脏的脂肪合成和堆积,促使肝脏发生纤维化和炎症[15]。本研究结果显示,rhGH 处理可显著减少高脂诱导的脂肪肝细胞模型中脂质积累,且呈剂量依赖性。这主要是由于肝细胞中脂质从头合成途径被抑制导致的。以上临床和基础研究结果充分表明,GH 信号通路在肝脏脂质代谢稳态维持中发挥关键作用,rhGH 具有直接用于MAFLD 治疗的潜力。但由于目前将rhGH 直接用于MAFLD 治疗的报道还较少,依然需要进一步的体内实验和临床数据分析,对rhGH的使用时间和剂量等进行研究和论证。
利益冲突所有作者均声明不存在利益冲突
