贝莱斯芽孢杆菌CL-4 固态发酵对豆粕营养品质的影响
2023-10-20瞿子惠刘歆郑琳魏炳栋闫晓刚于维陈龙郎洪彦
瞿子惠,刘歆,郑琳,魏炳栋,闫晓刚,于维,陈龙,郎洪彦
(吉林省农业科学院动物营养与饲料研究所,吉林公主岭136100)
豆粕是食品和饲料领域常见的优质植物性蛋白来源。 豆粕中主要的抗原蛋白是大豆球蛋白和β-伴球蛋白,分别占豆粕总蛋白的30%和40%左右[1]。 当幼龄仔猪摄入这类蛋白质时,会引起过敏,导致吸收不良综合征、生长抑制和腹泻。 此外,豆粕中还含有非淀粉多糖,主要由纤维素、半纤维素和果胶组成,被证实是导致断奶仔猪肠道疾病的诱因[2]。 发酵豆粕通过添加有益微生物,如少孢根霉(Rhizopus oligosporus)、米曲霉(Aspergillus oryzae)、短乳杆菌(Lactobacillus brevis)或枯草芽孢杆菌(Bacillus subtilis),可以有效去除部分对动物有害的抗营养因子,从而改善豆粕营养品质,提高动物消化利用率[3-5]。
贝莱斯芽孢杆菌(Bacillus velezensis)作为芽孢杆菌中新划分的一个种,于2016 年与B. methylotrophicus、B. amyloliquefacienssubsp. plantarum、B. oryzicola重新归类并命名为B. velezensis[6]。 有关B. velezensis的研究集中于生物防治和促进植物生长等方面[7-8]。 贝莱斯芽孢杆菌于2020 年被列入欧盟安全资格认定(QPS)推荐的生物制剂列表中,可作为新型发酵饲料菌种[9],有关B.velezensis在畜禽应用的报道逐渐增多[10],主要集中在饲料霉菌毒素[玉米赤霉烯酮(zearalenone,ZEN)和黄曲霉毒素B1(AFB1)]脱毒[11]和水产益生菌方面[12]。 本研究团队主要开展有关B.velezensis在木质纤维素利用方面的研究,前期成功分离并鉴定一株来自鸡盲肠内容物的B.velezensisCL-4,具有富产木质纤维素酶优势,同时具有抑制病原细菌和真菌的能力,对动物安全无毒,具有良好的益生特性[13]。 现已完成了该菌株的全基因组测序,并成功用于发酵玉米胚芽粕,获得授权发明专利《一株禽源贝莱斯芽孢杆菌CL-4及其应用》(专利号:202110109964.X)。 豆粕常用发酵菌多为枯草芽孢杆菌[2]、酿酒酵母菌[14]、植物乳杆菌[15]等,仅有少数文献报道了贝莱斯芽孢杆菌发酵豆粕的应用[16]。 因此,本研究利用B. velezensisCL-4 发酵豆粕,探究发酵前后豆粕中抗营养因子、营养成分、微生物、酶活力以及表观形态等变化,旨在为生物蛋白饲料提供新型优良菌种,为进一步改善发酵豆粕营养品质提供理论依据和数据支撑。
1 材料与方法
1.1 试验材料
1.1.1 菌株和发酵原料 菌种贝莱斯芽孢杆菌(B. velezensis)CL-4 分离自肉鸡盲肠内容物,病原指示菌为金黄色葡萄球菌ATCC25923、大肠埃希菌ATCC25922,均由吉林省农业科学院动物营养与饲料研究所保存,豆粕购自吉林省公主岭禾丰牧业有限责任公司。
1.1.2 主要试剂和仪器 DNS 试剂、LB 培养基、大豆球蛋白和β-伴球蛋白ELISA 试剂盒购自北京龙科方舟生物工程技术有限公司,植物蛋白提取试剂盒购自南京凯基生物有限公司。 控摇床,恒温培养箱,高压灭菌锅,超净工作台。
1.2 试验方法
1.2.1 豆粕抗原蛋白平板制备及菌株降解能力测定 抗原蛋白培养基的制备:称取5 g 豆粕,磨碎后过60 目筛,加入pH 8.5 的Tris-HCl 缓冲液75 mL,30 ~50 ℃、 200 r/min 振荡1 h,9 000 r/min离心40 min,沉淀再浸提一次,合并两次上清液。 向上清液中加入NaHSO3至0.01 mol/L,用2 mol/L HCl 调pH 至6.4,4 ℃沉淀过夜。 于6 500 r/min、4 ℃离心30 min,得到大豆球蛋白沉淀。 上清液加NaCl 至0.25 mol/L,调pH 至4.0 ~6.0,室温搅拌30 min,9 000 r/min、4 ℃离心30 min,上清液稀释2 倍,调pH 至4.8,6 500 r/min离心20 min 得到β-伴球蛋白沉淀。 将所有沉淀溶于ddH2O,调pH 至5.5 ~6.5,加入1.5%(w/v)琼脂,115 ℃灭菌20 min。
抗原蛋白平板制备:在灭菌培养皿中加入15 mL 抗原蛋白培养基,待冷却后再加入营养培养基(蛋白胨10 g/L、牛肉膏3 g/L、氯化钠5 g/L、琼脂20 g/L,121℃高压灭菌15 min)15 mL,冷却至凝固,待培养基表面无明显水迹后,将已灭菌的牛津杯置于试验平板中,轻轻加压,使其与培养皿接触无空隙,4℃保存备用。
菌株降解豆粕抗原蛋白能力测定:根据Wongputtisin 等[17]的方法制备候选菌株B. velezensis CL-4 粗上清液,过0.22 μm 微孔滤膜。 取100 μL 粗上清液加入抗原蛋白筛选平板的牛津杯中培养24 h,以添加100 μL 生理盐水为对照。 若菌株对抗原蛋白有降解作用,即可见到水解圈。 根据水解圈直径与牛津杯孔径比值测定B. velezensisCL-4 的豆粕抗原蛋白降解能力。
1.2.2 发酵豆粕的制备 将B. velezensisCL-4 在37 ℃液体LB 培养基中培养12 h 以备固态发酵。将豆粕121 ℃高压灭菌处理20 min,称取灭菌后的豆粕100 g 于500 mL 烧瓶中,发酵菌种添加量为107CFU/g,最终含水量为40%,搅拌均匀后用滤菌呼吸膜封住瓶口于37 ℃下发酵24 h,然后105 ℃、30 min 阻断发酵。 以0.85%无菌生理盐水为对照,重复3 次。 将发酵样品65 ℃烘干24 h,冷却研磨过60 目筛,用于SDS-PAGE 和营养成分分析。
1.2.3 pH 值和发酵代谢产物相关指标测定 准确称取0、24 h 的发酵样品各1.00 g 溶于9.0 mL蒸馏水中,室温150 r/min 振荡10 min,静置1 min后测定pH 值;采用倍比稀释法测定发酵样品中活菌数;通过DNS 法测定纤维素酶、木聚糖酶和果胶酶活力,中性蛋白酶活力测定参考行业标准SB/T 10317—1999;使用琼脂扩散法测定发酵后豆粕的抑菌性,以金黄色葡萄球菌ATCC25923 和大肠埃希菌ATCC25922 作为抑菌试验的指示剂。
1.2.4 营养成分分析 根据AOAC(2005)测定发酵前后豆粕中干物质、粗纤维、粗蛋白、纤维素、半纤维素、总磷、钙和灰分等含量。 根据Ovissipour等[18]的方法测定发酵前后豆粕中酸溶蛋白含量。采用氨基酸自动分析仪测定发酵前后豆粕中氨基酸含量。
1.2.5 豆粕抗原蛋白定量检测 利用间接竞争性ELISA 法测定发酵前后豆粕中大豆球蛋白和β-伴球蛋白含量,采用北京龙科方舟试剂盒进行。
1.2.6 SDS-PAGE 分析 根据植物蛋白提取试剂盒说明书提取发酵0、12、24 h 豆粕可溶性蛋白,使用Bio-Rad 蛋白定量试剂盒将上清液定量至50 μg/mL,分别配制12%分离胶和5%浓缩胶,采用稳流35 mA 电泳至蛋白进入分离胶,然后设定稳流45 mA 电泳至溴酚蓝离胶底1 cm,最后采用考马斯亮蓝染色和脱色液脱色,直至凝胶背景脱净。
1.2.7 扫描电镜观察 取发酵前后豆粕样品0.1 g 包裹于滤纸内,用2.5%戊二醛4 ℃浸泡过夜。扫描电镜观察倍数分别为1 000、1 500、3 000。
1.3 数据统计与分析
使用SPSS 软件(24.0)通过Student’st-test和单因素方差分析(ANOVA)对数据进行统计分析,各组间数据显著差异水平设定为P<0.05,数值表示为平均值±标准差。
2 结果与分析
2.1 B. velezensis CL-4 降解豆粕抗原蛋白能力测定
如图1 所示,B. velezensisCL-4 胞外上清液在大豆抗原蛋白筛选板上显示出较大直径水解圈,而生理盐水对照没有出现水解圈,初步推断B.velezensisCL-4 胞外上清液具有降解大豆抗原蛋白的能力。
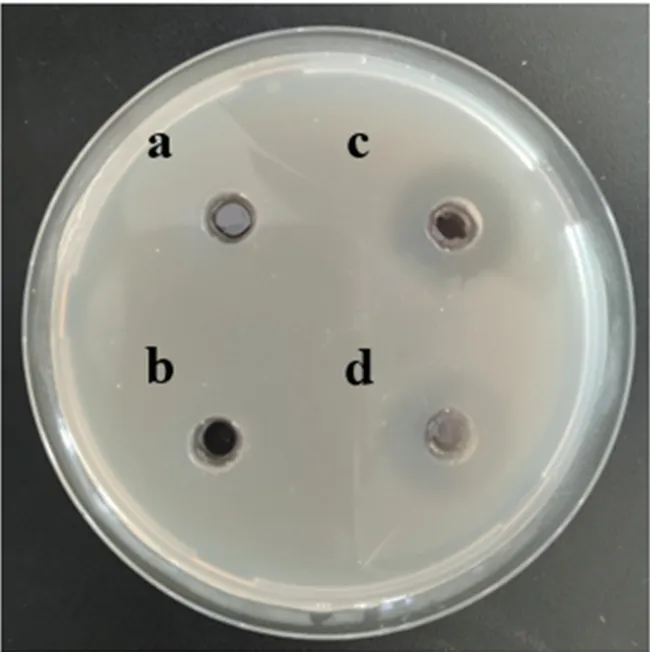
图1 B. velezensis CL-4 降解豆粕抗原蛋白能力
2.2 豆粕发酵前后营养成分比较分析
如表1 所示,与发酵前相比,B. velezensisCL-4 固态发酵24 h 后,豆粕干物质含量由93.25%±0.36%下降至92.69%±0.32%,粗蛋白含量由46.78%±0.32%增加到51.28%±0.24%,酸溶蛋白含量由5.15% ±0.04%显著提升至10.74% ±0.12%,钙、灰分和总磷含量均有所提高。 粗纤维含量显著降低,其中半纤维素含量从19.92%±0.11%下降到13.23%±0.09%,纤维素含量由7.41%±0.05%降低到5.85%±0.08%。 各种氨基酸含量均呈上升趋势,除精氨酸、蛋氨酸、丙氨酸、酪氨酸和脯氨酸外,其他必需和非必需氨基酸显著提升(P<0.05)。 与原始豆粕相比,固态发酵饲料的总氨基酸含量由41.72%±0.40%显著提高至48.14%±0.14%。 因此,B. velezensisCL-4 固态发酵可显著提高豆粕营养品质,降低粗纤维含量。
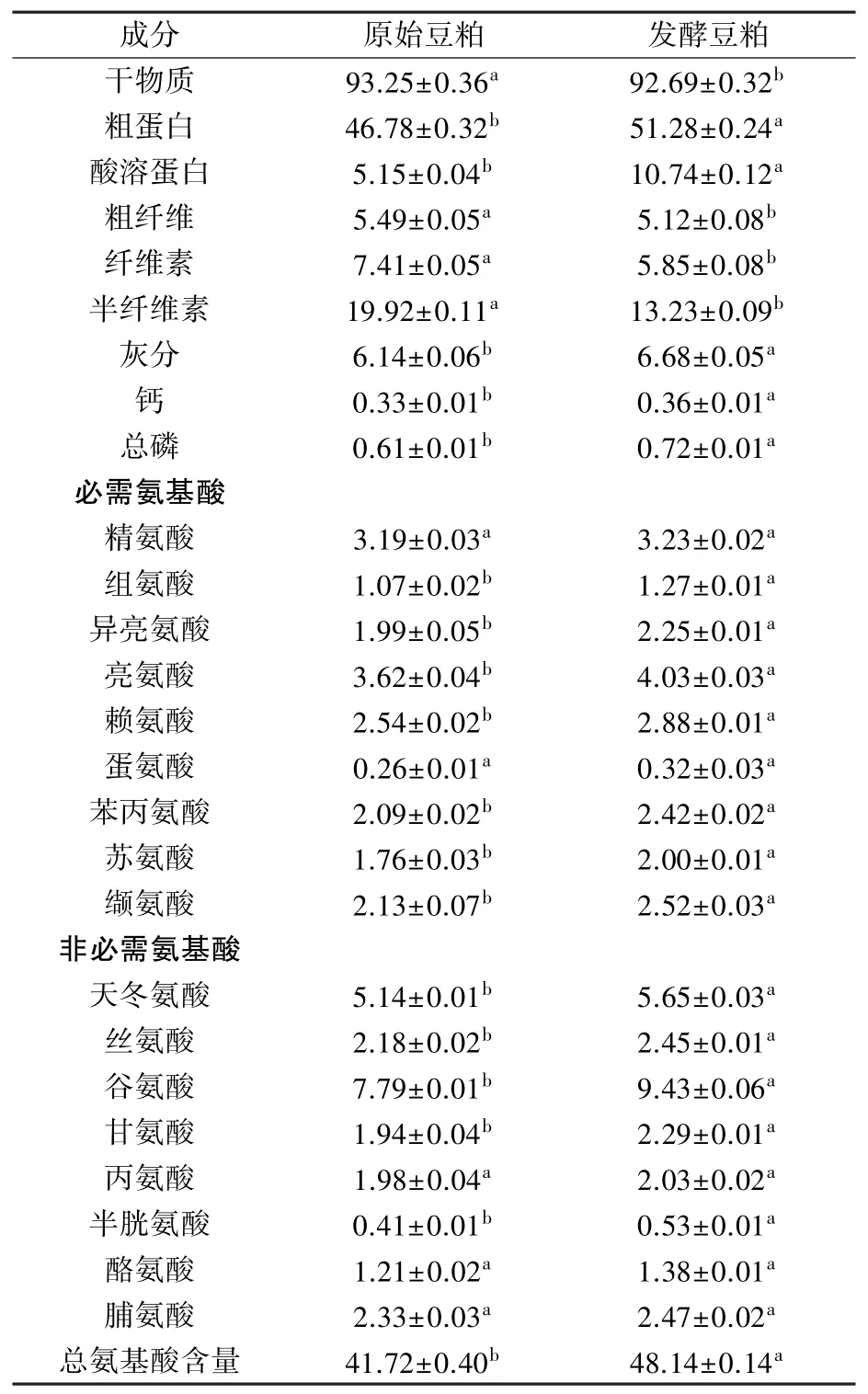
表1 B. velezensis CL-4 发酵前后豆粕营养成分分析%
2.3 发酵豆粕抗菌活性
图2显示,与未发酵豆粕的上清液相比,固态发酵24 h 后的豆粕上清液在MH 固体培养基上对金黄色葡萄球菌ATCC25923 和大肠埃希菌ATCC25922 具有明显的抑菌圈。 因此,B. velezensisCL-4 固态发酵豆粕具有一定的抗菌活性。
2.4 发酵豆粕pH 值、活菌数及酶活力变化
由表2 可知,与发酵前相比,B. velezensisCL-4 固态发酵豆粕的活菌数从(8.13±0.04) log CFU/g显著增加到(10.28±0.29) log CFU/g;pH值从6.64±0.02 小幅增加到7.01±0.05;纤维素酶活力由(7.57±0.41) U/g 提升至(18.73±1.67)U/g,木聚糖酶活力由(7.21±0.48) U/g 提升至(23.92±1.48) U/g,果胶酶活力由(5.52±0.38)U/g 上升至(14.05± 2.71) U/g,β-甘露聚糖酶活力由(6.52±0.12) U/g 提升至(17.64±0.84) U/g,中性蛋白酶活力由(7.90±0.74) U/g 提升至(235.93±10.19) U/g,各种酶活力均显著提高。
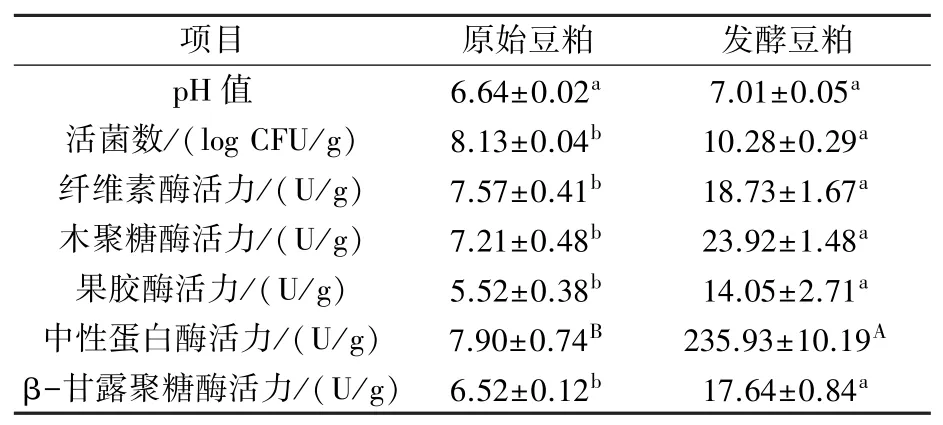
表2 B. velezensis CL-4 发酵豆粕pH 值、活菌数及酶活力变化
2.5 发酵豆粕抗原蛋白降解效果
SDS-PAGE 分析结果(图3)显示,在24 h 发酵过程中,豆粕分子量大于35 kDa 的蛋白亚基逐步降解,而15~24 kDa 的蛋白含量逐渐提高。 大豆抗原蛋白亚基中的β-伴球蛋白亚基(α 和α′)分子量在70~100 kDa 左右,发酵12 h 基本降解,而β-伴球蛋白β′亚基分子量为60 kDa 左右,于24 h 被降解。 因此,B. velezensisCL-4 固态发酵可将豆粕中大分子抗原蛋白降解成小分子肽类。
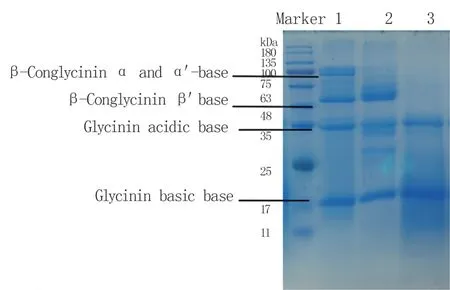
图3 B. velezensis CL-4 发酵豆粕可溶性蛋白分子量变化
ELISA 定量检测结果(表3)显示,与发酵前相比,B. velezensisCL-4 固态发酵24 h 后,豆粕中大豆球蛋白含量由(176.14±3.15) mg/g 降低至(26.58±1.22) mg/g,降解率可达84.91%;β-伴球蛋白含量由(134.66±2.24) mg/g 下降至(25.65±0.75) mg/g,降解率可达80. 95%。 表明B.velezensisCL-4 固态发酵可显著降低豆粕中大豆球蛋白和β-伴球蛋白含量。

表3 B. velezensis CL-4 发酵豆粕抗原蛋白的降解效果
2.6 发酵过程中豆粕表观形态变化
扫描电镜观察结果(图4)显示,发酵前豆粕结构紧凑、表面光滑。B. velezensisCL-4 固态发酵24 h 后,豆粕的块状结构被大量分解,呈现出碎片、破裂和多纤维素结构,表明B. velezensisCL-4固态发酵可明显改变豆粕表观形态,有效降解木质纤维素。
3 讨论与结论
豆粕来源广泛且营养丰富,是动物饲料中主要的植物源性蛋白资源。 然而,豆粕中含有多种抗营养因子,限制了其在幼龄动物日粮中的广泛应用[17]。 研究表明微生物发酵可以部分降解豆粕中抗营养因子,从而改善其营养品质[19-20]。
本研究中,抗原蛋白平板法测定验证了新型菌种B. velezensisCL-4 可降解豆粕抗原蛋白,B.velezensisCL-4 固态发酵24 h 后,豆粕中大豆球蛋白和β-伴球蛋白的降解率可分别达84.91%和80.95%。 由于原料在发酵前已经灭菌且发酵过程也是无菌的,不涉及外源或天然微生物影响,因而B. velezensisCL-4 在豆粕发酵过程中发挥主要作用。 SDS-PAGE 测定的豆粕可溶性蛋白分子量变化与酶联免疫吸附法测定的大豆球蛋白和β-伴球蛋白在发酵过程中的降解趋势一致。 此前研究也在B. velezensisCL-4 全基因组序列中检测到丝氨酸蛋白酶、氨基肽酶、金属蛋白酶等多种蛋白水解酶的基因[13]。 在酶活力检测中也发现,B.velezensisCL-4 中性蛋白酶活性显著提高,有效分解豆粕中抗原蛋白。 Wang 等[4]采用两段发酵法通过枯草芽孢杆菌CW4 和粪肠球菌CWEF 发酵豆粕和玉米混合底物,营养价值显著提高。 Yao等[21]发现枯草芽孢杆菌N-11 厌氧发酵豆粕可增加酸溶蛋白(ASP)含量,最高达到13.48%,大豆球蛋白和β-伴球蛋白分别降低82.38%和88.32%。Shi 等[2]发现在玉米-豆粕混合饲料中接种枯草芽孢杆菌B. subtilis 和屎肠杆菌E. faecium,大豆球蛋白和β-伴球蛋白的降解率分别为86.12%和77.53%。 以上研究与本试验结果一致,在后续研究中还需要通过2DE 电泳和蛋白质组学对发酵产物中的蛋白质作进一步研究。
本研究中,B. velezensis CL-4 固态发酵豆粕与原始豆粕相比含有更高含量的粗蛋白和氨基酸含量,与前人的报道一致[3,22]。 发酵过程中干物质的损失也可能导致粗蛋白和氨基酸的增加[23]。B. velezensis CL-4 可显著提高豆粕中酸溶蛋白含量主要是由于在发酵过程中,豆粕抗原蛋白或其他蛋白水解形成小分子肽和游离氨基酸[24]。 本研究中,B. velezensis CL-4 发酵豆粕对金黄色葡萄球菌ATCC25923 和大肠埃希菌ATCC25922 具有一定抑制能力,可部分替代饲料中的抗生素。
本研究中,与原始豆粕相比,发酵豆粕中纤维素和半纤维素降解率分别为21.05%和33.58%。在豆粕发酵过程中几种非淀粉多糖降解酶(纤维素酶、木聚糖酶、β-甘露聚糖酶和果胶酶)的活力均显著上升。 扫描电镜观察发现与原始豆粕相比,发酵豆粕表面结构呈现开裂和多孔结构,说明其中木质纤维素组分可能被部分降解,而这与非淀粉多糖降解酶密切相关。 此外,随着纤维素和半纤维素的降解,豆粕中蛋白组分更容易被B.velezensis CL-4 分泌的蛋白酶所分解,因此发酵豆粕可能会具有更高的养分消化率。
目前生物发酵饲料常用的发酵菌种为芽孢杆菌、乳酸菌以及酵母菌。 中国生物饲料产业创新战略联盟最新发布并实施的《发酵饲料技术通则》中明确指出发酵饲料菌种只允许添加饲料添加剂品种目录(2013 年)规定的相应菌种,可用菌种约为35 种,而欧盟食品安全局(EFSA)可利用的菌种数量可达80 余种[25]。 因而,新型发酵菌种的研发和应用急需开展。 贝莱斯芽孢杆菌菌株通常从土壤、植物根际、河流、动物肠道和发酵食品等来源分离获得[26],其相关研究集中于生物防治和促进植物生长等方面[27-28]。 贝莱斯芽孢杆菌已于2020 年被列入欧盟安全资格认定(QPS)推荐的生物制剂列表中,可作为新型发酵饲料菌种[29]。 全基因组学分析发现B. velezensis CL-4有大量编码木质纤维素降解酶的基因,其发酵产生的碳水化合物酯酶、果胶酸裂解酶和碳水化合物结合模块(CBMs)也可能影响纤维素和半纤维素降解[13]。 此外,在GH1-13[30]、FZB42[8]、ZY-1-1[31]、LS69[32]和UCMB5113[33]等B. velezensis 基因组中均发现参与降解纤维素和半纤维素的酶基因。 但有关将B. velezensis 应用于动物饲料益生菌和生物发酵饲料中的报道仍然较少。
本研究通过高产蛋白酶和木质纤维素降解酶的B. velezensis CL-4 发酵豆粕,可降解豆粕中抗营养因子(大豆抗原蛋白、纤维素和半纤维素),显著改变了原始豆粕的营养特性,提高了营养品质和功能代谢物(活菌数、酶活力以及抑菌活性),可作为新型发酵豆粕菌种,具有广阔的应用前景。
