PEDV感染过程中TRIM5α介导的自噬对病毒复制的影响
2023-10-19朱嘉乐王梓行郭嘉朱德馨魏春燕史超张伟孙志华张辉
朱嘉乐,王梓行,郭嘉,朱德馨,魏春燕,史超,张伟,孙志华,张辉
(新疆石河子大学动物科技学院,新疆 石河子 832003)
猪流行性腹泻(porcien epidemic diarrhea,PED)是由猪流行性腹泻病毒(porcien epidemic diarrhea virus,PEDV)引起的一种接触性肠道传染病,严重危害畜牧业的健康发展[1]。PEDV属于冠状病毒科α冠状病毒属成员,是一种有囊膜包被的单股正链RNA病毒[2]。仔猪感染后其临床表现为严重呕吐、腹泻、精神抑郁及食欲下降等,最后因消瘦、严重脱水而死亡[3]。
自噬是细胞内的一种降解机制,细胞通过这种机制将有毒的聚集体、受损的细胞器和感染物从细胞质中移除,或者通过将其降解达到代谢的目的。同时自噬也可作为一种促进细胞生存的机制发挥作用,负责溶酶体的降解和细胞质再循环[4]。病毒感染细胞可引起细胞自噬,自噬同样会影响病毒复制[5]。如猪瘟病毒感染可诱导细胞自噬并促进完整的自噬过程,自噬过程有利于猪瘟病毒的复制[6],同时也有研究表明,自噬可以抑制PEDV的复制[19]。
三结构域蛋白5α(tripartite motif protein 5α,TRIM5α)是TRIM蛋白家族重要成员,由RING、B-box、Coiled-coil和PRYSPRY 4个结构域组成[7],TRIM5α对猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)存在抑制作用[7],TRIM21通过核衣壳蛋白的蛋白酶体降解抑制PEDV增殖[8],但TRIM5α对PEDV的调控作用鲜有报道。
本研究利用PEDV感染Vero-E6细胞诱导细胞自噬,通过实时荧光定量技术检测TRIM5α在PEDV感染Vero-E6细胞过程中的表达量,进而通过RNA干扰技术合成TRIM5α干扰片段检测其是否会对Vero-E6细胞自噬和PEDV复制产生影响,初步证明TRIM5α通过促进Vero-E6细胞自噬并抑制PEDV在Vero-E6细胞中的复制,为揭示TRIM5α在PEDV感染Vero-E6细胞过程中发挥调控作用提供理论依据,为PED的防控和药物新靶点的开发提供新思路。
1 材料与方法
1.1 细胞与毒株
非洲绿猴肾细胞(Vero-E6)和PEDV毒株均由新疆石河子大学动物疾病防控兵团重点实验室保存。
1.2 主要试剂及仪器
DMEM basic(1×)、胰酶和胎牛血清(FBS)购自美国Gibco公司;UltraSYBR Mixture(Low ROX)荧光定量染料,Ultrapure RNA Kit超纯RNA提取试剂盒均购自康为世纪生物科技有限公司;cDNA反转录试剂盒购自北京天根生化科技(北京)有限公司;转染试剂购自上海碧云天生物技术公司;LC3A/B Rabbit mAb购自Cell Signaling Technology(CST)公司;HRP AffiniPURE Goat Anti-Rabbit IgG(H+L)购自Earthox公司;高敏性ECL化学发光检测试剂盒购自南京诺维赞生物科技股份有限公司。
1.3 引物序列设计及siRNA
根据GenBank中公布的PEDV N基因序列(MT787025.1,MW560716.1)、PEDV ORF3基因序列(MZ342899.1)、TRIM5α基因序列(AY625003.1)、GAPDH基因序列(XM_028828781.1)设计相应引物,引物由生工生物工程公司合成。TRIM5α的3条siRNA由安徽通用生物公司设计并合成(表1)。

表1 引物及干扰片段
1.4 半数组织细胞感染量(TCID50)测定
取处于对数生长期的Vero-E6细胞平铺于96孔板,将待测病毒液经10倍依次稀释,分别感染细胞。每孔感染100 μL病毒稀释液,对照孔感染100 μL稀释缓冲液。置于37 ℃、5% CO2培养箱中培养3~4 d,观察并记录96孔板中发生病变的孔数,采用Reed-Muench法测定TCID50。
1.5 PEDV感染Vero-E6细胞N基因的鉴定
取对数生长期的Vero-E6细胞,以MOI=1 PEDV接种至Vero-E6细胞,感染3~4 d后,利用RNA提取试剂盒提取总RNA。按照反转录试剂盒说明书进行反转录,以反转录cDNA作为模板,使用PEDV-N(MT787025.1)的特异性引物进行N基因的扩增。取20 mL PCR扩增产物用1%琼脂糖凝胶电泳检测,通过凝胶成像仪观察目的条带。
1.6 Western blot检测LC3Ⅱ表达水平
以MOI=1的PEDV感染Vero-E6细胞,分别在0、6、12、24、36和48 h收集被感染细胞,裂解液裂解后,12 000 r/min,离心10 min,收取上清液制备蛋白样品,用BCA法检测蛋白浓度并定量。经SDS-PAGE电泳,90 V恒压6 h,将蛋白转至PVDF膜上,5%脱脂奶粉封闭2 h,以兔抗LC3A/B单抗为一抗,以HRP 标记的山羊抗兔为二抗,ECL显色,化学发光成像仪拍照保存。
1.7 荧光定量PCR(RT-qPCR)检测TRIM5α的表达水平
以PBS为对照,分别在0、6、12、24、36和48 h后收集细胞并提取总RNA,反转录合成的cDNA。以GAPDH(XM_028828781.1)为内参基因,荧光定量PCR定量检测TRIM5α基因的mRNA表达水平(每组各3个重复)。程序设定采用三步法荧光定量PCR,荧光定量PCR反应条件:95 ℃预变形10 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,共50个循环。使用2-ΔΔCt计算TRIM5α的相对表达量。
1.8 利用RT-qPCR检测siRNA干扰效率
将siRNA-1、siRNA-2、siRNA-3分别转染Vero-E6细胞,置于37 ℃、5%CO2培养箱中继续培养48 h,利用RNA提取试剂盒提取干扰后细胞总RNA并将其反转录为cDNA。以其为模板,采用TRIM5α(AY625003.1)的定量引物对其进行相对定量检测,计算siRNA-1、siRNA-2、siRNA-3的干扰效率。
1.9 干扰TRIM5α对细胞自噬和病毒复制的影响
根据1.8结果将siRNA-2转染Vero-E6细胞并设立对照组。细胞生长至70%~80%时接种MOI=1的病毒。按照1.6方法收集被病毒感染48 h的细胞,检测LC3Ⅱ蛋白的表达水平。同时提取被病毒感染48 h细胞的总RNA,利用1.7的方法,以PEDV-N和PEDV-ORF3的定量引物检测N和ORF3基因的mRNA表达水平。通过Reed-Muench法测定干扰TRIM5α组和对照组病毒TCID50。
1.10 统计学分析
每个试验均重复3次。数据处理采用SPSS 17.0软件进行分析,采用单因素方差分析比较两组间均数差异,结果用“平均值±标准差”表示。P<0.05,差异显著,P<0.01,差异极显著。
2 结果
2.1 病毒TCID50测定
PEDV感染Vero-E6细胞后,观察并记录96孔板中发生病变的孔数,采用Reed-Muench法测定TCID50,结果见表2。
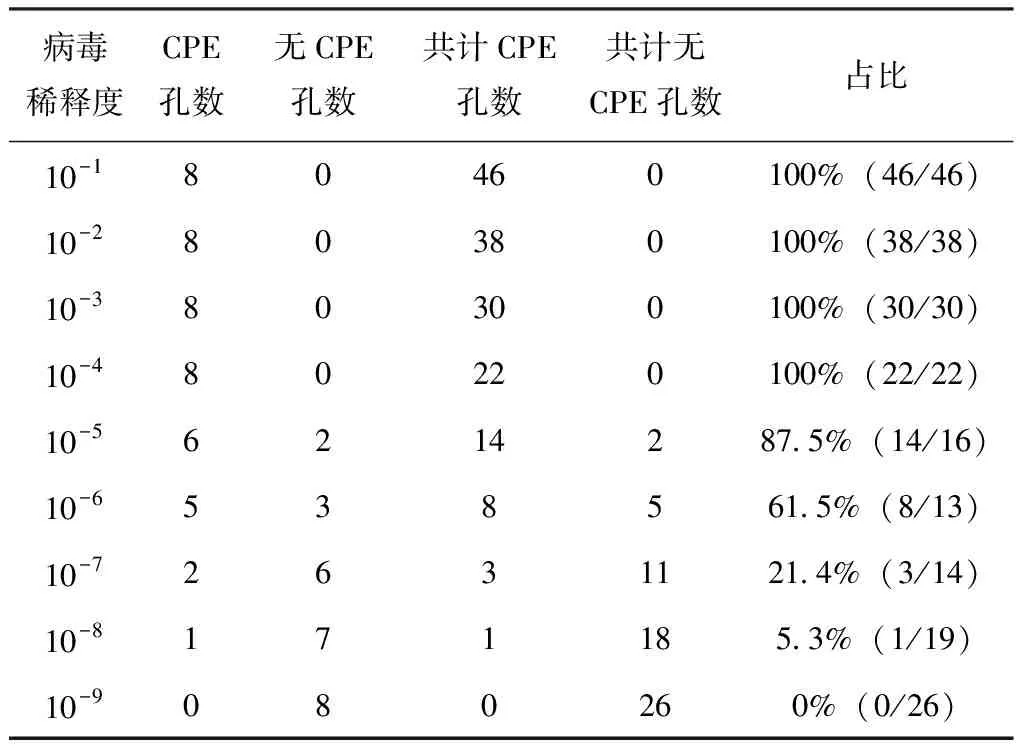
表2 PEDV TCID50的测定
距离比=(61.5-50)/(61.5-21.4)=0.3,lgTCID50=(-1)×0.3+(-6)=-6.3,所以病毒液的TCID50为10-6.3/mL。
2.2 PEDV 感染Vero细胞N基因鉴定
以MOI=1的PEDV感染Vero-E6细胞48 h后观察到明显的细胞病变,与对照组相比,接毒组的细胞呈现出表面粗糙、明显皱缩、细胞膜融合、细胞聚集成团形成合胞体及大量脱落的现象。提取细胞总RNA并将其反转录为cDNA,以其为模板,使用PEDV-N的特异性引物扩增。琼脂糖凝胶电泳结果显示在1 326 bp处出现目的条带,与预期大小一致(图1)。说明PEDV成功感染Vero-E6细胞,可用于后续试验。

M. DL2000 DNA Marker;1,2,3. N基因产物;4. 阴性对照
2.3 PEDV感染Vero-E6细胞诱导细胞自噬
PEDV感染Vero-E6细胞0、6、12、24、36、48 h后,收集总蛋白,利用Western blot检测自噬相关蛋白LC3 Ⅱ的表达情况。结果显示,LC3Ⅱ蛋白的表达量随着感染时间的增加而增多(图2A);进一步利用Image J对蛋白进行定量分析并绘制柱状图,结果显示LC3Ⅱ蛋白相对表达量在48 h最高,且与对照组相比差异显著(P<0.01),见图2B。
2.4 RT-qPCR检测TRIM5α相对表达量
用RT-qPCR检测PEDV感染Vero-E6细胞0、6、12、24、36、48 h时TRIM5α的表达情况,结果见图3。在PEDV感染Vero-E6细胞0、12、24、48 h时,TRIM5α的相对表达量逐渐升高且在48 h时表达量最高,且与PBS对照组相比差异极显著(P<0.01)。

与PBS组相比,**表示P<0.01,***表示P<0.001
2.5 干扰片段筛选及干扰后LC3Ⅱ蛋白的表达水平
转染siRNA-1、siRNA-2、siRNA-3后,RT-qPCR检测TRIM5α表达情况的结果见图4。图4A显示siRNA-2的干扰效率最高,干扰效率为 85%。Vero-E6细胞转染siRNA-2后,待细胞汇合度达到80%接种病毒时,Western blot结果显示,接毒48 h后自噬标志蛋白LC3Ⅱ的表达明显降低,自噬受到抑制(图4B)。

A. 未转染siRNA-2的PEDV感染Vero-E6细胞试验组;B. 转染siRNA-2的PEDV感染Vero-E6细胞试验组;C. PEDV N、ORF3 mRNA表达水平;D. 干扰组与对照组病毒滴度变化
2.6 干扰TRIM5α细胞病变观察和N、ORF3基因表达检测
Vero-E6细胞转染siRNA-2后,待细胞汇合度达到80%后接毒,并在接毒后48 h观察细胞病变,与未干扰组相比(图5A),干扰组细胞呈现出更加明显的细胞皱缩、细胞膜融合、细胞聚集成团形成合胞体且存在大量脱落的现象(图5B)。干扰TRIM5α后,通过RT-qPCR检测N、ORF3基因的表达。结果显示,2个基因的表达量均升高(图5C),且干扰组病毒滴度明显高于对照组(图5D),表明PEDV感染Vero-E6细胞过程中干扰TRIM5α会促进PEDV复制。
3 讨论
PEDV能使各个年龄段的猪只感染发病,尤其是对10日龄以内仔猪的感染最为严重,猪只发病率和死亡率可达100%[9]。我国从1973年开始出现有关PED的报道,1984年研究人员利用荧光标记的抗原和血清中和试验鉴定了该病的抗原,从而确定了PED在我国出现[10]。由于PEDV的S基因的高突变率和跨国传播极大地促进了该病毒突变与流行[11]。高毒力PEDV毒株传播速度快、仔猪致死率高。亚洲经典PEDV弱毒疫苗针对变异毒株的保护效果并不理想,所以新型PEDV毒株的高效疫苗的研发、新药物靶点的寻找迫在眉睫。本试验从蛋白水平出发,探究TRIM5α通过细胞自噬对PEDV复制的影响。
TRIM家族存在于所有动物体内,是包含了较多蛋白的一个相当大的家族,参与细胞周期、增殖、凋亡、分化、转移、基因表达、转录调节、信号传递、损伤修复、炎症免疫等几乎一切生命活动的调控[12]。多项研究证明,TRIM家族分子可通过多种途径调节自噬,包括调控自噬相关信号通路、调节自噬核心分子、作为自噬底物识别受体等[13]。TRIM5α 具有E3泛素连接酶活性[14],存在于细胞质中,能够抑制包括HIV-1在内的一些逆转录病毒的感染。TRIM蛋白参与了细胞的众多生命进程,在细胞自噬和病毒感染中发挥重要作用。TRIM蛋白参与了病毒和非病毒诱导的自噬过程,其中TRIM5α在自噬过程中起关键作用[15]。TRIM5α发挥其限制活性是通过识别包裹病毒基因组RNA的衣壳蛋白,从而准确靶向病毒核心。自噬因子和TRIM5α、TRIM6、TRIM16、TRIM17、TRIM20、TRIM22、TRIM49和TRIM55之间的相互作用是紧密且广泛的,并且涉及调节剂和效应物(ULK1、Beclin1、mAtg8s和p62/sequestosome1)。TRIM5α可以通过依赖于与mAtg8s相互作用的方式直接识别靶标的氨基酸序列来靶向逆转录病蛋白衣壳用于自噬降解[16]。在本试验中干扰TRIM5α的内源性表达,可导致LC3Ⅱ的表达量降低,说明TRIM5α促进自噬发生。
自噬与病毒感染的关系错综复杂,既可促进一些正链RNA病毒的复制,也可抑制单纯疱疹病毒和人类免疫缺陷病毒等病毒的复制,这与病毒的类型或宿主密切相关[17]。研究报道猪细小病毒感染ST细胞可诱发自噬并促进病毒的复制[18]。研究者用PEDV感染自噬诱导剂Rapamycin处理细胞,发现降低了PEDV滴度,而自噬抑制剂3-MA处理细胞后,提高了PEDV的滴度,表明自噬可以抑制PEDV的复制[19]。本研究证实PEDV感染Vero-E6过程中TRIM5α的干扰导致细胞自噬受到抑制,与此同时,当细胞自噬受到抑制时,PEDV的N、ORF3 2个基因的表达量上调且出现典型的细胞皱缩、细胞膜融合、细胞大量脱落等情况,初步证实了TRIM家族的抗病毒作用,同时为防控PED提供了实验基础。
综上,本研究证实TRIM5α在PEDV感染Vero-E6细胞诱导细胞自噬中发挥促进作用,干扰TRIM5α后,LC3Ⅱ蛋白的表达量明显降低,细胞自噬受到抑制,其主要机制是TRIM5α抑制PEDV在Vero-E6细胞中的复制。这一结果不仅从蛋白和mRNA水平上印证细胞自噬和PEDV感染的关系,同时也将TRIM家族和病毒复制建立联系,为抗PEDV新型药物靶点的开发奠定基础。
