电阻抗断层成像技术在ARDS患者全流程管理中的应用进展
2023-10-19邹海达张春阳高贵锋刘韶华钱何布林海徐创业
邹海达,张春阳,高贵锋,刘韶华,钱何布,林海,徐创业
1.深圳市安保医疗科技股份有限公司 广东省急救和生命支持类医疗设备工程技术研究中心,广东 深圳 518000;2.郑州大学第一附属医院 综合ICU,河南 郑州 450052;3.苏州大学附属苏州九院 急救重症科,江苏 苏州 215006;4.马鞍山市人民医院 重症医学科,安徽 马鞍山 243009
引言
急性呼吸窘迫综合征(Acute Respiratory Distress Syndrome,ARDS)是临床常见危重病症,患者ICU 入住率高且预后欠佳,其病理表现为肺毛细血管内皮细胞或者肺泡上皮细胞的弥漫性损伤,临床表现为持续性呼吸窘迫和顽固性低氧血症[1]。数据显示,ARDS 患者占ICU 收治人数的比例达到10.4%,占机械通气患者总数的23.4%,病死率高达40.0%[2]。在全球新冠病毒疫情中,重症患者占确诊总数的5%,其中超50%罹患ARDS[3]。
ARDS 肺损伤的复杂性亟需更准确高效的诊疗技术与方法,以捕捉从肺尖到肺基底的整体及区域异质性,并表征通气、通气/灌注(Ventilation/Perfusion,V/Q)的空间分布。尽管传统的技术在ARDS 患者诊疗过程中发挥重要的作用,但是难以平衡无创、实时和可视化的临床需求。电阻抗断层成像(Electrical Impedance Tomography,EIT)技术作为一种无创伤、无辐射的新型成像方法[4],可实时有效地获取患者肺通气和灌注信息,被越来越多地应用于ARDS 患者的治疗全流程管理中。本文从EIT 技术原理出发,旨在综述EIT 技术在ARDS 患者全流程管理中的应用现状,并对未来的技术发展趋势和临床应用方向进行总结,以期为临床医护人员和EIT 领域专家提供参考。
1 EIT技术原理
人体不同组织以及同一组织在不同病生理状态下的电阻抗具有显著差异,这是EIT 技术的生物学基础。EIT 能够对人体内部的电阻率分布及其动态变化进行图形化表征,具有操作简便、低成本、无创、无辐射、床旁连续监测等优势。1978 年Henderson 等[5]最早提出EIT 可以从人体体表胸腔处无创监测通气情况,揭示其在医学成像领域的应用潜力。此后,EIT 在医学上的应用被不断拓宽,涵盖胃动力评估、脑功能监测、乳腺癌筛查、血栓检测和肺功能成像等[6]。目前,肺功能成像是EIT 最主要的应用领域。EIT 通过电极阵列向患者施加安全电流激励,在体表采集响应电信号,来重构目标区域的电阻抗分布或变化图像。相较于传统CT,EIT不存在电离辐射,安全简便,尤其适用于急危重症患者机械通气的床旁实时监测。典型EIT 系统构成框架如图1 所示,主要包括电极激励采集、电源供电、微处理器控制、信号处理、人机交互等模块。
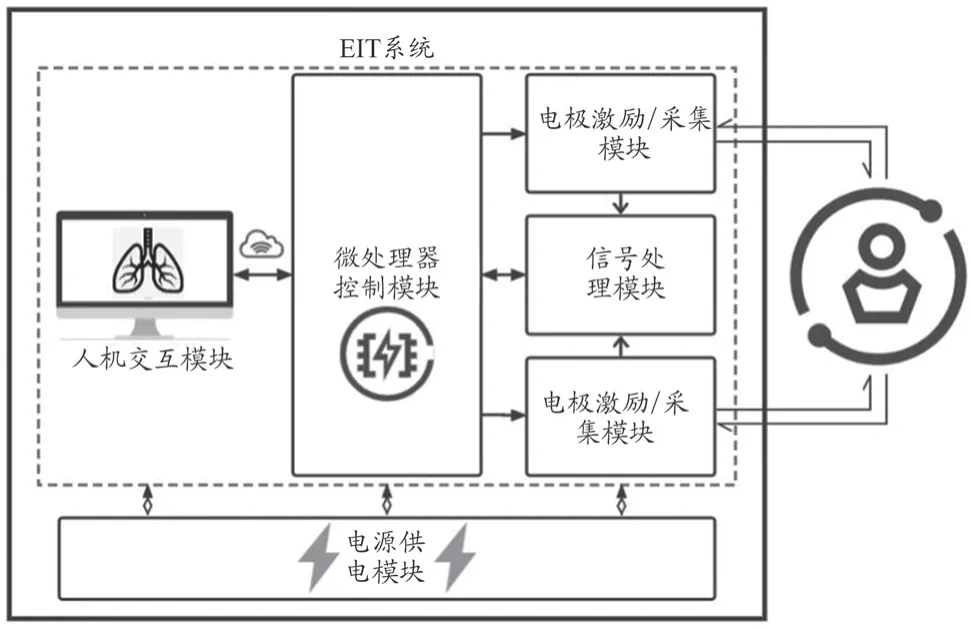
图1 典型EIT系统构成框架示意图
肺的区域异质性是ARDS 患者机械通气中的重要病理生理改变,而传统方法难以实时监测肺区通气分布与变化情况。EIT 可检测区域通气空间和时间分布状态。Mauri 等[7]通过EIT 技术测得动态呼气末肺阻抗(End-Expiratory Lung Impedance,EELI)和呼气末肺容积(End-Expiratory Lung Volume,EELV),并发现其呈线性正相关。Zhao 等[8-9]通过归一化EIT 图像各像素点对应阻抗差异的离散程度,获得整体不均一指数(Global Inhomogeneity Index,GI),以量化通气不均一程度。Spadaro 等[10]研究发现,潮气分布指数[5]可间接评估潮气通气均匀性。此外,通气时间不均匀性可通过计算区域通气延迟异质性来表征。
2 EIT监测ARDS患者疾病生理变化
2.1 EIT监测ARDS患者麻醉期间通气状态
EIT 可动态监测患者麻醉阶段通气变化,并评估不同预氧合策略的效果。局部麻醉剂对减轻ARDS 的炎症级联反应有潜在的疗效。王迪芬等[11]总结发现,对于重症肺炎合并ARDS 患者,早期麻醉干预可迅速纠正缺氧,提升危重症患者的生存率和治愈率。但麻醉诱导期间功能残气量(Functional Residual Capacity,FRC)显著降低,可引起严重低氧血症。为改善FRC,预氧合是麻醉诱导过程中的重要一环,有利于增加肺内氧储备,延长建立人工气道的时间。Humphreys 等[12]报道,择期行心脏手术的患儿中,使用EIT 监测可及时发现在麻醉诱导后FRC 的降低,并通过设置呼气终末正压(Positive End-Expiratory Pressure,PEEP)逆转该趋势。
2.2 EIT监测ARDS患者气胸
使用机械通气治疗重症ARDS 患者时,气胸并发症发生率达到13%~18%[13],严重时可危及患者生命安全。Hahn 等[14]于2006 年通过与CT 图像比对,验证EIT 可实时监测气胸。研究发现,通过比对图像的高亮与死腔,EIT 可在肺复张过程中监测气胸的存在。另外,EIT 在识别低至20 mL 气胸区域的灵敏度达到100%[15]。值得注意的是,在临床实践中,建议EIT 联合肺超声(Lung Ultrasonic,LUS)来最终确认气胸,予以后续插管治疗。
2.3 EIT识别ARDS患者呼吸钟摆现象
呼吸钟摆是指因胸膜负压非均匀传递导致肺内气体从非重力依赖区再分布到依赖区而整体潮气量保持恒定的现象,常见于ARDS 患者。Yoshida 等[16]通过EIT 动物实验揭示,吸气早期阶段的自主呼吸会引起呼吸钟摆,且钟摆体积与自主呼吸努力的强度呈正相关。肺损伤时,会在依赖肺区造成暂时性过度扩张[17]。作为区域通气可视化工具,EIT 监测技术可床旁识别钟摆现象并定量评估钟摆体积[16,18]。
2.4 EIT检测ARDS患者胸腔积液
EIT 可以帮助评估胸腔积液(Pleural Effusion,PE)的存在及其清除的有效性。在积液病变区,区域阻抗呈反相变化可以观察到EELI 的增加[18-19]。Omer 等[20]使用参数EIT 方法对比了PE 模型与正常模型间的阻抗变化,发现随着PE 体积的增大,二者阻抗变化差异显著。但需要注意的是,这种变化的诱因可能不仅是肺通气的改善,需要准确排除是否是因为电极-体表界面导电性下降的原因造成的[21]。LUS 可床旁快速评估ARDS 患者的血流动力学状态和肺部状况,EIT 图像可融合LUS 等诊断工具,丰富对ARDS 病理生理的认识。项龙等[22]采用EIT 联合LUS 共同指导小儿保护性通气策略的实施,成功救治了重度ARDS 患儿。
3 EIT指导ARDS患者治疗方案
3.1 EIT指导ARDS患者个性化PEEP滴定
PEEP 滴定不仅能减少肺不均匀性,还可能降低区域肺压,更好地实施肺保护[18],适宜的PEEP 滴定有助于避免肺损伤[23]和改善患者存活率[24]。Eronia 等[25]研究发现,利用EIT 指导个体化PEEP 滴定是可行的,可用于精确反映区域肺通气的异质性。既往动物模型研究证实,EIT 监测下GI 指导的最佳PEEP 与动态顺应性指导的最佳PEEP 无显著差异[26]。相较于传统方法(如压力/容积曲线),EIT 指导有助于从符合ARDS 病理生理改变的角度优化PEEP 设定[2],有更高的顺应性和氧合指数。目前基于EIT 的PEEP 个性化滴定方法尚无定论,除GI 法外还包括:过度膨胀/塌陷(Over Distension and Collapse,OD/CL)法、EELI 法和区域通气延迟法,其中根据OD/CL 平衡滴定PEEP 的方法在临床中最为常用[18]。
3.2 EIT监测ARDS患者肺通气与灌注
ARDS 气体交换的紊乱是由肺部通气和灌注的区域不匹配造成的。临床上区分肺通气和肺灌注尤为重要,这有助于个体化评估潜在气体交换并制定治疗方案。使用高渗氯化钠溶液造影下,EIT 可以同时对肺通气和肺灌注进行监测和评估[27],为优化V/Q 匹配提供依据。Frerichs 等[28]使用5.85%氯化钠溶液作为造影剂,阐述了EIT 和CT 在灌注监测上具有可比性。动物实验表明,在观察健康肺和塌陷肺的灌注状况方面,EIT 可通过区域阻抗-时间变化曲线定量分析区域灌注情况,与单光子发射计算机体层摄影检测结果高度一致。如Mauri 等[29]应用5%氯化钠溶液造影,使用EIT 衡量阻抗图像像素点来监测区域通气、灌注和V/Q 错配度。在高渗氯化钠溶液造影肺灌注术中,EIT 不仅有效,而且高度安全,在国内外临床使用中未见不良反应报道[30]。
3.3 EIT观察ARDS患者氧疗效果
高流量氧疗(High-Flow Nasal Cannula,HFNC)是ICU 呼吸衰竭患者的新型呼吸支持方式,较无创通气具有更好的舒适性和耐受性[18]。研究表明,HFNC 失败病例中再插管率或病死率在30%~50%,并且临床上缺乏标准的参数用于有效评估HFNC 疗效[31]。Spadaro 等[10]研究发现,ΔEELI、潮气阻抗、EELV 与潮气量具有明确的相关性。在一项健康志愿者研究中,通过EIT 技术发现HFNC 可以增加EELI、FRC 并降低呼吸频率[32]。Basile 等[33]的研究也佐证了EIT 可实时有效观察HFNC疗效,结果表明,患者经HFNC 治疗后,肺通气异质性降低、EELV 增加、呼吸频率下降。同时,EIT 可实时有效监测HFNC 应用于ARDS 患者的个性化疗效,有效识别HFNC 对重力依赖区通气改善的潜能,为优化HFNC 治疗方案提供新的思路[18]。
3.4 EIT指导ARDS患者俯卧位通气
俯卧位通气是ARDS 患者重要且常用的治疗手段之一,约占ARDS 有创通气病例的8%,占重度ARDS 患者的16.3%[3]。俯卧位通气对肺背侧的复张作用显著超于肺腹侧的萎陷影响,有助于V/Q 匹配的改善,进而改善整体氧合水平,提高存活率。EIT 可从不同维度评估俯卧位治疗的作用效应[18]。Perier 等[34]使用EIT 比较了新冠病毒相关ARDS 患者与非新冠病毒相关ARDS患者分别在仰卧位和俯卧位下PEEP 滴定,发现俯卧位时的最佳PEEP 与仰卧位无明显差异,但可显著提高氧合水平。一项队列研究表明,俯卧位通气下EELI 分布均匀,腹侧和背侧肺区无明显差异[32]。Bachmann 等[35]用EIT 获取阻抗比和GI,为个体化俯卧位通气提供有效信息。EIT 还能确定俯卧位通气持续时间。Kotani 等[36]成功根据EIT 参数选择能够维持背侧肺泡肺开放的最小PEEP 以及俯卧位通气终止时机。
3.5 EIT指导体外膜氧合时肺保护通气策略
作为危及生命的低氧血症的补救性疗法,静脉体外膜氧合(Veno-Venous Extracorporeal Membrane Oxygenation,VV-ECMO)可以支持重度ARDS 患者气体交换,挽救难治性ARDS 患者的生命。Papazian 等[37]强烈建议,当重度ARDS 患者氧合过低(PaO2/FiO2<80 mmHg)时,应当及时考虑ECMO 治疗。两项回顾性对照研究[38-39]表明,对甲型H1N1 相关ARDS 患者应用VV-ECMO 疗法是有益的。Combes 等[40]通过多中心随机试验研究发现,ECMO 并发症发生频率低,仅观察到较少卒中病例。Goligher 等[41]进一步探索发现,ECMO 在降低ARDS患者病死率方面具有巨大潜力。由于气体交换评价指标很难在ECMO 患者上获得,以往基于氧合的肺可复张性评估和PEEP 滴定难以操作,而EIT 可免受上述限制[2]。一项单中心研究表明,EIT 监测可了解ECMO 联合俯卧位通气对局部通气及最佳PEEP 的影响,有助于指导ECMO 时肺保护同期策略[42]。
4 EIT辅助ARDS患者撤机康复
4.1 EIT指导ARDS患者撤机
自主呼吸试验用于撤机评估尚存在局限性,而EIT技术可以得到GI、ΔEELI 和吸气相气体分布参数,有助于预测撤机结局。早期活动是缩短ARDS 患者通气时间、改善临床结局的有效方式。周润奭等[43]对20 例需进行早期活动的ARDS 脱机困难患者进行分析,发现EIT 表征的感兴趣区4 区通气变化与血氧饱和度SpO2存在关联性,其结果揭示了EIT 有助于降低护士床旁评估早期活动的难度,进而辅助脱机困难患者撤机。
4.2 EIT改善ARDS患者预后与康复训练
ARDS 患者的预后由多重因素决定。EIT 监测涵盖了丰富的肺信息,依据肺的生理特点制定个体化的通气策略有望改善ARDS 患者的预后[27,44]。肺康复(Pulmonary Rehabilitation,PR)是指全面评估患者病情后制定的患者个性化的综合干预疗法,可贯穿ARDS 患者治疗全程[45]。EIT 可就临床症状、病情恢复、身体机能恢复等方面评价ARDS 患者PR 训练效果,有助于PR 决策。
5 总结与展望
EIT 可以对肺部生理信息进行功能性成像,并具有便携、无辐射特性,应用于ARDS 患者全流程管理的临床价值已经得到充分证实。同时,EIT 技术还存在一些局限性:① 受限于电极位点数量,其空间分辨率较低,无法提供精确的区域组织解剖学定位;② 成像效果受电极缚带、适用人群、体位姿势等诸多因素制约,且目前大多研究局限在某一断面的二维成像;③ 需床旁CT、LUS 等其他图像诊断工具配合以发挥最佳临床价值。
EIT 技术发展以及指导ARDS 患者治疗的研究方向包括以下几个方面:① 技术上,迭代优化EIT 系统设计,基于人工智能和大数据分析提高成像速度与成像质量,辅助定位病灶;② 算法上,结合新的图像重建算法,实现胸腔三维可视化,为临床研究及应用提供更多有效生理信息;③ 产品上,将EIT 核心算法模块化并与现有呼吸机、麻醉机、监护仪等设备匹配,既扩大EIT 应用时机,又有效节约ICU 有限空间;④ 功能上,建立EIT 与呼吸机等治疗设备的联动,形成机械通气治疗-质量监测-效果反馈-方案调整的个性化方案;⑤ 成本上,开发具有自主知识产权的EIT 系统和核心零部件,突破国外产品和技术垄断,降低医疗成本的同时,实现国产高端医疗设备自主可控;⑥ 应用上,依据现有应用案例和经验,扩展EIT 在ARDS 患者诊疗中的应用,以及其他需要机械通气支持的疾病中。
综上所述,随着技术和产品的发展,人们对EIT 及其应用将愈发成熟,最终为实现基于EIT 指导的ARDS患者个体化、精细化全流程管理带来新的契机。
